
第七章 酶 一、教学目的与要求 1、掌握酶的催化原理及特性。 2、掌握酶促反应实质及影响因素。 3、了解各种酶的功能。 二、教学重点与难点 重点:1、酶的催化特性 2、影响酶促反应的因素 难点:酶的作用机制—中间产物学说 三、课时安排与教学方法 教学内容 (计划/实 际) 课时数 课程类型/ 教学方法 第一节 酶的概述 2/ 理论/ 第二节 酶的结构和作用机制 1/ 理论/ 第三节 影响酶促反应的因素 2/ 理论/ 第四节 重要的酶类 1/ 理论/ 合计 6/ 四、教学过程 第七章 酶 生命过程的基本特点就是新陈代谢。新陈代谢过程包含着许多复杂而有规律的物质变化和能量 变化。人、动物和植物在新陈代谢中的一切化学反应,不需要高温高压或强烈的酸碱条件,就很容 易地在一切生物体内进行。其中必须要有一种奇特的物质参加,这就是酶。酶与烹饪的关系很密切。 如动物屠宰后,酶的作用可使肉嫩化,改善肉类原料的风味和质构。又如蔬菜、水果在成熟过程中, 由于酶的作用可使其具有一定的色香味等。 激素是生物体产生的代谢调节物质,通过体液或细胞外液运送到特定作用部位,从而引起特殊 激动效应(调节控制各种物质代谢或生理功能)的一群微量的有机化合物。因此,也可以把这类化学 物质看作生物体内的“化学讯息”。目前有些激素已可通过人工合成得到,但主要来源仍然是作为 “下脚料”的动物腺体。 第一节 酶的概述 酶:酶是由生物体活细胞产生,在细胞内、外均能起催化作用并且有高度专一性的特殊蛋白质。 酶促反应:酶所催化的反应叫酶促反应。 底物:在酶促反应中被催化的物质称为底物。 产物:反应的生成物称为产物。 酶活性:酶所具有的催化能力称为酶活性。 酶的激活:使酶获得活性的过程叫酶的激活。 酶的失活:使酶失去活性的过程叫失活。 一、酶的催化特性 催化剂的通性:只能影响化学反应速度,而不改变反应的平衡点,并在反应前后本身不发生变化, 在热力学规律的限制下起催化作用。 酶催化剂的特性:
第七章 酶 一、教学目的与要求 1、掌握酶的催化原理及特性。 2、掌握酶促反应实质及影响因素。 3、了解各种酶的功能。 二、教学重点与难点 重点:1、酶的催化特性 2、影响酶促反应的因素 难点:酶的作用机制—中间产物学说 三、课时安排与教学方法 教学内容 (计划/实 际) 课时数 课程类型/ 教学方法 第一节 酶的概述 2/ 理论/ 第二节 酶的结构和作用机制 1/ 理论/ 第三节 影响酶促反应的因素 2/ 理论/ 第四节 重要的酶类 1/ 理论/ 合计 6/ 四、教学过程 第七章 酶 生命过程的基本特点就是新陈代谢。新陈代谢过程包含着许多复杂而有规律的物质变化和能量 变化。人、动物和植物在新陈代谢中的一切化学反应,不需要高温高压或强烈的酸碱条件,就很容 易地在一切生物体内进行。其中必须要有一种奇特的物质参加,这就是酶。酶与烹饪的关系很密切。 如动物屠宰后,酶的作用可使肉嫩化,改善肉类原料的风味和质构。又如蔬菜、水果在成熟过程中, 由于酶的作用可使其具有一定的色香味等。 激素是生物体产生的代谢调节物质,通过体液或细胞外液运送到特定作用部位,从而引起特殊 激动效应(调节控制各种物质代谢或生理功能)的一群微量的有机化合物。因此,也可以把这类化学 物质看作生物体内的“化学讯息”。目前有些激素已可通过人工合成得到,但主要来源仍然是作为 “下脚料”的动物腺体。 第一节 酶的概述 酶:酶是由生物体活细胞产生,在细胞内、外均能起催化作用并且有高度专一性的特殊蛋白质。 酶促反应:酶所催化的反应叫酶促反应。 底物:在酶促反应中被催化的物质称为底物。 产物:反应的生成物称为产物。 酶活性:酶所具有的催化能力称为酶活性。 酶的激活:使酶获得活性的过程叫酶的激活。 酶的失活:使酶失去活性的过程叫失活。 一、酶的催化特性 催化剂的通性:只能影响化学反应速度,而不改变反应的平衡点,并在反应前后本身不发生变化, 在热力学规律的限制下起催化作用。 酶催化剂的特性:

(一)具有很高的催化效率 酶的催化效率极高,可比一般催化剂高106~1013倍。 例如,1分子过氧化氢酶,每分钟可催化5×106个过氧化氢分子分解为水和氧,比铁粉催化过氧 化氢分解的效率高1010倍。又如,1g 结晶的细菌α-淀粉酶在56℃、15min内可使2吨淀粉水解为糊精。 酶催化反应的高效率是长期以来最引人注目的研究课题之一,它不仅有很高的理论意义,而且也 具有重要的实际意义。 (二)高度的专一性 酶对其所催化物质的选择性比其它催化剂严格得多。 例如,氢离子可以催化淀粉、脂肪和蛋白质等物质的水解,对其催化物质并无特殊要求。而酶则 不然,β-淀粉酶只能催化淀粉水解生成麦芽糖,而不能催化麦芽糖水解成葡萄糖。蛋白酶只能催化 蛋白质水解,而不能催化其它物质水解。 一种酶只能作 用于一类化合物,或作用 于一定的化学键或一种立体异 构体,从而产生一定的产 物。这种现象就 称 为 酶 的专一性 或特异性。 (三)反应条件温和 酶催化的反应是在常温、常压和近中性的溶液条件下进行。酶本身是蛋白质,故强酸、强碱、高 温、高压、紫外线、重金属盐等一切导致蛋白质不可逆变性的因素,都能使酶受到破坏而丧失其催化 活性。 (四)酶的活性是被调节控制的 生命现象表示了它内部化学反应历程的有序性。这种有序性是受多方面的因素调节和控制的。正 是因为受这些因素的调控,酶在生物体 内才 能准确 地行 使它的 催化 功能, 才能 使生命 活动 有条 不紊地进行。 二、酶的命名 酶的命名有习惯命名和系统命名两种方法。 (一)习惯命名 1、绝大多数酶是根据其所催化的底物命名的,如催化水解淀粉的称为淀粉酶,催化水解蛋白质 的称为蛋白酶等。 2、某些酶根据其所催化的反应性质来命名,如水解酶、脱氢酶、氧化酶、转移酶、异构酶等。 3、有的酶结合上述两个原则来命名,例如琥珀酸脱氢酶是根据其作用底物是琥珀酸和所催化的 反应为脱氢反应而命名的。 4、在这些命名的基础上有时还加上酶的来源和其它特点以区别同一类酶。如胃蛋白酶和胰蛋白 酶,指明其来源不同。碱性磷酸酶和酸性磷酸酶则指出这两种磷酸酶所要求的酸碱度不同等。 习惯命名比较简单,应用历史较长,但缺乏系统性,随着被认识的酶的数目日益增多,而出现许 多问题。例如一酶数名或一名数酶。也有些酶命名不甚合理。为了适应酶学发展的新情况,避免命名 的重复和混乱,国际酶学委员会于1961年提出了一个新的系统命名及系统分类的原则,已为国际生化 协会所采用。 (二)系统命名 按照国际系统命名法原则,每一种酶有一个系统名称和习惯 名称。习惯名称应简单,便于使用,系统名称应明确标明酶的底物及催化反应的性质。 系统命名原 则 : 1、列出底物 , 并 用 “:”隔开。 2、指明反应 性 质 。 如上例中应将两个底物 “ L-丙 氨 酸 ”及 “α-酮戊二酸 ”同时列出,并用 “:”将它们隔开。 它 所 催 化 的 反 应 性质 为 氨 基 转 移 ,也 需 要 指 明 ,所 以 它 的 系 统 名 称 为 “L -丙 氨 酸 :α -酮 戊 二酸氨基转 移 酶”。 3、若底物之 一 是 水 时 , 可 将 水 略 去 不写 。 如乙酰辅酶A水解酶(习惯命名 ),可 以 写 成 乙 酰 辅 酶A:水解酶 (系统命名),而 不 必 写 成 乙酰辅酶A:水水解酶。 4、底物的名 称 必 须 确 切 。 例如若有不 同 构 型, 则 必 须 注 明 L-、 D-型及α-、 β -型 等。现举例如下表7-1所示。 表 7-1 酶 命 名法举例 习惯名称 系 统 名 称 催 化 反 应
(一)具有很高的催化效率 酶的催化效率极高,可比一般催化剂高106~1013倍。 例如,1分子过氧化氢酶,每分钟可催化5×106个过氧化氢分子分解为水和氧,比铁粉催化过氧 化氢分解的效率高1010倍。又如,1g 结晶的细菌α-淀粉酶在56℃、15min内可使2吨淀粉水解为糊精。 酶催化反应的高效率是长期以来最引人注目的研究课题之一,它不仅有很高的理论意义,而且也 具有重要的实际意义。 (二)高度的专一性 酶对其所催化物质的选择性比其它催化剂严格得多。 例如,氢离子可以催化淀粉、脂肪和蛋白质等物质的水解,对其催化物质并无特殊要求。而酶则 不然,β-淀粉酶只能催化淀粉水解生成麦芽糖,而不能催化麦芽糖水解成葡萄糖。蛋白酶只能催化 蛋白质水解,而不能催化其它物质水解。 一种酶只能作 用于一类化合物,或作用 于一定的化学键或一种立体异 构体,从而产生一定的产 物。这种现象就 称 为 酶 的专一性 或特异性。 (三)反应条件温和 酶催化的反应是在常温、常压和近中性的溶液条件下进行。酶本身是蛋白质,故强酸、强碱、高 温、高压、紫外线、重金属盐等一切导致蛋白质不可逆变性的因素,都能使酶受到破坏而丧失其催化 活性。 (四)酶的活性是被调节控制的 生命现象表示了它内部化学反应历程的有序性。这种有序性是受多方面的因素调节和控制的。正 是因为受这些因素的调控,酶在生物体 内才 能准确 地行 使它的 催化 功能, 才能 使生命 活动 有条 不紊地进行。 二、酶的命名 酶的命名有习惯命名和系统命名两种方法。 (一)习惯命名 1、绝大多数酶是根据其所催化的底物命名的,如催化水解淀粉的称为淀粉酶,催化水解蛋白质 的称为蛋白酶等。 2、某些酶根据其所催化的反应性质来命名,如水解酶、脱氢酶、氧化酶、转移酶、异构酶等。 3、有的酶结合上述两个原则来命名,例如琥珀酸脱氢酶是根据其作用底物是琥珀酸和所催化的 反应为脱氢反应而命名的。 4、在这些命名的基础上有时还加上酶的来源和其它特点以区别同一类酶。如胃蛋白酶和胰蛋白 酶,指明其来源不同。碱性磷酸酶和酸性磷酸酶则指出这两种磷酸酶所要求的酸碱度不同等。 习惯命名比较简单,应用历史较长,但缺乏系统性,随着被认识的酶的数目日益增多,而出现许 多问题。例如一酶数名或一名数酶。也有些酶命名不甚合理。为了适应酶学发展的新情况,避免命名 的重复和混乱,国际酶学委员会于1961年提出了一个新的系统命名及系统分类的原则,已为国际生化 协会所采用。 (二)系统命名 按照国际系统命名法原则,每一种酶有一个系统名称和习惯 名称。习惯名称应简单,便于使用,系统名称应明确标明酶的底物及催化反应的性质。 系统命名原 则 : 1、列出底物 , 并 用 “:”隔开。 2、指明反应 性 质 。 如上例中应将两个底物 “ L-丙 氨 酸 ”及 “α-酮戊二酸 ”同时列出,并用 “:”将它们隔开。 它 所 催 化 的 反 应 性质 为 氨 基 转 移 ,也 需 要 指 明 ,所 以 它 的 系 统 名 称 为 “L -丙 氨 酸 :α -酮 戊 二酸氨基转 移 酶”。 3、若底物之 一 是 水 时 , 可 将 水 略 去 不写 。 如乙酰辅酶A水解酶(习惯命名 ),可 以 写 成 乙 酰 辅 酶A:水解酶 (系统命名),而 不 必 写 成 乙酰辅酶A:水水解酶。 4、底物的名 称 必 须 确 切 。 例如若有不 同 构 型, 则 必 须 注 明 L-、 D-型及α-、 β -型 等。现举例如下表7-1所示。 表 7-1 酶 命 名法举例 习惯名称 系 统 名 称 催 化 反 应

谷丙转氨酶 己糖激酶 L-丙氨酸:α-酮戊二酸氨基转移酶 ATP:己糖磷酸基转移酶 L-丙氨酸+α-酮戊二酸→丙酮酸+L-谷氨酸 ATP+葡萄糖→6-磷酸葡萄糖+ADP 三、酶的分 类 国际系统分 类 法 将所 有 的 酶 促 反 应 按 反 应 性 质 分 为 六 大 类。 (一)氧化还原酶类 氧化还原酶类催化氧化还原反应。 反应通式: A·2H + B ==== A + B·2H 2H2 O2 ==== 2H2 O + O2 如乳酸脱氢酶、琥珀酸脱氢酶、细胞色素氧化酶 (二)转移酶类 转移酶类催化分子间基团的转移反应。 反应通式: AB + C ==== A + BC 如转氨酶、转甲基酶等。 (三)水解酶类 水解酶类催化水解反应。 反应通式: AB + HOH ==== AOH + BH 如唾液淀粉酶、胃蛋白酶、核酸酶、脂酶等 (四)裂解酶(裂合酶或脱加酶)类 裂解酶类催化非水解地从底物上移去一个基团的反应或其逆反应。 催化一种化合物分裂为两种化合物的反应 反应通式: AB ==== A + B 或催化有两种化合物合成一种化合物的反应 反应通式: A + B ==== AB 如醛缩酶、柠檬酸合成酶。 果糖-1,6-2P ⎯醛缩酶 ⎯⎯→ 磷酸二羟基丙酮+3-磷酸甘油 (五)异构酶类 异构酶类催化各种同分异构体的相互转变。 反应通式: A ==== B 如磷酸葡萄糖异构酶、磷酸甘油酸磷酸变位酶等。 G-1-P ⎯磷酸葡萄糖异构酶 ⎯⎯⎯ ⎯→ G-6-P(6-磷酸葡萄糖) 3-磷酸甘油酸 ⎯磷酸甘油酸磷酸变位酶 ⎯⎯⎯⎯⎯⎯→ 2-磷酸甘油酸 (六)合成酶类(或称连接酶类) 合成酶类催化两个分子合成一个分子的反应,合成过程中伴 有ATP分解的酶类。 反应通式: A + B + ATP ==== AB + ADP + Pi 如谷氨酰胺合成酶、谷胱甘肽合成酶、CTP合成酶等。 在科技文献中,为严格起见,一般使用酶的系统名称,但是因某些系统名称太长,为了方便 起见,有时仍使用酶的习惯名称。 四、酶的化学本质及组成 (一)酶的化学本质 关于酶是否为蛋白质,曾有过争论,自20世纪30年代科学家获得了蛋白酶的结晶以后,酶是蛋白 质的观点才逐渐被接受。随着研究的深入,特别是1969年核糖核酸酶的合成成功,更充分地证明―― 酶的化学本质就是蛋白质。 归纳起来,酶是蛋白质的证据有: ①酶的元素组成和含氮量与蛋白质相同。一般蛋白质的元素组成是C、H、O、N四大主要元素,它 们的含量依次是50%~52%,6.8%~7.7%,22%~28%,15%~18%。酶的元素组成与含量与其相 似,特别是含氮量。 ②化学结构与空间构象与蛋白质相同。酶同蛋白质一样,都是由氨基酸以肽键形成肽链,并且有 二级、三级或四级的空间构象。维持构象的次级键也与蛋白质一样容易受到理化因素的影响而使酶变 性,酶变性后活性消失。 ③酶两性离子的性质与蛋白质相同。酶与蛋白质一样,在不同的酸碱溶液中呈现不同的离子状态。 在电场中,这些大分子常聚集于电极的一端,当不移向任何一端时则为等电点,溶解度此时表现为最
谷丙转氨酶 己糖激酶 L-丙氨酸:α-酮戊二酸氨基转移酶 ATP:己糖磷酸基转移酶 L-丙氨酸+α-酮戊二酸→丙酮酸+L-谷氨酸 ATP+葡萄糖→6-磷酸葡萄糖+ADP 三、酶的分 类 国际系统分 类 法 将所 有 的 酶 促 反 应 按 反 应 性 质 分 为 六 大 类。 (一)氧化还原酶类 氧化还原酶类催化氧化还原反应。 反应通式: A·2H + B ==== A + B·2H 2H2 O2 ==== 2H2 O + O2 如乳酸脱氢酶、琥珀酸脱氢酶、细胞色素氧化酶 (二)转移酶类 转移酶类催化分子间基团的转移反应。 反应通式: AB + C ==== A + BC 如转氨酶、转甲基酶等。 (三)水解酶类 水解酶类催化水解反应。 反应通式: AB + HOH ==== AOH + BH 如唾液淀粉酶、胃蛋白酶、核酸酶、脂酶等 (四)裂解酶(裂合酶或脱加酶)类 裂解酶类催化非水解地从底物上移去一个基团的反应或其逆反应。 催化一种化合物分裂为两种化合物的反应 反应通式: AB ==== A + B 或催化有两种化合物合成一种化合物的反应 反应通式: A + B ==== AB 如醛缩酶、柠檬酸合成酶。 果糖-1,6-2P ⎯醛缩酶 ⎯⎯→ 磷酸二羟基丙酮+3-磷酸甘油 (五)异构酶类 异构酶类催化各种同分异构体的相互转变。 反应通式: A ==== B 如磷酸葡萄糖异构酶、磷酸甘油酸磷酸变位酶等。 G-1-P ⎯磷酸葡萄糖异构酶 ⎯⎯⎯ ⎯→ G-6-P(6-磷酸葡萄糖) 3-磷酸甘油酸 ⎯磷酸甘油酸磷酸变位酶 ⎯⎯⎯⎯⎯⎯→ 2-磷酸甘油酸 (六)合成酶类(或称连接酶类) 合成酶类催化两个分子合成一个分子的反应,合成过程中伴 有ATP分解的酶类。 反应通式: A + B + ATP ==== AB + ADP + Pi 如谷氨酰胺合成酶、谷胱甘肽合成酶、CTP合成酶等。 在科技文献中,为严格起见,一般使用酶的系统名称,但是因某些系统名称太长,为了方便 起见,有时仍使用酶的习惯名称。 四、酶的化学本质及组成 (一)酶的化学本质 关于酶是否为蛋白质,曾有过争论,自20世纪30年代科学家获得了蛋白酶的结晶以后,酶是蛋白 质的观点才逐渐被接受。随着研究的深入,特别是1969年核糖核酸酶的合成成功,更充分地证明―― 酶的化学本质就是蛋白质。 归纳起来,酶是蛋白质的证据有: ①酶的元素组成和含氮量与蛋白质相同。一般蛋白质的元素组成是C、H、O、N四大主要元素,它 们的含量依次是50%~52%,6.8%~7.7%,22%~28%,15%~18%。酶的元素组成与含量与其相 似,特别是含氮量。 ②化学结构与空间构象与蛋白质相同。酶同蛋白质一样,都是由氨基酸以肽键形成肽链,并且有 二级、三级或四级的空间构象。维持构象的次级键也与蛋白质一样容易受到理化因素的影响而使酶变 性,酶变性后活性消失。 ③酶两性离子的性质与蛋白质相同。酶与蛋白质一样,在不同的酸碱溶液中呈现不同的离子状态。 在电场中,这些大分子常聚集于电极的一端,当不移向任何一端时则为等电点,溶解度此时表现为最

低。 ④酶的胶体性质与蛋白质相同。酶与蛋白质一样是大分子胶体化合物,不能透过半透膜。 ⑤酶的其它性质也与蛋白质相同。酶所具有的酸碱性质、降解作用、颜色反应(如双缩脲反应等)、 变性反应等理化性质与蛋白质相同。 以上所述这些现象都充分说明酶的化学本质是蛋白质。 (二)酶的组成 酶也与一般蛋白质一样,种类很多。根据许多精密的研究结果,按其化学结构来划分,可归纳为 两类组成:单纯蛋白酶和结合蛋白酶。 1、单纯蛋白酶 单纯蛋白酶又称单成分酶,其组成是由单纯蛋白质构成的。所以单纯蛋白酶水 解的终产物是氨基酸,再无其它物质。大多数水解酶都是单纯蛋白酶。如胃蛋白酶、脲酶、木瓜蛋白 酶等。 组成:单纯蛋白质 水解产物:氨基酸 实例:水解酶――胃蛋白酶、脲酶、木瓜蛋白酶等 2、结合蛋白酶 结合蛋白酶又称双成分酶。这些酶除含有蛋白质以外,还有其它非蛋白质成分。 结合蛋白酶的蛋白质部分称酶蛋白,非蛋白质部分称活性基或辅助因子。结合蛋白酶 必须是两部 分结合 起 来 组 成的全酶 才具有催化活性。全酶的任何一部分单独存在都不具有催化活性。 全酶(结合酶)=酶蛋白+活性基(辅酶或辅基) 在结合酶中,根据活性基与酶蛋白结合的松紧程度,活性基又辅酶与辅基之分。 辅基:与酶蛋白结合紧密,用透析法不易除去的活性基称辅基;辅酶:与酶蛋白结合疏松,易 被透析法除去的活性基称辅酶。活性基的成分有两类: 一类是低分子有机化合物如NAD、NADP、FAD、FMN等, 一类是无机金属离子,如Fe3+ 、Cu2+ 、Zn2 +、Mn2+ 等。 NAD(辅酶Ⅰ) 烟酰胺-核糖-磷酸-磷酸-核糖-腺嘌呤 NADP(辅酶Ⅱ)烟酰胺-核糖-磷酸-磷酸-核糖-腺嘌呤 │ 磷酸 FAD(黄素腺嘌呤二核苷酸) 异咯嗪-核醇-磷酸-磷酸-核糖-腺嘌呤 FMN(磷酸核黄素 黄素单核苷酸) 异咯嗪-核醇-磷酸 第二节 酶的结构和作用机制 一、酶的活性中心 (一)酶的活性中心 酶与底物的结合不是随意的,酶分子有一定的区域与底物相合,这一区域的一些基团还直接参 与化学键的形成与断裂。这一特定区域称为酶的活性中心。 (二)酶的必需基团 存在于酶的活性中心的,直接参与化学键的形成与断裂的,与酶的催化活性密切相关基团,称 为酶的必需基团。 活性中心内的必需基团分为两种: 结合基团:其中与底物结合的称为结合基团, 催化基团:促进底物发生化学变化的称为催化基团。 有些必需基目兼有这两种作用。既是结合基团又是催化基团。 (三)活性中心的作用 活性中心是酶起专一性催化作用的关键部位。当活性中心被占据或空间结构被破坏时,酶就失 去作用。 (四)非活性中心的作用 酶分子中非活性中心部分也有着一定的作用。 1、维持酶的空间结构。 2、与免疫功能有关等等。 二、酶原激活
低。 ④酶的胶体性质与蛋白质相同。酶与蛋白质一样是大分子胶体化合物,不能透过半透膜。 ⑤酶的其它性质也与蛋白质相同。酶所具有的酸碱性质、降解作用、颜色反应(如双缩脲反应等)、 变性反应等理化性质与蛋白质相同。 以上所述这些现象都充分说明酶的化学本质是蛋白质。 (二)酶的组成 酶也与一般蛋白质一样,种类很多。根据许多精密的研究结果,按其化学结构来划分,可归纳为 两类组成:单纯蛋白酶和结合蛋白酶。 1、单纯蛋白酶 单纯蛋白酶又称单成分酶,其组成是由单纯蛋白质构成的。所以单纯蛋白酶水 解的终产物是氨基酸,再无其它物质。大多数水解酶都是单纯蛋白酶。如胃蛋白酶、脲酶、木瓜蛋白 酶等。 组成:单纯蛋白质 水解产物:氨基酸 实例:水解酶――胃蛋白酶、脲酶、木瓜蛋白酶等 2、结合蛋白酶 结合蛋白酶又称双成分酶。这些酶除含有蛋白质以外,还有其它非蛋白质成分。 结合蛋白酶的蛋白质部分称酶蛋白,非蛋白质部分称活性基或辅助因子。结合蛋白酶 必须是两部 分结合 起 来 组 成的全酶 才具有催化活性。全酶的任何一部分单独存在都不具有催化活性。 全酶(结合酶)=酶蛋白+活性基(辅酶或辅基) 在结合酶中,根据活性基与酶蛋白结合的松紧程度,活性基又辅酶与辅基之分。 辅基:与酶蛋白结合紧密,用透析法不易除去的活性基称辅基;辅酶:与酶蛋白结合疏松,易 被透析法除去的活性基称辅酶。活性基的成分有两类: 一类是低分子有机化合物如NAD、NADP、FAD、FMN等, 一类是无机金属离子,如Fe3+ 、Cu2+ 、Zn2 +、Mn2+ 等。 NAD(辅酶Ⅰ) 烟酰胺-核糖-磷酸-磷酸-核糖-腺嘌呤 NADP(辅酶Ⅱ)烟酰胺-核糖-磷酸-磷酸-核糖-腺嘌呤 │ 磷酸 FAD(黄素腺嘌呤二核苷酸) 异咯嗪-核醇-磷酸-磷酸-核糖-腺嘌呤 FMN(磷酸核黄素 黄素单核苷酸) 异咯嗪-核醇-磷酸 第二节 酶的结构和作用机制 一、酶的活性中心 (一)酶的活性中心 酶与底物的结合不是随意的,酶分子有一定的区域与底物相合,这一区域的一些基团还直接参 与化学键的形成与断裂。这一特定区域称为酶的活性中心。 (二)酶的必需基团 存在于酶的活性中心的,直接参与化学键的形成与断裂的,与酶的催化活性密切相关基团,称 为酶的必需基团。 活性中心内的必需基团分为两种: 结合基团:其中与底物结合的称为结合基团, 催化基团:促进底物发生化学变化的称为催化基团。 有些必需基目兼有这两种作用。既是结合基团又是催化基团。 (三)活性中心的作用 活性中心是酶起专一性催化作用的关键部位。当活性中心被占据或空间结构被破坏时,酶就失 去作用。 (四)非活性中心的作用 酶分子中非活性中心部分也有着一定的作用。 1、维持酶的空间结构。 2、与免疫功能有关等等。 二、酶原激活
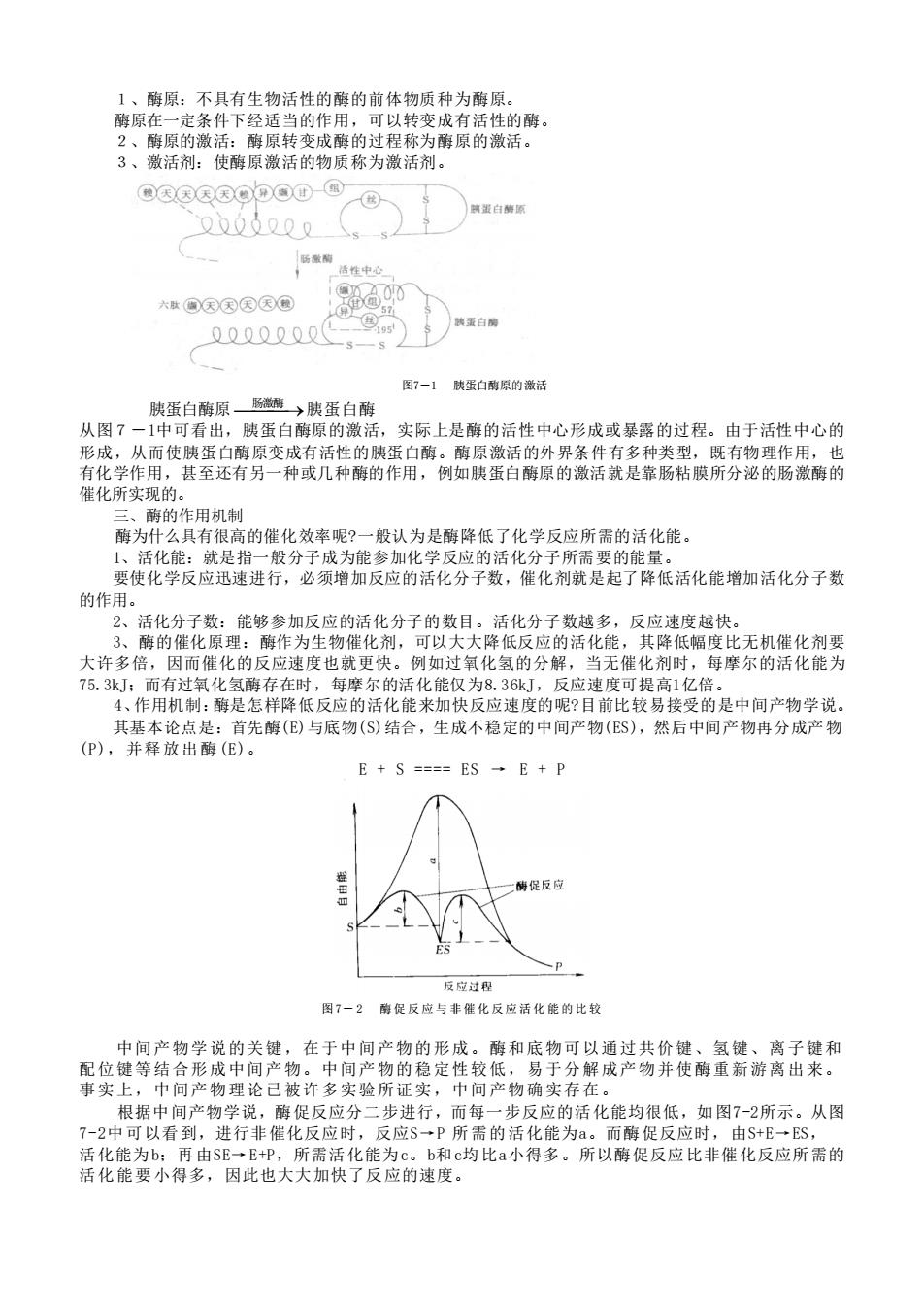
1、酶原:不具有生物活性的酶的前体物质种为酶原。 酶原在一定条件下经适当的作用,可以转变成有活性的酶。 2、酶原的激活:酶原转变成酶的过程称为酶原的激活。 3、激活剂:使酶原激活的物质称为激活剂。 图7-1 胰蛋白酶原的激活 胰蛋白酶原 ⎯肠激酶 ⎯⎯→ 胰蛋白酶 从图7-1中可看出,胰蛋白酶原的激活,实际上是酶的活性中心形成或暴露的过程。由于活性中心的 形成,从而使胰蛋白酶原变成有活性的胰蛋白酶。酶原激活的外界条件有多种类型,既有物理作用,也 有化学作用,甚至还有另一种或几种酶的作用,例如胰蛋白酶原的激活就是靠肠粘膜所分泌的肠激酶的 催化所实现的。 三、酶的作用机制 酶为什么具有很高的催化效率呢?一般认为是酶降低了化学反应所需的活化能。 1、活化能:就是指一般分子成为能参加化学反应的活化分子所需要的能量。 要使化学反应迅速进行,必须增加反应的活化分子数,催化剂就是起了降低活化能增加活化分子数 的作用。 2、活化分子数:能够参加反应的活化分子的数目。活化分子数越多,反应速度越快。 3、酶的催化原理:酶作为生物催化剂,可以大大降低反应的活化能,其降低幅度比无机催化剂要 大许多倍,因而催化的反应速度也就更快。例如过氧化氢的分解,当无催化剂时,每摩尔的活化能为 75.3kJ;而有过氧化氢酶存在时,每摩尔的活化能仅为8.36kJ,反应速度可提高1亿倍。 4、作用机制:酶是怎样降低反应的活化能来加快反应速度的呢?目前比较易接受的是中间产物学说。 其基本论点是:首先酶(E)与底物(S)结合,生成不稳定的中间产物(ES),然后中间产物再分成产物 (P),并释放出酶(E)。 E + S ==== ES → E + P 图 7- 2 酶促反应与非催化反应活化能的比较 中间产物学说的关键,在于中间产物的形成。酶和底物可以通过共价键、氢键、离子键和 配位键等结合形成中间产物。中间产物的稳定性较低,易于分解成产物并使酶重新游离出来。 事实上,中间产物理论已被许多实验所证实,中间产物确实存在。 根据中间产物学说,酶促反应分二步进行,而每一步反应的活化能均很低,如图7-2所示。从图 7-2中可以看到,进行非催化反应时,反应S→P 所需的活化能为a。而酶促反应时,由S+E→ES, 活化能为b;再由SE→E+P,所需活化能为c。b和c均比a小得多。所以酶促反应比非催化反应所需的 活化能要小得多,因此也大大加快了反应的速度
1、酶原:不具有生物活性的酶的前体物质种为酶原。 酶原在一定条件下经适当的作用,可以转变成有活性的酶。 2、酶原的激活:酶原转变成酶的过程称为酶原的激活。 3、激活剂:使酶原激活的物质称为激活剂。 图7-1 胰蛋白酶原的激活 胰蛋白酶原 ⎯肠激酶 ⎯⎯→ 胰蛋白酶 从图7-1中可看出,胰蛋白酶原的激活,实际上是酶的活性中心形成或暴露的过程。由于活性中心的 形成,从而使胰蛋白酶原变成有活性的胰蛋白酶。酶原激活的外界条件有多种类型,既有物理作用,也 有化学作用,甚至还有另一种或几种酶的作用,例如胰蛋白酶原的激活就是靠肠粘膜所分泌的肠激酶的 催化所实现的。 三、酶的作用机制 酶为什么具有很高的催化效率呢?一般认为是酶降低了化学反应所需的活化能。 1、活化能:就是指一般分子成为能参加化学反应的活化分子所需要的能量。 要使化学反应迅速进行,必须增加反应的活化分子数,催化剂就是起了降低活化能增加活化分子数 的作用。 2、活化分子数:能够参加反应的活化分子的数目。活化分子数越多,反应速度越快。 3、酶的催化原理:酶作为生物催化剂,可以大大降低反应的活化能,其降低幅度比无机催化剂要 大许多倍,因而催化的反应速度也就更快。例如过氧化氢的分解,当无催化剂时,每摩尔的活化能为 75.3kJ;而有过氧化氢酶存在时,每摩尔的活化能仅为8.36kJ,反应速度可提高1亿倍。 4、作用机制:酶是怎样降低反应的活化能来加快反应速度的呢?目前比较易接受的是中间产物学说。 其基本论点是:首先酶(E)与底物(S)结合,生成不稳定的中间产物(ES),然后中间产物再分成产物 (P),并释放出酶(E)。 E + S ==== ES → E + P 图 7- 2 酶促反应与非催化反应活化能的比较 中间产物学说的关键,在于中间产物的形成。酶和底物可以通过共价键、氢键、离子键和 配位键等结合形成中间产物。中间产物的稳定性较低,易于分解成产物并使酶重新游离出来。 事实上,中间产物理论已被许多实验所证实,中间产物确实存在。 根据中间产物学说,酶促反应分二步进行,而每一步反应的活化能均很低,如图7-2所示。从图 7-2中可以看到,进行非催化反应时,反应S→P 所需的活化能为a。而酶促反应时,由S+E→ES, 活化能为b;再由SE→E+P,所需活化能为c。b和c均比a小得多。所以酶促反应比非催化反应所需的 活化能要小得多,因此也大大加快了反应的速度