
59 第五章 蛋白质与核酸 一、教学目的与要求 1、 用蛋白质的结构特征阐明蛋白质的亲水性、等点性、乳化性、起泡性、变性作用、凝胶作用、膨润 作用及其应用。 2、 介绍烹饪加工中的蛋白质的变性及意义。 3、 了解核酸的有关知识。 二、教学重点与难点 1、 蛋白质的性质及在烹饪中的应用。 2、蛋白质的结构及两性电离。 三、课时安排与教学方法 教学内容 (计划/实际) 课时数 课程类型/ 教学方法 第一节 蛋白质的化学组成和α-氨基酸 4/ 理论/ 第二节 蛋白质的结构与分类 2/ 理论/ 第三节 蛋白质的性质 2/ 理论/ 第四节 蛋白质在烹调过程中的功能性质 2/ 理论/ 第五节 核酸及其功能 1/ 理论/ 合计 11/ 四、教学过程 第五章 蛋白质与核酸 蛋白质和核酸在生物体内占有特殊的地位,是构成细胞原生质的主要成分。原生质是生命现象 的物质基础。 一、蛋白质的生理功能 蛋白质是动植物组织中的主要物质,占活细胞干重的50%以上,是生命活动的物质基础;蛋白质 是与生命活动联系紧密的物质,在生物体内,蛋白质有各种各样的生物学功能。 1、酶的催化功能; 2、激素的代谢调节功能; 3、血红蛋白和脂蛋白的运输功能; 4、肌纤维蛋白的运动功能; 5、机体的免疫功能和胶原蛋白的支架功能。 蛋白质不仅是构成各类细胞原生质的主要物质,而且核蛋白及其相应的核糖核酸还是遗传的主 要物质基础。 二、蛋白质的营养功能 构成蛋白质的基本材料就是20种基本氨基酸。由于它们在每一种蛋白质中的组成和排列顺序不同, 会形成具有不同空间结构的生物大分子,表现出不同的生物活性和功能特性。 从营养的角度考虑,食物中的蛋白质为我们提供构造机体所需的氮元素和必需氨基酸,是人类 生长发育的主要营养素。 三、蛋白质在烹饪中的作用
59 第五章 蛋白质与核酸 一、教学目的与要求 1、 用蛋白质的结构特征阐明蛋白质的亲水性、等点性、乳化性、起泡性、变性作用、凝胶作用、膨润 作用及其应用。 2、 介绍烹饪加工中的蛋白质的变性及意义。 3、 了解核酸的有关知识。 二、教学重点与难点 1、 蛋白质的性质及在烹饪中的应用。 2、蛋白质的结构及两性电离。 三、课时安排与教学方法 教学内容 (计划/实际) 课时数 课程类型/ 教学方法 第一节 蛋白质的化学组成和α-氨基酸 4/ 理论/ 第二节 蛋白质的结构与分类 2/ 理论/ 第三节 蛋白质的性质 2/ 理论/ 第四节 蛋白质在烹调过程中的功能性质 2/ 理论/ 第五节 核酸及其功能 1/ 理论/ 合计 11/ 四、教学过程 第五章 蛋白质与核酸 蛋白质和核酸在生物体内占有特殊的地位,是构成细胞原生质的主要成分。原生质是生命现象 的物质基础。 一、蛋白质的生理功能 蛋白质是动植物组织中的主要物质,占活细胞干重的50%以上,是生命活动的物质基础;蛋白质 是与生命活动联系紧密的物质,在生物体内,蛋白质有各种各样的生物学功能。 1、酶的催化功能; 2、激素的代谢调节功能; 3、血红蛋白和脂蛋白的运输功能; 4、肌纤维蛋白的运动功能; 5、机体的免疫功能和胶原蛋白的支架功能。 蛋白质不仅是构成各类细胞原生质的主要物质,而且核蛋白及其相应的核糖核酸还是遗传的主 要物质基础。 二、蛋白质的营养功能 构成蛋白质的基本材料就是20种基本氨基酸。由于它们在每一种蛋白质中的组成和排列顺序不同, 会形成具有不同空间结构的生物大分子,表现出不同的生物活性和功能特性。 从营养的角度考虑,食物中的蛋白质为我们提供构造机体所需的氮元素和必需氨基酸,是人类 生长发育的主要营养素。 三、蛋白质在烹饪中的作用

60 从烹饪加工角度看,食物原料中的蛋白质对所烹调的食物的色泽、风味、质构等起着重要的作用。常见 烹饪原料中的蛋白质含量见表5-1。 表 5-1 常见烹饪原料的蛋白质含量 单位:% (质量分数 ) 原 料 蛋白质含量 原 料 蛋白质含量 原 料 蛋白质含量 猪肉 猪肝 牛肉 带鱼 对虾 13.2 19.3 18.1 17.7 18.6 鸡蛋 牛奶 豆腐 豆浆 黄豆 12.7 3.0 5.0 1.8 35.1 四季豆 胡萝卜 马铃薯 菜花 花生仁 2.0 1.0 2.0 2.1 25.0 第一节 蛋白质的化学组成和α-氨基酸 一、蛋白质的化学组成 (一)蛋白质的元素组成 对蛋白质进行元素分析发现,与食品中的其它营养素相比,在蛋白质中,除含有碳、氢、氧元 素外,还含有氮元素和少量的硫元素,有些蛋白还含有铁、铜、磷和锌等元素。 C H O N S P Fe Cu Zn 对不同生物体来源的蛋白质元素组成进行比较后发现,这些蛋白质中氮元素的含量相近,都约 为16%。由于食物中的氮元素主要是由蛋白质提供的,因此,如果我们测定出食物中氮元素的量, 乘以100/16=6.25就可以推算出该食物中的蛋白质的含量,这个6.25就被称为蛋白质系数。这样 测得的蛋白质我们称其为粗蛋白,这就 是凯氏定氮测定蛋白质含量的原理。 1克N相当于100/16=6.25克的蛋白质 6.25称为蛋白质系数 则食物中的蛋白质含量=实验测得的N的量×6.25 (二)蛋白质的水解与消化 蛋白质是大分子物质,相对分子质量都在10 000以上。蛋白质不能被生物体直接利用,必须分解 成小分子物质后才能被机体吸收利用。 水解:我们把蛋白质在体外的降解反应称为蛋白质的水解; 消化:而把蛋白质在体内的水解过程称为消化。 对蛋白质在不同水解时期得到的水解或消化产物进行分析后发现,蛋白质在水解或消化过程中 逐渐降解,相对分子质量越来越小,最后成为各种氨基酸的混合物。蛋白质完全水解或消化后得到 的氨基酸是蛋白质的基本组成单位。 蛋白质 ⎯⎯⎯⎯→ 酸、碱、酶 胨 ⎯⎯⎯⎯→ 酸、碱、酶 多肽 ⎯⎯⎯⎯→ 酸、碱、酶 二肽 ⎯⎯⎯⎯→ 酸、碱、酶 氨基酸 根据蛋白质的水解程度,可将蛋白质的水解分为完全水解和部分水解。 完全水解: 产物――是各种氨基酸的混合物。 条件――在较激烈的水解条件下才能发生蛋白质的完全水解,如在强酸(盐酸、硫酸)、强碱(氢 氧化钠)、高浓度(12mol/L)、高温(100~110℃)长时间(10~20h)的水解条件下,能发生蛋白质的 完全水解。 酸水解――得到的氨基酸是L-氨基酸。酸水解时有少数氨基酸被破坏,如色氨酸完全被破坏, 羟基氨基酸及含酰胺基的氨基酸被分解或水解。 碱水解――其中多数氨基酸被破坏。碱对氨基酸产生消旋作用,所得产物是D型和L型氨基酸的 混合物。 蛋白质的水解,尤其是酸水解在食品加工中应用较多,如利用酸水解生产化学酱油、生产营养 添加剂氨基酸等。 不完全水解即部分水解: 产物――是各种大小不等的肽段和氨基酸。 条件――在较温和的水解条件下,发生不完全水解,如酶水 解、稀酸水解。 酶水解――优点是水解条件温和,水解温度通常在30~50℃,不产生消旋作用,也不破坏氨基
60 从烹饪加工角度看,食物原料中的蛋白质对所烹调的食物的色泽、风味、质构等起着重要的作用。常见 烹饪原料中的蛋白质含量见表5-1。 表 5-1 常见烹饪原料的蛋白质含量 单位:% (质量分数 ) 原 料 蛋白质含量 原 料 蛋白质含量 原 料 蛋白质含量 猪肉 猪肝 牛肉 带鱼 对虾 13.2 19.3 18.1 17.7 18.6 鸡蛋 牛奶 豆腐 豆浆 黄豆 12.7 3.0 5.0 1.8 35.1 四季豆 胡萝卜 马铃薯 菜花 花生仁 2.0 1.0 2.0 2.1 25.0 第一节 蛋白质的化学组成和α-氨基酸 一、蛋白质的化学组成 (一)蛋白质的元素组成 对蛋白质进行元素分析发现,与食品中的其它营养素相比,在蛋白质中,除含有碳、氢、氧元 素外,还含有氮元素和少量的硫元素,有些蛋白还含有铁、铜、磷和锌等元素。 C H O N S P Fe Cu Zn 对不同生物体来源的蛋白质元素组成进行比较后发现,这些蛋白质中氮元素的含量相近,都约 为16%。由于食物中的氮元素主要是由蛋白质提供的,因此,如果我们测定出食物中氮元素的量, 乘以100/16=6.25就可以推算出该食物中的蛋白质的含量,这个6.25就被称为蛋白质系数。这样 测得的蛋白质我们称其为粗蛋白,这就 是凯氏定氮测定蛋白质含量的原理。 1克N相当于100/16=6.25克的蛋白质 6.25称为蛋白质系数 则食物中的蛋白质含量=实验测得的N的量×6.25 (二)蛋白质的水解与消化 蛋白质是大分子物质,相对分子质量都在10 000以上。蛋白质不能被生物体直接利用,必须分解 成小分子物质后才能被机体吸收利用。 水解:我们把蛋白质在体外的降解反应称为蛋白质的水解; 消化:而把蛋白质在体内的水解过程称为消化。 对蛋白质在不同水解时期得到的水解或消化产物进行分析后发现,蛋白质在水解或消化过程中 逐渐降解,相对分子质量越来越小,最后成为各种氨基酸的混合物。蛋白质完全水解或消化后得到 的氨基酸是蛋白质的基本组成单位。 蛋白质 ⎯⎯⎯⎯→ 酸、碱、酶 胨 ⎯⎯⎯⎯→ 酸、碱、酶 多肽 ⎯⎯⎯⎯→ 酸、碱、酶 二肽 ⎯⎯⎯⎯→ 酸、碱、酶 氨基酸 根据蛋白质的水解程度,可将蛋白质的水解分为完全水解和部分水解。 完全水解: 产物――是各种氨基酸的混合物。 条件――在较激烈的水解条件下才能发生蛋白质的完全水解,如在强酸(盐酸、硫酸)、强碱(氢 氧化钠)、高浓度(12mol/L)、高温(100~110℃)长时间(10~20h)的水解条件下,能发生蛋白质的 完全水解。 酸水解――得到的氨基酸是L-氨基酸。酸水解时有少数氨基酸被破坏,如色氨酸完全被破坏, 羟基氨基酸及含酰胺基的氨基酸被分解或水解。 碱水解――其中多数氨基酸被破坏。碱对氨基酸产生消旋作用,所得产物是D型和L型氨基酸的 混合物。 蛋白质的水解,尤其是酸水解在食品加工中应用较多,如利用酸水解生产化学酱油、生产营养 添加剂氨基酸等。 不完全水解即部分水解: 产物――是各种大小不等的肽段和氨基酸。 条件――在较温和的水解条件下,发生不完全水解,如酶水 解、稀酸水解。 酶水解――优点是水解条件温和,水解温度通常在30~50℃,不产生消旋作用,也不破坏氨基

61 酸。缺点是酶水解时间较长且水解也难彻底。 在动物体内,要将蛋白质完全消化,往往需要几种酶共同参与才能完成。利用蛋白质的不完全 水解,可以改善蛋白质的可消化性、溶解性及其它功能特性,如蛋白质的起泡性、乳化性等,生产 出更多的适宜加工需要的蛋白质原料。 二、α-氨基酸 (一)氨基酸的结构特点 构成天然蛋白质的常见氨基酸仅有20种,这些氨基酸我们称其为基本氨基酸,其在水溶液 或晶体状态时的结构通式为: CHO COO- HO-C-H 在水溶液中:+ H3N-C-H CH2OH R L-(-)甘油醛 L-α-氨基酸 式中,R代表氨基酸的侧链基团,各种氨基酸的区别就在于侧链R基的不同。 除脯氨酸外,这些氨基酸在结构上的共同特点是: 都是α-氨基酸,在与羧基相邻的α-碳原子上都有一个氨基;除甘氨酸外,其余的α-氨基酸中 的α-碳原子是手性碳原子,因此氨基酸具有旋光性;将天然蛋白质中的氨基酸的构型与甘油醛的构 型相比较发现,天然蛋白质中的氨基酸构型绝大部分是L-型。 (二)氨基酸的分类 氨基酸的分类方法很多。 按氨基酸侧链R基的化学结构分类 杂环族 芳香族 脂肪族 在生物体中更需要我们了解的是一个蛋白质中的氨基酸侧链基团与水的相互作用的大小,这直接 影响蛋白质在生物体中的功能,也直接关系到蛋白质在食品中的作用。基于上述的原因,通常对氨基 酸的分类是按其侧链R基与水的相互作用的大小,即极性进行的。 按R基的极性分类 、带负电荷的氨基酸 、带正电荷的氨基酸 、不带电荷的极性氨基酸 、非极性氨基酸 4 3 2 1 20种基本 氨基酸可以分成四 组。这些基本氨基 酸的结构、在食品 中的分布见表 4-2。 (教科 书:P390-393 ) 1、非极性氨基酸 结构特点:侧链R基为非极性基团。 种类:8种,包括丙氨酸、缬氨酸、亮氨酸、异亮氨酸这四个带有脂肪烃侧链的氨基酸;两种芳香 族氨基酸:苯丙氨酸和色氨酸,蛋氨酸(甲硫氨酸)和脯氨酸。 性质:这组氨基酸与水的相互作用最弱,疏水性最强。 2、不带电荷的极性氨基酸 结构特点:这组氨基酸的侧链为不带有电荷的极性基团。 种 类: 7种,包括含羟基的丝氨酸、苏氨酸、酪氨酸,含酰胺基的天冬酰胺和谷酰胺,含巯 基的半胱氨酸及侧链R基为H原子的甘氨酸。 性 质: 这组氨基酸侧链的极性基团可以与水形成氢键,亲水性增大。 3、带正电荷的氨基酸 结构特点:这类氨基酸的侧链基团带有一个正电荷,即整个分子中有两个带正电荷的氨基和一个 带负电荷的羧基,在pH=7时整个分子携带正电荷,是碱性氨基酸。 种 类: 3种,这类氨基酸有赖氨酸、精氨酸和组氨酸。 性 质: 这组氨基酸与水的相互作用除了氢键作用外,还存在离子的水合作用,所以,它们 与水的相互作用更强烈。这组氨基酸都能溶于水。 4、带负电荷的氨基酸 结构特点:即在氨基酸的侧链基团上带有一个负电荷,整个分子有两个带负电荷的羧基和一个正 电荷的氨基,在pH=7时整个分子携带负电荷,属于酸性氨基酸。 种 类: 2种,这组氨基酸有两个,为天冬氨酸和谷氨酸。性 质: 其与水的相互作用同带 正电荷的氨基酸
61 酸。缺点是酶水解时间较长且水解也难彻底。 在动物体内,要将蛋白质完全消化,往往需要几种酶共同参与才能完成。利用蛋白质的不完全 水解,可以改善蛋白质的可消化性、溶解性及其它功能特性,如蛋白质的起泡性、乳化性等,生产 出更多的适宜加工需要的蛋白质原料。 二、α-氨基酸 (一)氨基酸的结构特点 构成天然蛋白质的常见氨基酸仅有20种,这些氨基酸我们称其为基本氨基酸,其在水溶液 或晶体状态时的结构通式为: CHO COO- HO-C-H 在水溶液中:+ H3N-C-H CH2OH R L-(-)甘油醛 L-α-氨基酸 式中,R代表氨基酸的侧链基团,各种氨基酸的区别就在于侧链R基的不同。 除脯氨酸外,这些氨基酸在结构上的共同特点是: 都是α-氨基酸,在与羧基相邻的α-碳原子上都有一个氨基;除甘氨酸外,其余的α-氨基酸中 的α-碳原子是手性碳原子,因此氨基酸具有旋光性;将天然蛋白质中的氨基酸的构型与甘油醛的构 型相比较发现,天然蛋白质中的氨基酸构型绝大部分是L-型。 (二)氨基酸的分类 氨基酸的分类方法很多。 按氨基酸侧链R基的化学结构分类 杂环族 芳香族 脂肪族 在生物体中更需要我们了解的是一个蛋白质中的氨基酸侧链基团与水的相互作用的大小,这直接 影响蛋白质在生物体中的功能,也直接关系到蛋白质在食品中的作用。基于上述的原因,通常对氨基 酸的分类是按其侧链R基与水的相互作用的大小,即极性进行的。 按R基的极性分类 、带负电荷的氨基酸 、带正电荷的氨基酸 、不带电荷的极性氨基酸 、非极性氨基酸 4 3 2 1 20种基本 氨基酸可以分成四 组。这些基本氨基 酸的结构、在食品 中的分布见表 4-2。 (教科 书:P390-393 ) 1、非极性氨基酸 结构特点:侧链R基为非极性基团。 种类:8种,包括丙氨酸、缬氨酸、亮氨酸、异亮氨酸这四个带有脂肪烃侧链的氨基酸;两种芳香 族氨基酸:苯丙氨酸和色氨酸,蛋氨酸(甲硫氨酸)和脯氨酸。 性质:这组氨基酸与水的相互作用最弱,疏水性最强。 2、不带电荷的极性氨基酸 结构特点:这组氨基酸的侧链为不带有电荷的极性基团。 种 类: 7种,包括含羟基的丝氨酸、苏氨酸、酪氨酸,含酰胺基的天冬酰胺和谷酰胺,含巯 基的半胱氨酸及侧链R基为H原子的甘氨酸。 性 质: 这组氨基酸侧链的极性基团可以与水形成氢键,亲水性增大。 3、带正电荷的氨基酸 结构特点:这类氨基酸的侧链基团带有一个正电荷,即整个分子中有两个带正电荷的氨基和一个 带负电荷的羧基,在pH=7时整个分子携带正电荷,是碱性氨基酸。 种 类: 3种,这类氨基酸有赖氨酸、精氨酸和组氨酸。 性 质: 这组氨基酸与水的相互作用除了氢键作用外,还存在离子的水合作用,所以,它们 与水的相互作用更强烈。这组氨基酸都能溶于水。 4、带负电荷的氨基酸 结构特点:即在氨基酸的侧链基团上带有一个负电荷,整个分子有两个带负电荷的羧基和一个正 电荷的氨基,在pH=7时整个分子携带负电荷,属于酸性氨基酸。 种 类: 2种,这组氨基酸有两个,为天冬氨酸和谷氨酸。性 质: 其与水的相互作用同带 正电荷的氨基酸
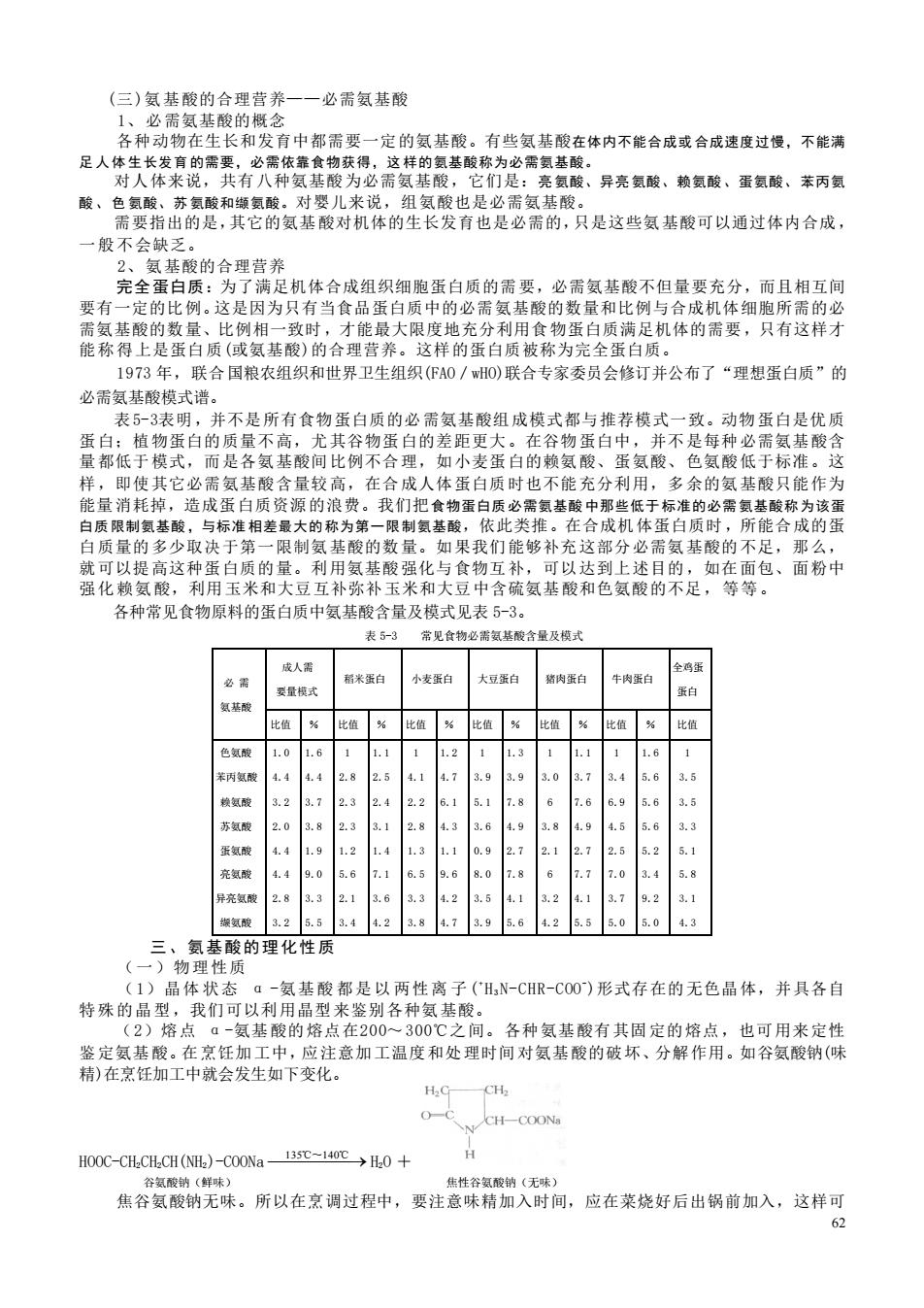
62 (三)氨基酸的合理营养——必需氨基酸 1、必需氨基酸的概念 各种动物在生长和发育中都需要一定的氨基酸。有些氨基酸在体内不能合成或合成速度过慢,不能满 足 人 体 生长发育 的需要,必需依靠食物获得,这 样的氨基酸称为必需氨基酸。 对人体来说,共有八种氨基酸为必需氨基酸,它们是:亮 氨酸、异亮 氨酸、赖氨酸 、蛋氨酸、 苯丙氨 酸 、 色 氨酸、苏 氨酸和缬氨酸。对婴儿来说,组氨酸也是必需氨基酸。 需要指出的是,其它的氨基酸对机体的生长发育也是必需的,只是这些氨基酸可以通过体内合成, 一般不会缺乏。 2、氨基酸的合理营养 完全蛋白质:为了满足机体合成组织细胞蛋白质的需要,必需氨基酸不但量要充分,而且相互间 要有一定的比例。这是因为只有当食品蛋白质中的必需氨基酸的数量和比例与合成机体细胞所需的必 需氨基酸的数量、比例相一致时,才能最大限度地充分利用食物蛋白质满足机体的需要,只有这样才 能称得上是蛋白质(或氨基酸)的合理营养。这样的蛋白质被称为完全蛋白质。 1973 年,联合国粮农组织和世界卫生组织(FAO/wHO)联合专家委员会修订并公布了“理想蛋白质”的 必需氨基酸模式谱。 表5-3表明,并不是所有食物蛋白质的必需氨基酸组成模式都与推荐模式一致。动物蛋白是优质 蛋白;植物蛋白的质量不高,尤其谷物蛋白的差距更大。在谷物蛋白中,并不是每种必需氨基酸含 量都低于模式,而是各氨基酸间比例不合理,如小麦蛋白的赖氨酸、蛋氨酸、色氨酸低于标准。这 样,即使其它必需氨基酸含量较高,在合成人体蛋白质时也不能充分利用,多余的氨基酸只能作为 能量消耗掉,造成蛋白质资源的浪费。我们把食物蛋白质 必需氨基酸 中那些低于 标准的必需 氨基酸称 为该蛋 白质 限制氨基酸 ,与标准 相差最大的 称为第一限 制氨基酸,依此类推。在合成机体蛋白质时,所能合成的蛋 白质量的多少取决于第一限制氨基酸的数量。如果我们能够补充这部分必需氨基酸的不足,那么, 就可以提高这种蛋白质的量。利用氨基酸强化与食物互补,可以达到上述目的,如在面包、面粉中 强化赖氨酸,利用玉米和大豆互补弥补玉米和大豆中含硫氨基酸和色氨酸的不足,等等。 各种常见食物原料的蛋白质中氨基酸含量及模式见表 5-3。 表 5-3 常见食物必需氨基酸含量及模式 必 需 氨基酸 成人需 要量模式 稻米蛋白 小麦蛋白 大豆蛋白 猪肉蛋白 牛肉蛋白 全鸡蛋 蛋白 比值 % 比值 % 比值 % 比值 % 比值 % 比值 % 比值 色氨酸 苯丙氨酸 赖氨酸 苏氨酸 蛋氨酸 亮氨酸 异亮氨酸 缬氨酸 1.0 4.4 3.2 2.0 4.4 4.4 2.8 3.2 1.6 4.4 3.7 3.8 1.9 9.0 3.3 5.5 1 2.8 2.3 2.3 1.2 5.6 2.1 3.4 1.1 2.5 2.4 3.1 1.4 7.1 3.6 4.2 1 4.1 2.2 2.8 1.3 6.5 3.3 3.8 1.2 4.7 6.1 4.3 1.1 9.6 4.2 4.7 1 3.9 5.1 3.6 0.9 8.0 3.5 3.9 1.3 3.9 7.8 4.9 2.7 7.8 4.1 5.6 1 3.0 6 3.8 2.1 6 3.2 4.2 1.1 3.7 7.6 4.9 2.7 7.7 4.1 5.5 1 3.4 6.9 4.5 2.5 7.0 3.7 5.0 1.6 5.6 5.6 5.6 5.2 3.4 9.2 5.0 1 3.5 3.5 3.3 5.1 5.8 3.1 4.3 三、氨基酸的理化性质 (一)物理性质 (1)晶体 状态 α -氨基酸 都是以 两性离 子( + H3 N-CHR-COO- )形式存在的无色晶体,并具各自 特殊的晶型,我们可以利用晶型来鉴别各种氨基酸。 (2)熔点 α-氨基酸的熔点在200~300℃之间。各种氨基酸有其固定的熔点,也可用来定性 鉴定氨基酸。在烹饪加工中,应注意加工温度和处理时间对氨基酸的破坏、分解作用。如谷氨酸钠(味 精)在烹饪加工中就会发生如下变化。 HOOC-CH2CH2CH(NH2)-COONa ⎯135 ⎯℃~⎯140⎯℃→ H2O + 谷氨酸钠(鲜味) 焦性谷氨酸钠(无味) 焦谷氨酸钠无味。所以在烹调过程中,要注意味精加入时间,应在菜烧好后出锅前加入,这样可
62 (三)氨基酸的合理营养——必需氨基酸 1、必需氨基酸的概念 各种动物在生长和发育中都需要一定的氨基酸。有些氨基酸在体内不能合成或合成速度过慢,不能满 足 人 体 生长发育 的需要,必需依靠食物获得,这 样的氨基酸称为必需氨基酸。 对人体来说,共有八种氨基酸为必需氨基酸,它们是:亮 氨酸、异亮 氨酸、赖氨酸 、蛋氨酸、 苯丙氨 酸 、 色 氨酸、苏 氨酸和缬氨酸。对婴儿来说,组氨酸也是必需氨基酸。 需要指出的是,其它的氨基酸对机体的生长发育也是必需的,只是这些氨基酸可以通过体内合成, 一般不会缺乏。 2、氨基酸的合理营养 完全蛋白质:为了满足机体合成组织细胞蛋白质的需要,必需氨基酸不但量要充分,而且相互间 要有一定的比例。这是因为只有当食品蛋白质中的必需氨基酸的数量和比例与合成机体细胞所需的必 需氨基酸的数量、比例相一致时,才能最大限度地充分利用食物蛋白质满足机体的需要,只有这样才 能称得上是蛋白质(或氨基酸)的合理营养。这样的蛋白质被称为完全蛋白质。 1973 年,联合国粮农组织和世界卫生组织(FAO/wHO)联合专家委员会修订并公布了“理想蛋白质”的 必需氨基酸模式谱。 表5-3表明,并不是所有食物蛋白质的必需氨基酸组成模式都与推荐模式一致。动物蛋白是优质 蛋白;植物蛋白的质量不高,尤其谷物蛋白的差距更大。在谷物蛋白中,并不是每种必需氨基酸含 量都低于模式,而是各氨基酸间比例不合理,如小麦蛋白的赖氨酸、蛋氨酸、色氨酸低于标准。这 样,即使其它必需氨基酸含量较高,在合成人体蛋白质时也不能充分利用,多余的氨基酸只能作为 能量消耗掉,造成蛋白质资源的浪费。我们把食物蛋白质 必需氨基酸 中那些低于 标准的必需 氨基酸称 为该蛋 白质 限制氨基酸 ,与标准 相差最大的 称为第一限 制氨基酸,依此类推。在合成机体蛋白质时,所能合成的蛋 白质量的多少取决于第一限制氨基酸的数量。如果我们能够补充这部分必需氨基酸的不足,那么, 就可以提高这种蛋白质的量。利用氨基酸强化与食物互补,可以达到上述目的,如在面包、面粉中 强化赖氨酸,利用玉米和大豆互补弥补玉米和大豆中含硫氨基酸和色氨酸的不足,等等。 各种常见食物原料的蛋白质中氨基酸含量及模式见表 5-3。 表 5-3 常见食物必需氨基酸含量及模式 必 需 氨基酸 成人需 要量模式 稻米蛋白 小麦蛋白 大豆蛋白 猪肉蛋白 牛肉蛋白 全鸡蛋 蛋白 比值 % 比值 % 比值 % 比值 % 比值 % 比值 % 比值 色氨酸 苯丙氨酸 赖氨酸 苏氨酸 蛋氨酸 亮氨酸 异亮氨酸 缬氨酸 1.0 4.4 3.2 2.0 4.4 4.4 2.8 3.2 1.6 4.4 3.7 3.8 1.9 9.0 3.3 5.5 1 2.8 2.3 2.3 1.2 5.6 2.1 3.4 1.1 2.5 2.4 3.1 1.4 7.1 3.6 4.2 1 4.1 2.2 2.8 1.3 6.5 3.3 3.8 1.2 4.7 6.1 4.3 1.1 9.6 4.2 4.7 1 3.9 5.1 3.6 0.9 8.0 3.5 3.9 1.3 3.9 7.8 4.9 2.7 7.8 4.1 5.6 1 3.0 6 3.8 2.1 6 3.2 4.2 1.1 3.7 7.6 4.9 2.7 7.7 4.1 5.5 1 3.4 6.9 4.5 2.5 7.0 3.7 5.0 1.6 5.6 5.6 5.6 5.2 3.4 9.2 5.0 1 3.5 3.5 3.3 5.1 5.8 3.1 4.3 三、氨基酸的理化性质 (一)物理性质 (1)晶体 状态 α -氨基酸 都是以 两性离 子( + H3 N-CHR-COO- )形式存在的无色晶体,并具各自 特殊的晶型,我们可以利用晶型来鉴别各种氨基酸。 (2)熔点 α-氨基酸的熔点在200~300℃之间。各种氨基酸有其固定的熔点,也可用来定性 鉴定氨基酸。在烹饪加工中,应注意加工温度和处理时间对氨基酸的破坏、分解作用。如谷氨酸钠(味 精)在烹饪加工中就会发生如下变化。 HOOC-CH2CH2CH(NH2)-COONa ⎯135 ⎯℃~⎯140⎯℃→ H2O + 谷氨酸钠(鲜味) 焦性谷氨酸钠(无味) 焦谷氨酸钠无味。所以在烹调过程中,要注意味精加入时间,应在菜烧好后出锅前加入,这样可

63 以避免味精被破坏。 (3)溶解性 α-氨基酸是离子型化合物。除胱氨酸和酪氨酸外,其它氨基酸都能溶于水。溶 解度大的氨基酸是那些容易质子化的氨基酸,氨基酸侧链R基的极性越大、带有的电荷数目越多,在水 中的溶解度越大。 (4)味感 α-氨基酸都呈现味感。氨基酸的味感与其立体构型有关。D-氨基酸多数带有甜味, 而L-氨基酸依其侧链R基不同而有甜、苦、鲜、酸四种不同的味感。一般R基为疏水基团的L-型氨基酸 带有苦味,R基是极性基团的往往有甜味。谷氨酸和天冬氨酸本身带酸味,但其钠盐却有鲜味。 (二)氨基酸的酸碱性和等电点 1、酸碱性质 一般无机盐为离子化合物,具有高熔点,能溶于水而不溶于有机溶剂。氨基酸也具有这个特点, 因此可以推断氨基酸也为离子化合物。在水溶液及晶体状态下,氨基酸以两性离子的形式存在。 所谓两性离子是指在同一个氨基酸分子上带有能给出质子的 -NH3 +正离子和能接受质子的-COO-负离子的离子型化合物。因此,氨基酸是两性离子。 根据Bronsted-lowry的酸碱学说,酸是质子(H+ )的供体,碱是质子的受体,表示如下: HA(酸)→ H + + A- (碱) 所以,以两性离子存在的氨基酸,也是两性电解质,在不同的酸碱条件下会发生解离作用。当 加入酸时,由于-COO-接受质子,使氨基酸成为带正电荷的阳离子,在电场作用下向负极移动;而加 入碱时,则-NH3 +释放质子,氨基酸成为带负电荷的阴离子,在电场中向正极移动。氨基酸在不同条 件下的存在状态为: H2 N-CRH-COO- ==== + H3 N-CRH-COO- ==== + H3 N-CRH-COOH 在碱性溶液中 在晶体状态或在水溶液中 在酸性溶液中 氨基酸是两性电解质,这使得它在酸和碱中的溶解度大于其在水中的溶解度。利用氨基酸的这一 性质,我们可以用稀酸或稀碱来提取氨基酸。 2、等电点 定义:当氨基酸处于兼性离子状态(极少数为中性分子)而且可能解离为阳离子和阴离子的趋势相等时,其所处环 境的pH称为该氨基酸的等电点,用pI表示。 特点:在等电点处,氨基酸既不向电场的正极也不向电场的负极移动,因此这时氨基酸的净电荷数 为0。由于静电作用,氨基酸的溶解度最小,易于沉淀。 利用这个性质,可以分离制备氨基酸。如谷氨酸生产中就是利用这一原理,将微生物发酵液的pH 调整到其等电点(pI=3.22),使谷氨酸沉淀析出。 (三)氨基酸的化学反应 氨基酸虽是离子型化合物,但在溶液状态下存在下列平衡: H2 N-CHR-COOH ==== + H3 N-CHR-COO- 当-NH2或-COOH参与化学反应时,这个平衡被打破,向左移动。反应是按分子型进行的,因此, 在化学反应中可按H2N-CHR-COOH表示。 氨基酸的反应是指它的氨基和羧基以及侧链上的官能团所参与的那些反应。 1、与茚三酮的显色反应 茚三酮在微酸溶液中与α-氨基酸共热,发生下列氧化、脱氧、脱羧作用,生成蓝紫色物质。 利用此反应,我们可以通过比色分析定性、定量地测定各种氨基酸,也可用量压法通过测定反 应释放出的CO2量的多少定量测定氨基酸的含量。 2、与甲醛的反应 氨基酸的甲醛滴定法是测定氨基酸含量的一种常用的实验法。其反应原理为:
63 以避免味精被破坏。 (3)溶解性 α-氨基酸是离子型化合物。除胱氨酸和酪氨酸外,其它氨基酸都能溶于水。溶 解度大的氨基酸是那些容易质子化的氨基酸,氨基酸侧链R基的极性越大、带有的电荷数目越多,在水 中的溶解度越大。 (4)味感 α-氨基酸都呈现味感。氨基酸的味感与其立体构型有关。D-氨基酸多数带有甜味, 而L-氨基酸依其侧链R基不同而有甜、苦、鲜、酸四种不同的味感。一般R基为疏水基团的L-型氨基酸 带有苦味,R基是极性基团的往往有甜味。谷氨酸和天冬氨酸本身带酸味,但其钠盐却有鲜味。 (二)氨基酸的酸碱性和等电点 1、酸碱性质 一般无机盐为离子化合物,具有高熔点,能溶于水而不溶于有机溶剂。氨基酸也具有这个特点, 因此可以推断氨基酸也为离子化合物。在水溶液及晶体状态下,氨基酸以两性离子的形式存在。 所谓两性离子是指在同一个氨基酸分子上带有能给出质子的 -NH3 +正离子和能接受质子的-COO-负离子的离子型化合物。因此,氨基酸是两性离子。 根据Bronsted-lowry的酸碱学说,酸是质子(H+ )的供体,碱是质子的受体,表示如下: HA(酸)→ H + + A- (碱) 所以,以两性离子存在的氨基酸,也是两性电解质,在不同的酸碱条件下会发生解离作用。当 加入酸时,由于-COO-接受质子,使氨基酸成为带正电荷的阳离子,在电场作用下向负极移动;而加 入碱时,则-NH3 +释放质子,氨基酸成为带负电荷的阴离子,在电场中向正极移动。氨基酸在不同条 件下的存在状态为: H2 N-CRH-COO- ==== + H3 N-CRH-COO- ==== + H3 N-CRH-COOH 在碱性溶液中 在晶体状态或在水溶液中 在酸性溶液中 氨基酸是两性电解质,这使得它在酸和碱中的溶解度大于其在水中的溶解度。利用氨基酸的这一 性质,我们可以用稀酸或稀碱来提取氨基酸。 2、等电点 定义:当氨基酸处于兼性离子状态(极少数为中性分子)而且可能解离为阳离子和阴离子的趋势相等时,其所处环 境的pH称为该氨基酸的等电点,用pI表示。 特点:在等电点处,氨基酸既不向电场的正极也不向电场的负极移动,因此这时氨基酸的净电荷数 为0。由于静电作用,氨基酸的溶解度最小,易于沉淀。 利用这个性质,可以分离制备氨基酸。如谷氨酸生产中就是利用这一原理,将微生物发酵液的pH 调整到其等电点(pI=3.22),使谷氨酸沉淀析出。 (三)氨基酸的化学反应 氨基酸虽是离子型化合物,但在溶液状态下存在下列平衡: H2 N-CHR-COOH ==== + H3 N-CHR-COO- 当-NH2或-COOH参与化学反应时,这个平衡被打破,向左移动。反应是按分子型进行的,因此, 在化学反应中可按H2N-CHR-COOH表示。 氨基酸的反应是指它的氨基和羧基以及侧链上的官能团所参与的那些反应。 1、与茚三酮的显色反应 茚三酮在微酸溶液中与α-氨基酸共热,发生下列氧化、脱氧、脱羧作用,生成蓝紫色物质。 利用此反应,我们可以通过比色分析定性、定量地测定各种氨基酸,也可用量压法通过测定反 应释放出的CO2量的多少定量测定氨基酸的含量。 2、与甲醛的反应 氨基酸的甲醛滴定法是测定氨基酸含量的一种常用的实验法。其反应原理为: