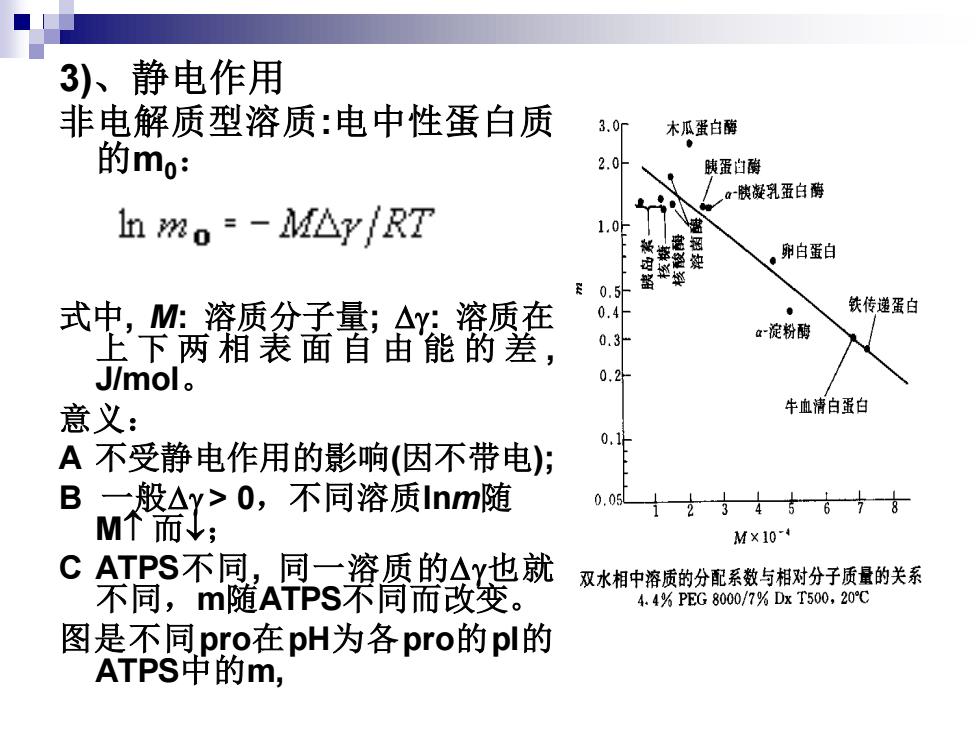
3)、静电作用 非电解质型溶质:电中性蛋白质 的m0: 式中, M: 溶质分子量; : 溶质在 上下两相表面自由能的差 , J/mol。 意义: A 不受静电作用的影响(因不带电); B 一般 > 0,不同溶质lnm随 M 而; C ATPS不同, 同一溶质的也就 不同,m随ATPS不同而改变。 图是不同pro在pH为各pro的pI的 ATPS中的m
3)、静电作用 非电解质型溶质:电中性蛋白质 的m0: 式中, M: 溶质分子量; : 溶质在 上下两相表面自由能的差 , J/mol。 意义: A 不受静电作用的影响(因不带电); B 一般 > 0,不同溶质lnm随 M 而; C ATPS不同, 同一溶质的也就 不同,m随ATPS不同而改变。 图是不同pro在pH为各pro的pI的 ATPS中的m
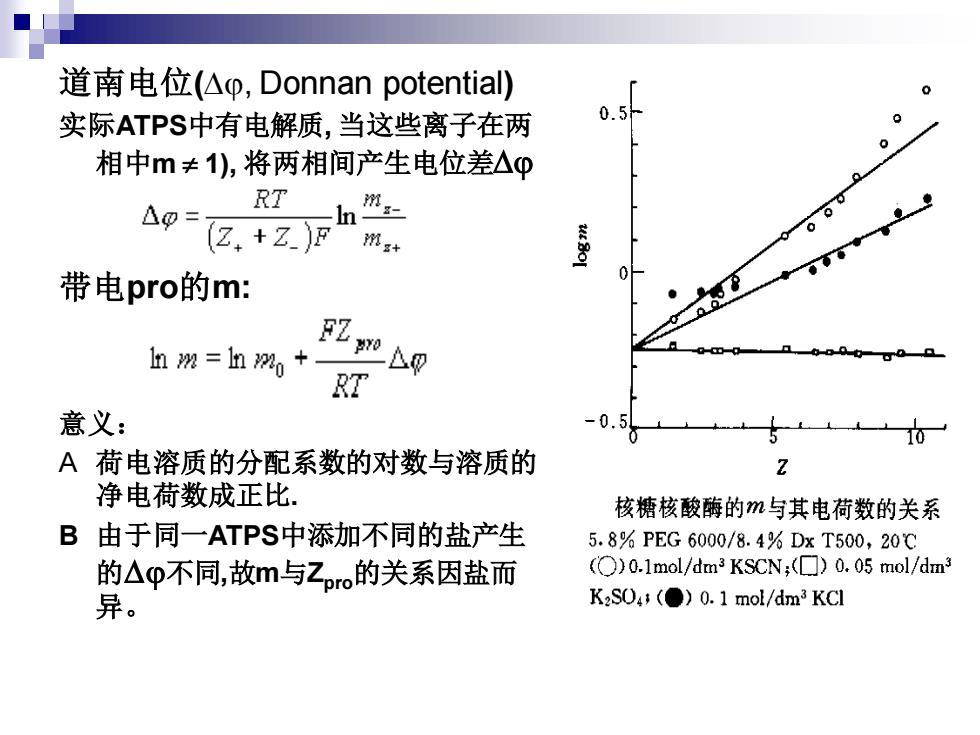
道南电位(, Donnan potential) 实际ATPS中有电解质, 当这些离子在两 相中m 1), 将两相间产生电位差 带电pro的m: 意义: A 荷电溶质的分配系数的对数与溶质的 净电荷数成正比. B 由于同一ATPS中添加不同的盐产生 的不同,故m与Zpro的关系因盐而 异
道南电位(, Donnan potential) 实际ATPS中有电解质, 当这些离子在两 相中m 1), 将两相间产生电位差 带电pro的m: 意义: A 荷电溶质的分配系数的对数与溶质的 净电荷数成正比. B 由于同一ATPS中添加不同的盐产生 的不同,故m与Zpro的关系因盐而 异

4)疏水作用 相间疏水因子(HF, hydrophobic factor) PEG/DX和PEG/KPi等ATPS上相(PEG相) 疏水性较大,相间的疏水性差用HF表示. HF可通过测定疏水性已知的aa在其pI处的 maa测算: RH-aa相对疏水性(relative hydrophobicity). 是通过测定aa在水和已醇中溶解度的差别 确定的,并设疏水性最小的Gly的RH=0.所 以,上式中的B为: mGly为Gly分配系数. 所以, pH=pL时aa在 ATPS中的分配系数与其RH值呈线性关系, 直线的斜率就是该双水相系统的HF值.图 为测定实例
4)疏水作用 相间疏水因子(HF, hydrophobic factor) PEG/DX和PEG/KPi等ATPS上相(PEG相) 疏水性较大,相间的疏水性差用HF表示. HF可通过测定疏水性已知的aa在其pI处的 maa测算: RH-aa相对疏水性(relative hydrophobicity). 是通过测定aa在水和已醇中溶解度的差别 确定的,并设疏水性最小的Gly的RH=0.所 以,上式中的B为: mGly为Gly分配系数. 所以, pH=pL时aa在 ATPS中的分配系数与其RH值呈线性关系, 直线的斜率就是该双水相系统的HF值.图 为测定实例
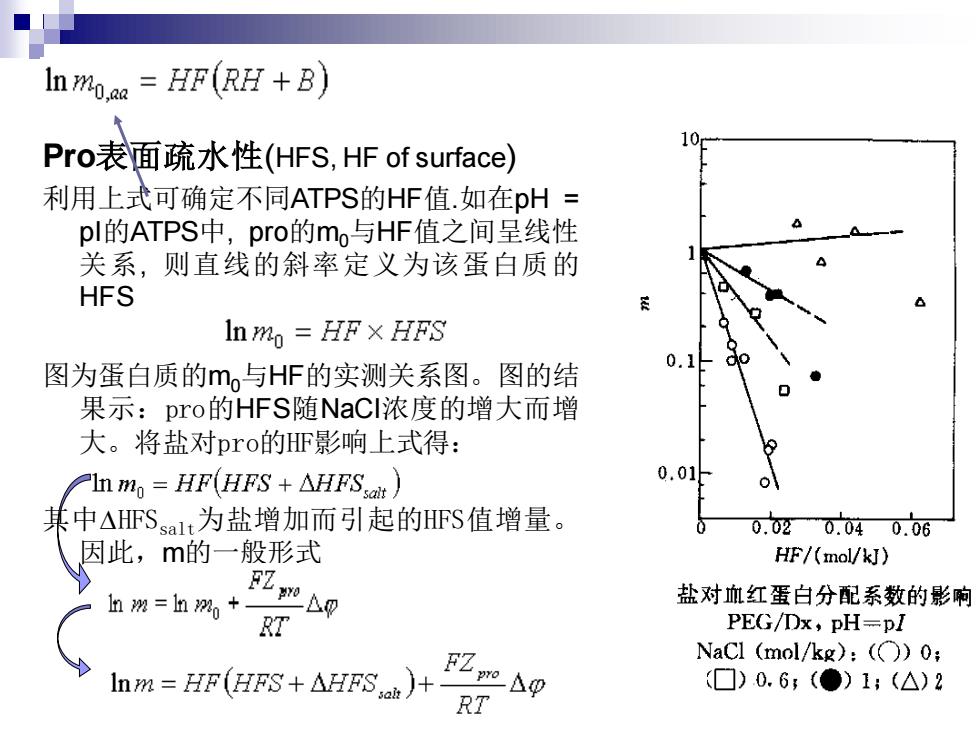
Pro表面疏水性(HFS, HF of surface) 利用上式可确定不同ATPS的HF值.如在pH = pI的ATPS中, pro的m0与HF值之间呈线性 关系, 则直线的斜率定义为该蛋白质的 HFS 图为蛋白质的m0与HF的实测关系图。图的结 果示:pro的HFS随NaCl浓度的增大而增 大。将盐对pro的HF影响上式得: 其中HFSsalt为盐增加而引起的HFS值增量。 因此,m的一般形式
Pro表面疏水性(HFS, HF of surface) 利用上式可确定不同ATPS的HF值.如在pH = pI的ATPS中, pro的m0与HF值之间呈线性 关系, 则直线的斜率定义为该蛋白质的 HFS 图为蛋白质的m0与HF的实测关系图。图的结 果示:pro的HFS随NaCl浓度的增大而增 大。将盐对pro的HF影响上式得: 其中HFSsalt为盐增加而引起的HFS值增量。 因此,m的一般形式

19.4 影响蛋白质m的综合因素 1)成相聚合物浓度和分子量 分子量M: 若降低聚合物的M,则pro分配于富含该聚合 物的相中。如PEG/DX系统,若降低DX的M,则m减 小。这一规律具有普遍意义。 成相系统的总浓度:增大时,系统远离临界点,系线长度 增加,两相性质的差别(疏水性等)增大,蛋白质分子的分 配系数将偏离临界点处的值(m=1),即大于1或小于1. 因此,成相物质的总浓度越高,系线越长,蛋白质越容易 分配于其中的某一相.
19.4 影响蛋白质m的综合因素 1)成相聚合物浓度和分子量 分子量M: 若降低聚合物的M,则pro分配于富含该聚合 物的相中。如PEG/DX系统,若降低DX的M,则m减 小。这一规律具有普遍意义。 成相系统的总浓度:增大时,系统远离临界点,系线长度 增加,两相性质的差别(疏水性等)增大,蛋白质分子的分 配系数将偏离临界点处的值(m=1),即大于1或小于1. 因此,成相物质的总浓度越高,系线越长,蛋白质越容易 分配于其中的某一相.