
第十章共价键与分子间力内容提要第一节现代价键理论一、氢分子的形成氢分子的形成是两个氢原子互相靠近,两个单电子自旋相反,两个1s轨道重叠,形成稳定共价键的结果,称为氢分子的基态。如果两个单电子自旋相同,轨道重叠部分互相抵消,不能成键,称为氢分子的排斥态。共价键的本质是电性的,但不同于一般静电作用,其结合力是两核间的电子云密集区对核的吸引力。二、现代价键理论①成键两个原子各提供一个自旋相反的单电子配对,两原子轨道重叠,使电子云密集于两核间,系统能量降低,形成稳定共价键。②单电子配对形成共价键后,就不能再和其他单电子配对。所以每个原子所形成共价键的数目取决于该原子中的单电子数目。这就是共价键的饱和性。③成键的原子轨道相互尽可能最大程度重叠,决定了共价键的方向性。三、共价键的类型按原子轨道重叠方式,沿键轴方向,以“头碰头”方式重叠形成的共价键称为α键,S-S、S-px、px-px轨道之间可以形成α键;以"肩并肩"方式重叠形成的共价键称为Ⅱ键,py-py、pz-pz轨道之间可以形成几键。α键的轨道重叠程度比元键大,因而键比元键牢固。6键是构成分子的骨架,可单独存在于两原子间。根据成键电子来源,成键两原子各提供1个电子配对形成的共价键称为正常共价键,一个原子单独提供电子对进入另一个原子的空轨道形成的共价键为配位键。四、键参数描述共价键性质的参数有键能、键长、键角、键的极性等。键能是衡量
第十章 共价键与分子间力 内容提要 第一节 现代价键理论 一、氢分子的形成 氢分子的形成是两个氢原子互相靠近,两个单电子自旋相反,两个 1s 轨道重叠,形成稳定共价键的结果,称为氢分子的基态。如果两个单电子自 旋相同,轨道重叠部分互相抵消,不能成键,称为氢分子的排斥态。共价键 的本质是电性的,但不同于一般静电作用,其结合力是两核间的电子云密集 区对核的吸引力。 二、现代价键理论 ①成键两个原子各提供一个自旋相反的单电子配对,两原子轨道重叠, 使电子云密集于两核间,系统能量降低,形成稳定共价键。②单电子配对形 成共价键后,就不能再和其他单电子配对。所以每个原子所形成共价键的数 目取决于该原子中的单电子数目。这就是共价键的饱和性。③成键的原子轨 道相互尽可能最大程度重叠,决定了共价键的方向性。 三、共价键的类型 按原子轨道重叠方式,沿键轴方向,以“头碰头”方式重叠形成的共价键 称为 σ 键,s-s、s-px、px-px 轨道之间可以形成 σ 键;以“肩并肩”方式重叠 形成的共价键称为 л 键,py-py、pz-pz 轨道之间可以形成 л 键。σ 键的轨道 重叠程度比 π 键大,因而 σ 键比 π 键牢固。σ 键是构成分子的骨架,可单独 存在于两原子间。 根据成键电子来源,成键两原子各提供 1 个电子配对形成的共价键称为 正常共价键,一个原子单独提供电子对进入另一个原子的空轨道形成的共价 键为配位键。 四、键参数 描述共价键性质的参数有键能、键长、键角、键的极性等。键能是衡量
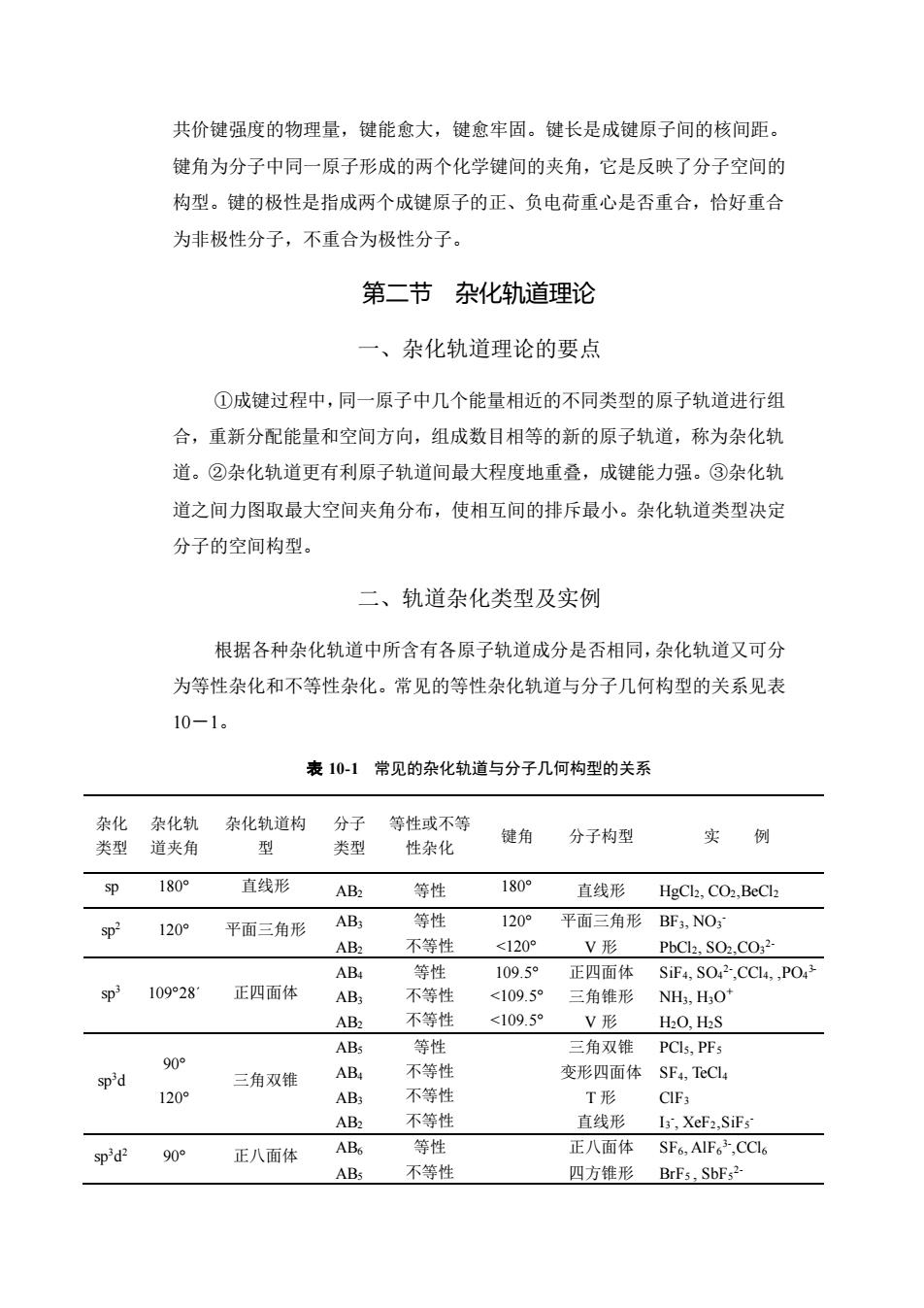
共价键强度的物理量,键能愈大,键愈牢固。键长是成键原子间的核间距。键角为分子中同一原子形成的两个化学键间的夹角,它是反映了分子空间的构型。键的极性是指成两个成键原子的正、负电荷重心是否重合,恰好重合为非极性分子,不重合为极性分子。第二节杂化轨道理论一、杂化轨道理论的要点①成键过程中,同一原子中几个能量相近的不同类型的原子轨道进行组合,重新分配能量和空间方向,组成数目相等的新的原子轨道,称为杂化轨道。②杂化轨道更有利原子轨道间最大程度地重叠,成键能力强。③杂化轨道之间力图取最大空间夹角分布,使相互间的排斥最小。杂化轨道类型决定分子的空间构型。二、轨道杂化类型及实例根据各种杂化轨道中所含有各原子轨道成分是否相同,杂化轨道又可分为等性杂化和不等性杂化。常见的等性杂化轨道与分子几何构型的关系见表10-1。表10-1常见的杂化轨道与分子几何构型的关系杂化杂化轨杂化轨道构分子等性或不等键角分子构型实例型类型道夹角类型性杂化180°直线形180°spAB2等性直线形HgCl2,CO2,BeCl2等性120°AB;平面三角形BF3, NO3sp2120°平面三角形不等性AB2<120°V形PbCl2,SO2,CO:2等性AB4109.5°正四面体SiF4, SO42,CCl4,,PO43sp3109°28°正四面体不等性<109.5°AB3三角锥形NH, H;O+不等性<109.5°AB2V形H2O, H2S等性ABs三角双锥PCls, PFs90°不等性AB4变形四面体SF4, TeCl4sp'd三角双锥不等性120°AB3T形CIF3AB2不等性直线形I3,XeF2,SiFsAB6等性正八面体SF6,AIF.CClsp'd290°正八面体不等性ABs四方锥形BrFs,SbFs2-
共价键强度的物理量,键能愈大,键愈牢固。键长是成键原子间的核间距。 键角为分子中同一原子形成的两个化学键间的夹角,它是反映了分子空间的 构型。键的极性是指成两个成键原子的正、负电荷重心是否重合,恰好重合 为非极性分子,不重合为极性分子。 第二节 杂化轨道理论 一、杂化轨道理论的要点 ①成键过程中,同一原子中几个能量相近的不同类型的原子轨道进行组 合,重新分配能量和空间方向,组成数目相等的新的原子轨道,称为杂化轨 道。②杂化轨道更有利原子轨道间最大程度地重叠,成键能力强。③杂化轨 道之间力图取最大空间夹角分布,使相互间的排斥最小。杂化轨道类型决定 分子的空间构型。 二、轨道杂化类型及实例 根据各种杂化轨道中所含有各原子轨道成分是否相同,杂化轨道又可分 为等性杂化和不等性杂化。常见的等性杂化轨道与分子几何构型的关系见表 10-1。 表 10-1 常见的杂化轨道与分子几何构型的关系 杂化 类型 杂化轨 道夹角 杂化轨道构 型 分子 类型 等性或不等 性杂化 键角 分子构型 实 例 sp 180° 直线形 AB2 等性 180° 直线形 HgCl2, CO2,BeCl2 sp2 120° 平面三角形 AB3 AB2 等性 不等性 120° <120° 平面三角形 V 形 BF3, NO3 - PbCl2, SO2,CO3 2- sp3 109°28´ 正四面体 AB4 AB3 AB2 等性 不等性 不等性 109.5° <109.5° <109.5° 正四面体 三角锥形 V 形 SiF4, SO4 2- ,CCl4, ,PO4 3- NH3, H3O + H2O, H2S sp3d 90° 120° 三角双锥 AB5 AB4 AB3 AB2 等性 不等性 不等性 不等性 三角双锥 变形四面体 T 形 直线形 PCl5, PF5 SF4, TeCl4 ClF3 I3 - , XeF2,SiF5 - sp3d 2 90° 正八面体 AB6 AB5 等性 不等性 正八面体 四方锥形 SF6, AlF6 3- ,CCl6 BrF5 , SbF5 2-
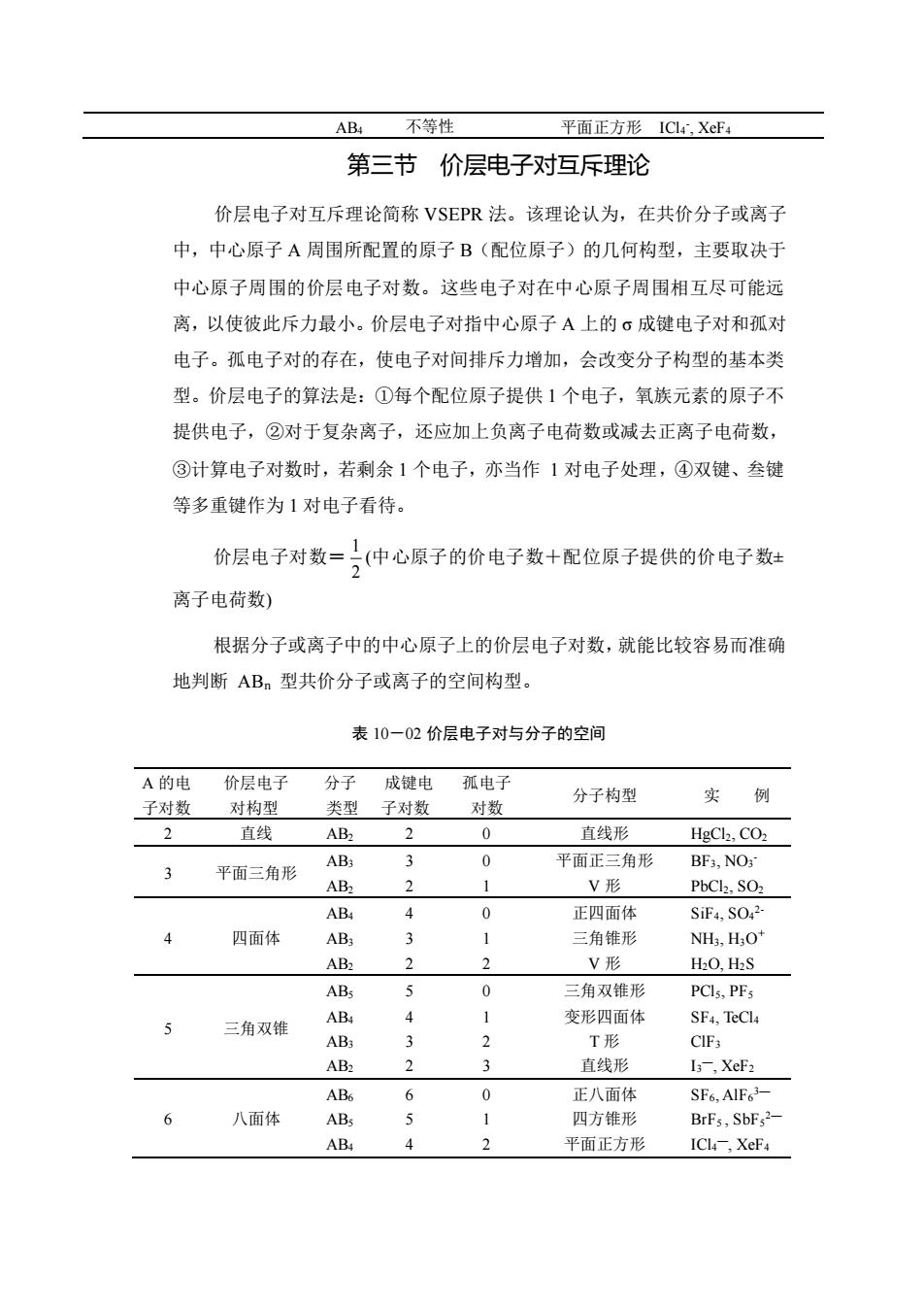
不等性AB4平面正方形ICl4XeF第三节价层电子对互斥理论价层电子对互斥理论简称VSEPR法。该理论认为,在共价分子或离子中,中心原子A周围所配置的原子B(配位原子)的几何构型,主要取决于中心原子周围的价层电子对数。这些电子对在中心原子周围相互尽可能远离,以使彼此斥力最小。价层电子对指中心原子A上的成键电子对和孤对电子。孤电子对的存在,使电子对间排斥力增加,会改变分子构型的基本类型。价层电子的算法是:①每个配位原子提供1个电子,氧族元素的原子不提供电子,②对于复杂离子,还应加上负离子电荷数或减去正离子电荷数,③计算电子对数时,若剩余1个电子,亦当作1对电子处理,④双键、叁键等多重键作为1对电子看待。价层电子对数=(中心原子的价电子数十配位原子提供的价电子数士2离子电荷数根据分子或离子中的中心原子上的价层电子对数,就能比较容易而准确地判断AB,型共价分子或离子的空间构型。表10-02价层电子对与分子的空间A的电价层电子分子成键电孤电子分子构型实例子对数对构型类型子对数对数2直线AB220直线形HgCl2, CO23AB30平面正三角形BF3, NO33平面三角形21AB2V形PbCl2, SO240AB4正四面体SiF4, SO,2-4四面体AB;31三角锥形NH3, H3O+22AB2V形H2O, H2SABs50三角双锥形PCls, PFs41AB4变形四面体SF4, TeCl45三角双锥32T形AB3CIF323AB2直线形I-, XeF2AB60SF6,AIF63-6正八面体156八面体ABs四方锥形BrFs,SbF,242AB4平面正方形ICl4-, XeF4
AB4 不等性 平面正方形 ICl4 - , XeF4 第三节 价层电子对互斥理论 价层电子对互斥理论简称 VSEPR 法。该理论认为,在共价分子或离子 中,中心原子 A 周围所配置的原子 B(配位原子)的几何构型,主要取决于 中心原子周围的价层电子对数。这些电子对在中心原子周围相互尽可能远 离,以使彼此斥力最小。价层电子对指中心原子 A 上的 σ 成键电子对和孤对 电子。孤电子对的存在,使电子对间排斥力增加,会改变分子构型的基本类 型。价层电子的算法是:①每个配位原子提供 1 个电子,氧族元素的原子不 提供电子,②对于复杂离子,还应加上负离子电荷数或减去正离子电荷数, ③计算电子对数时,若剩余 1 个电子,亦当作 1 对电子处理,④双键、叁键 等多重键作为 1 对电子看待。 价层电子对数= 2 1 (中心原子的价电子数+配位原子提供的价电子数± 离子电荷数) 根据分子或离子中的中心原子上的价层电子对数,就能比较容易而准确 地判断 ABn 型共价分子或离子的空间构型。 表 10-02 价层电子对与分子的空间 A 的电 子对数 价层电子 对构型 分子 类型 成键电 子对数 孤电子 对数 分子构型 实 例 2 直线 AB2 2 0 直线形 HgCl2, CO2 3 平面三角形 AB3 AB2 3 2 0 1 平面正三角形 V 形 BF3, NO3 - PbCl2, SO2 4 四面体 AB4 AB3 AB2 4 3 2 0 1 2 正四面体 三角锥形 V 形 SiF4, SO4 2- NH3, H3O + H2O, H2S 5 三角双锥 AB5 AB4 AB3 AB2 5 4 3 2 0 1 2 3 三角双锥形 变形四面体 T 形 直线形 PCl5, PF5 SF4, TeCl4 ClF3 I3 —, XeF2 6 八面体 AB6 AB5 AB4 6 5 4 0 1 2 正八面体 四方锥形 平面正方形 SF6, AlF6 3— BrF5 , SbF5 2— ICl4 —, XeF4

第四节分子轨道理论简介一、分子轨道理论的要点①分子轨道理论把分子作为一个整体考虑,分子中的电子不再从属于某个原子,而是在整个分子空间范围内运动。电子的运动状态用分子的波函数(称为分子轨道)来描述。②分子轨道的名称用6、元、8...符号表示。分子轨道可以由分子中原子轨道的线性组合(LCAO)而得到。几个原子轨道可组合成几个分子轨道:原子轨道线性相加组成的分子轨道称为成键分子轨道,其能量低于组合前原子轨道的能量;原子轨道线性相减组成的分子轨道称为反键分子轨道,能量高于组合前原子轨道的能量;非键分子轨道的能量等于组合前原子轨道的能量。③原子轨道线性组合成分子轨道必须符合对称性匹配原则、能量相近原则和最大重叠原则。圆柱形对称的原子轨道组成分子轨道:平面反对称的原子轨道组成元分子轨道。④电子在分子轨道中的排布也遵守Pauli不相容原理、能量最低原理和Hund规则。③在分子轨道理论中,用键级表示键的牢固程度。键级=一(成键轨道的电子数一反键轨道的电子数)2通常键级愈高,键能愈大,键愈稳定;键级为零,则原子不可能结合成分子。第二周期同核双原子分子的分子轨道能级图有两种类型(见教材),图10一13(a)适用于原子序数小的B、C、N、双原子分子,图10一13(b)适用于原子序数大的O2、F2等分子。根据不同的分子选择适当能级顺序,遵循电子排布规则可写出相应的分子轨道表示式。分子轨道中有单电子的分子具有顺磁性,无单电子的则具有反磁性。异核双原子分子的分子轨道能级图和分子轨道电子排布式不同于同核双原子分子,但同样遵循原子轨道线性组合成分子轨道的三条原则。第五节分子间的作用力分子间的作用力有vanderWaals力和氢键。vanderWaals力的产生与分子的极性和极化密切相关。分子的极化是指分子在外电场作用下发生的结构变化。vanderWaals力包括取向力、诱导力、色散力;其作用能只有几个到几十千焦每摩尔,约比化学键小1~2个数量级。大多数分子间的vanderWaals力以色散力为主,只有极性大的分子(如水分子)取
第四节 分子轨道理论简介 一、分子轨道理论的要点 ①分子轨道理论把分子作为一个整体考虑,分子中的电子不再从属于某个原 子,而是在整个分子空间范围内运动。电子的运动状态用分子的波函数 ψ(称为 分子轨道)来描述。②分子轨道的名称用 σ、π、δ.符号表示。分子轨道可以由 分子中原子轨道的线性组合(LCAO)而得到。几个原子轨道可组合成几个分子 轨道:原子轨道线性相加组成的分子轨道称为成键分子轨道,其能量低于组合前 原子轨道的能量;原子轨道线性相减组成的分子轨道称为反键分子轨道,能量高 于组合前原子轨道的能量;非键分子轨道的能量等于组合前原子轨道的能量。③ 原子轨道线性组合成分子轨道必须符合对称性匹配原则、能量相近原则和最大重 叠原则。圆柱形对称的原子轨道组成 σ 分子轨道;平面反对称的原子轨道组成 π 分子轨道。④电子在分子轨道中的排布也遵守 Pauli 不相容原理、能量最低原理 和 Hund 规则。⑤在分子轨道理论中,用键级表示键的牢固程度。 键级= 2 1 (成键轨道的电子数-反键轨道的电子数) 通常键级愈高,键能愈大,键愈稳定;键级为零,则原子不可能结合成分子。 第二周期同核双原子分子的分子轨道能级图有两种类型(见教材),图 10- 13(a)适用于原子序数小的 B、C 、N、双原子分子,图 10-13(b)适用于 原子序数大的 O2、F2 等分子。根据不同的分子选择适当能级顺序,遵循电子排 布规则可写出相应的分子轨道表示式。分子轨道中有单电子的分子具有顺磁性, 无单电子的则具有反磁性。 异核双原子分子的分子轨道能级图和分子轨道电子排布式不同于同核双原 子分子,但同样遵循原子轨道线性组合成分子轨道的三条原则。 第五节 分子间的作用力 分子间的作用力有 van der Waals 力和氢键。 van der Waals 力的产生与分子的极性和极化密切相关。分子的极化是指分 子在外电场作用下发生的结构变化。van der Waals 力包括取向力、诱导力、色散 力;其作用能只有几个到几十千焦每摩尔,约比化学键小 1~2 个数量级。大多 数分子间的 van der Waals 力以色散力为主,只有极性大的分子(如水分子)取

向力才比较显著,诱导力通常都很小。表10一03三种分子间作用力及其产生分子的极性分子间作用力的种类产生原因非极性分子之间色散力瞬时偶极非极性与极性分子之间色散力,诱导力瞬时偶极,诱导偶极瞬时偶极,诱导偶极,极性分子之间色散力,诱导力,取向力永久偶极当氢原子与电负性大,半径小的原子以共价键结合时,这种氢原子能与另一电负性大、半径小的有孤对电子的原子之间产生吸引作用,这种作用力称为氢键。氢键的键能一般在42kJ-mol-以下,它比化学键弱得多,但比vanderWaals力强。氢键具有饱和性和方向性。vanderWaals力及氢键的形成对物质的性质,如熔点、沸点、溶解度有一定影响。难题解析例10一1试用杂化轨道理论说明乙烯分子的形成及其构型。析根据杂化轨道理论,形成乙烯分子时,C原子的价层电子要杂化。共价键形成时,6键在成键两原子间能单独存在,且只存在一个;几键在成键两原子间不能单独存在,但可存在多个。乙烯分子中C原子的4个价电子分别与其它原子形成三个α键,C、C原子间的双键中有一个是几键。三个α键决定分子构型,因此C原子有三个原子轨道参与杂化,形成三个等性杂化轨道。解乙烯分子C2H4中有2个C原子和4个H原子,每个基态C原子的价层电子组态为2s22p2,在形成乙烯分子的过程中,1个2s电子被激发到2p空轨道上,然后1个2s轨道和2个2p轨道杂化形成3个等同的sp2杂化轨道,彼此间夹角为120%。每个C原子的2个sp?杂化轨道各与1个H原子的1s轨道重叠形成2个C一H键;2个C原子间各以1个sp2杂化轨道互相重叠,形成1个c键。由于2个C原子的这6个sp2杂化轨道处于同一平面,未参与杂化的2pz轨道则垂直于该平面,“肩并肩”重叠形成1个元键,构成C=C双键。乙烯分子中6个原子在一个平面上,分子呈平面构型。例10-2利用价层电子对互斥理论预测13°的空间构型。析先确定中心原子的价电子对数,中心原子提供7个电子,配位提供1个电子,加上负离子的电荷数,得价层电子数的总和再除以2。然后根据价层电子
向力才比较显著,诱导力通常都很小。 表 10-03 三种分子间作用力及其产生 分子的极性 分子间作用力的种类 产生原因 非极性分子之间 色散力 瞬时偶极 非极性与极性分子之间 色散力,诱导力 瞬时偶极,诱导偶极 极性分子之间 色散力,诱导力,取向力 瞬时偶极,诱导偶极, 永久偶极 当氢原子与电负性大,半径小的原子以共价键结合时,这种氢原子能与另一 电负性大、半径小的有孤对电子的原子之间产生吸引作用,这种作用力称为氢键。 氢键的键能一般在 42 kJ· mol-1 以下,它比化学键弱得多,但比 van der Waals 力强。氢键具有饱和性和方向性。 van der Waals 力及氢键的形成对物质的性质,如熔点、沸点、溶解度有一定 影响。 难题解析 例 10-1 试用杂化轨道理论说明乙烯分子的形成及其构型。 析 根据杂化轨道理论,形成乙烯分子时,C 原子的价层电子要杂化。共价 键形成时,σ 键在成键两原子间能单独存在,且只存在一个;л 键在成键两原子 间不能单独存在,但可存在多个。乙烯分子中 C 原子的 4 个价电子分别与其它 原子形成三个 σ 键,C、C 原子间的双键中有一个是 л 键。三个 σ 键决定分子构 型,因此 C 原子有三个原子轨道参与杂化,形成三个等性杂化轨道。 解 乙烯分子 C2H4 中有 2 个 C 原子和 4 个 H 原子,每个基态 C 原子的价层 电子组态为 2s2 2p2,在形成乙烯分子的过程中,1 个 2s 电子被激发到 2p 空轨道 上,然后 1 个 2s 轨道和 2 个 2p 轨道杂化形成 3 个等同的 sp2 杂化轨道,彼此间 夹角为 120º。每个 C 原子的 2 个 sp2 杂化轨道各与 1 个 H 原子的 1s 轨道重叠形 成 2 个 C—H σ 键;2 个 C 原子间各以 1 个 sp2 杂化轨道互相重叠,形成 1 个 σ 键。 由于 2 个 C 原子的这 6 个 sp2 杂化轨道处于同一平面,未参与杂化的 2pz 轨道则垂直于该平面, “肩并肩” 重叠形成 1 个 π 键,构成 C=C 双键。 乙烯分子中 6 个原子在一个平面上,分子呈平面构型。 例 10-2 利用价层电子对互斥理论预测 I3 - 的空间构型。 析 先确定中心原子的价电子对数,中心原子提供 7 个电子,配位提供 1 个 电子,加上负离子的电荷数,得价层电子数的总和再除以 2。然后根据价层电子