
石河子大学教案课程名称医用基础化学实验任课班级临床2011-1,10班预防2011-1班任课教师薛梅学院化学化工学院化学系二 0二0一二学年第一学期2011.8 -2012.1
石 河 子 大 学 教 案 课程名称 医用基础化学实验 任课班级 临床 2011-1,10 班 预防 2011-1 班 任课教师 薛 梅 学院 化学化工学院化学系 二 O 一一——二 O 一二 学年 第 一 学期 2011.8 -2012.1
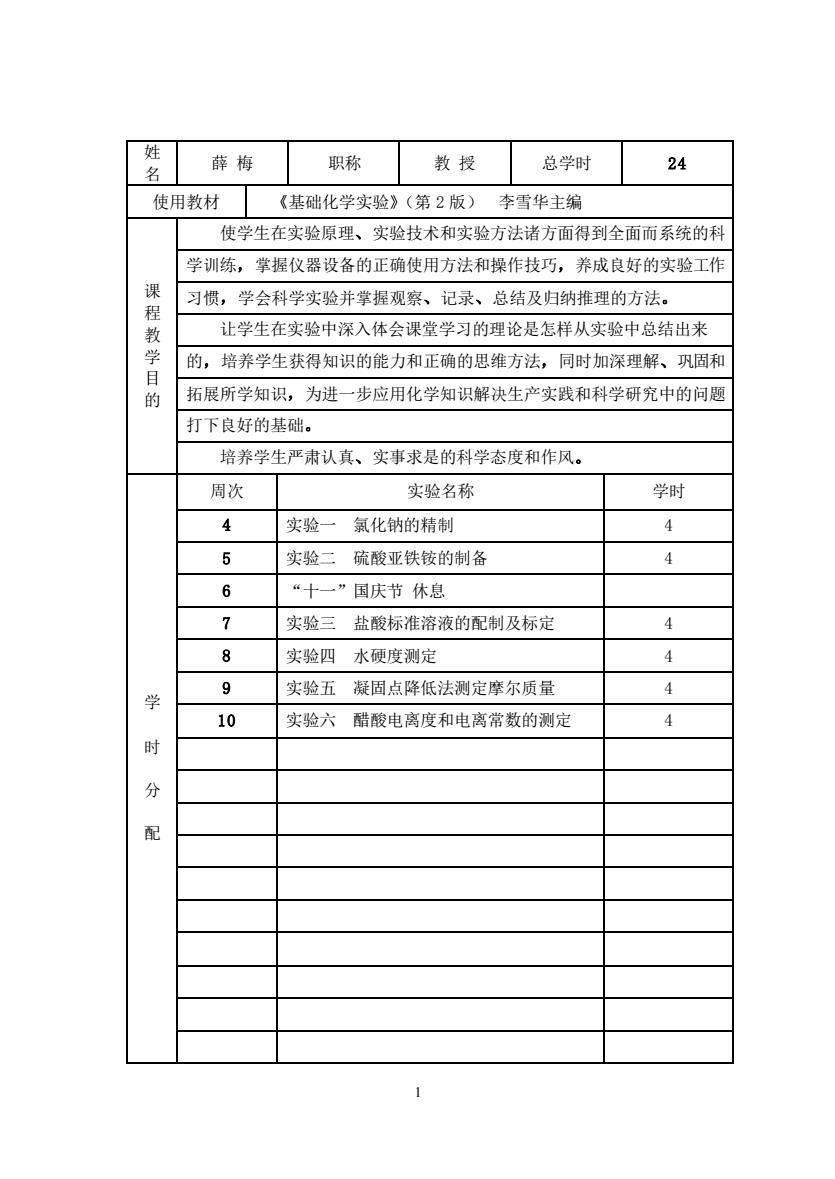
姓薛梅职称教授总学时24名使用教材《基础化学实验》(第2版)李雪华主编使学生在实验原理、实验技术和实验方法诸方面得到全面而系统的科学训练,掌握仪器设备的正确使用方法和操作技巧,养成良好的实验工作课习惯,学会科学实验并掌握观察、记录、总结及归纳推理的方法。程让学生在实验中深入体会课堂学习的理论是怎样从实验中总结出来教学的,培养学生获得知识的能力和正确的思维方法,同时加深理解、巩固和目拓展所学知识,为进一步应用化学知识解决生产实践和科学研究中的问题的打下良好的基础。培养学生严肃认真、实事求是的科学态度和作风。周次学时实验名称44实验/氯化钠的精制54实验二硫酸亚铁铵的制备6"+国庆节休息74实验三盐酸标准溶液的配制及标定84实验四水硬度测定94实验五凝固点降低法测定摩尔质量学410实验六醋酸电离度和电离常数的测定时分配1
1 姓 名 薛 梅 职称 教 授 总学时 24 使用教材 《基础化学实验》(第 2 版) 李雪华主编 课 程 教 学 目 的 使学生在实验原理、实验技术和实验方法诸方面得到全面而系统的科 学训练,掌握仪器设备的正确使用方法和操作技巧,养成良好的实验工作 习惯,学会科学实验并掌握观察、记录、总结及归纳推理的方法。 让学生在实验中深入体会课堂学习的理论是怎样从实验中总结出来 的,培养学生获得知识的能力和正确的思维方法,同时加深理解、巩固和 拓展所学知识,为进一步应用化学知识解决生产实践和科学研究中的问题 打下良好的基础。 培养学生严肃认真、实事求是的科学态度和作风。 学 时 分 配 周次 实验名称 学时 4 实验一 氯化钠的精制 4 5 实验二 硫酸亚铁铵的制备 4 6 “十一”国庆节 休息 7 实验三 盐酸标准溶液的配制及标定 4 8 实验四 水硬度测定 4 9 实验五 凝固点降低法测定摩尔质量 4 10 实验六 醋酸电离度和电离常数的测定 4
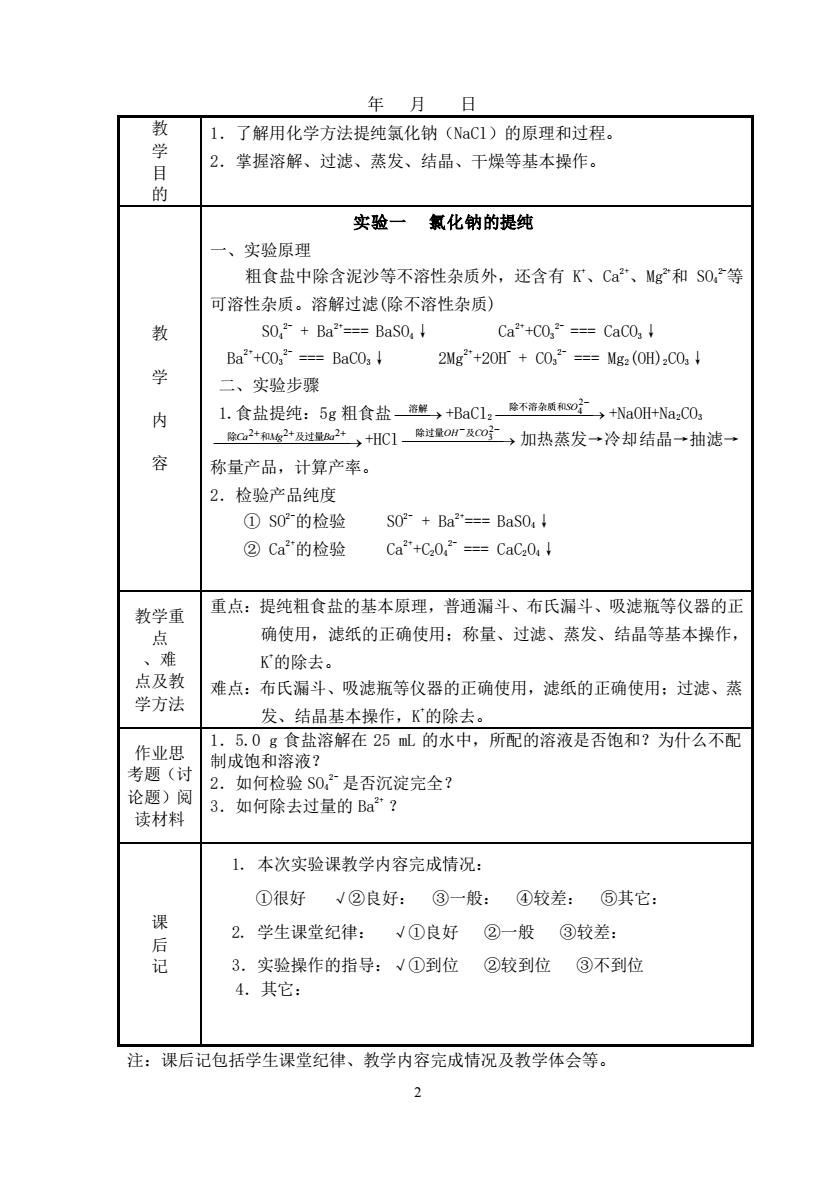
年月日教1.了解用化学方法提纯氯化钠(NaC1)的原理和过程。学2.掌握溶解、过滤、蒸发、结晶、干燥等基本操作。目的实验一氯化钠的提纯一、实验原理粗食盐中除含泥沙等不溶性杂质外,还含有K、Ca2+、Mg*和SO等可溶性杂质。溶解过滤(除不溶性杂质)教SO,2- + Ba2*--= BaSO, ↓Ca**+CO,2-=-= CaCO, Ba2*+CO.-== BaCO; ↓2Mg**+2OH + CO3=== Mg2 (OH)2CO3 ↓学二、实验步骤1.食盐提纯:5g 粗食盐—选鲜+BaC1。除不蒂杂质和so→+NaOH+Na.CO3内除过量H-及CO%,加热蒸发→冷却结晶抽滤→除C2+和M2+及过量Ba2++HC1容称量产品,计算产率。2.检验产品纯度①SO°的检验S02-+ Ba**--= BaSO,!②Ca的检验Ca2++C20,2---= CaC20, 1重点:提纯粗食盐的基本原理,普通漏斗、布氏漏斗、吸滤瓶等仪器的正教学重确使用,滤纸的正确使用:称量、过滤、蒸发、结晶等基本操作,点、难K的除去。点及教难点:布氏漏斗、吸滤瓶等仪器的正确使用,滤纸的正确使用:过滤、蒸学方法发、结晶基本操作,K的除去。1.5.0g食盐溶解在25mL的水中,所配的溶液是否饱和?为什么不配作业思制成饱和溶液?考题(讨2.如何检验S02是否沉淀完全?论题)阅3.如何除去过量的Ba2?读材料1.本次实验课教学内容完成情况:①很好√②良好:③一般:④较差:?其它:课③较差:2.学生课堂纪律:#①良好②一般后记②较到位③不到位3.实验操作的指导:V①到位4.其它:注:课后记包括学生课堂纪律、教学内容完成情况及教学体会等。2
2 年 月 日 教 学 目 的 1.了解用化学方法提纯氯化钠(NaCl)的原理和过程。 2.掌握溶解、过滤、蒸发、结晶、干燥等基本操作。 教 学 内 容 实验一 氯化钠的提纯 一、实验原理 粗食盐中除含泥沙等不溶性杂质外,还含有 K +、Ca2+、Mg2+和 SO4 2-等 可溶性杂质。溶解过滤(除不溶性杂质) SO4 2- + Ba2+=== BaSO4↓ Ca2++CO3 2- === CaCO3↓ Ba2++CO3 2- === BaCO3↓ 2Mg2++2OH- + CO3 2- === Mg2(OH)2CO3↓ 二、实验步骤 1.食盐提纯:5g 粗食盐 ⎯溶解⎯→ +BaCl2 ⎯⎯⎯⎯⎯⎯⎯→ 2− 4 除不溶杂质和SO +NaOH+Na2CO3 ⎯⎯⎯⎯⎯⎯⎯⎯⎯→ 2+ 2+ 2+ 除Ca 和Mg 及过量Ba +HCl ⎯⎯⎯⎯⎯⎯⎯→ − 2− 3 除过量OH 及CO 加热蒸发→冷却结晶→抽滤→ 称量产品,计算产率。 2.检验产品纯度 ① SO2-的检验 SO2- + Ba2+=== BaSO4↓ ② Ca2+的检验 Ca2++C2O4 2- === CaC2O4↓ 教学重 点 、难 点及教 学方法 重点:提纯粗食盐的基本原理,普通漏斗、布氏漏斗、吸滤瓶等仪器的正 确使用,滤纸的正确使用;称量、过滤、蒸发、结晶等基本操作, K +的除去。 难点:布氏漏斗、吸滤瓶等仪器的正确使用,滤纸的正确使用;过滤、蒸 发、结晶基本操作,K +的除去。 作业思 考题(讨 论题)阅 读材料 1.5.0 g 食盐溶解在 25 mL 的水中,所配的溶液是否饱和?为什么不配 制成饱和溶液? 2.如何检验 SO4 2- 是否沉淀完全? 3.如何除去过量的 Ba2+ ? 课 后 记 1. 本次实验课教学内容完成情况: ①很好 √②良好: ③一般: ④较差: ⑤其它: 2. 学生课堂纪律: √①良好 ②一般 ③较差: 3.实验操作的指导:√①到位 ②较到位 ③不到位 4.其它: 注:课后记包括学生课堂纪律、教学内容完成情况及教学体会等

年月日教学1.了解复盐制备的原理。目的2.练习水浴加热、常压及减压过滤、蒸发、浓缩、结晶和干燥等基本操作。实验二硫酸亚铁铵的制备一、实验原理Fe+H2SO,=-= FeSO,+H2FeSO,+(NH,)2SO,+6H,0=== (NH,),SO,FeSO, 6H,0教二、实验步骤学1.硫酸亚铁的制备内4.0gFe粉+25m13MH2S0a,水浴加热30min至反应基本无气泡,抽滤,滤液加1m13MHzSO.备用。容2.硫酸亚铁铵的制备加适量(NH),SO.于上述硫酸亚铁溶液中,水浴加热至全溶,继续蒸发浓缩至表面出现晶膜为止,静置、冷却、析晶、抽滤,洗涤、二次抽滤,称重,计算产率。重点:控制反应温度、抽滤操作教学重点、难点:控制蒸发浓缩时的反应温度难点及教方法:讲解:演示;学生动手操作;个别指导;签字并检查;总结:打扫卫生:学方法实验结束。作业、思考为何制备产品时溶液必须呈酸性?蒸发浓缩时是否需搅拌?题(讨论2.在蒸发浓缩过程中,若发现溶液变为黄色,是什么原因?应如何处理?题)、阅读3.制备产品时,如何判断反应基本完成?为何最后还要加入1ml1MH2SO.?材料1.本次实验课教学内容完成情况:①很好V②良好:③一般:④较差:③其它:题后2.学生课堂纪律:①良好V②一般③较差:记③不到位3实验操作的指导:V①到位②较到位4.其它:注:课后记包括学生课堂纪律、教学内容完成情况及教学体会等。3
3 年 月 日 教学 目的 1.了解复盐制备的原理。 2.练习水浴加热、常压及减压过滤、蒸发、浓缩、结晶和干燥等基本操作。 教 学 内 容 实验二 硫酸亚铁铵的制备 一、实验原理 Fe+H2SO4=== FeSO4+H2 FeSO4+(NH4)2SO4+6H2O=== (NH4)2SO4 FeSO4 6H2O 二、实验步骤 1.硫酸亚铁的制备 4.0gFe 粉+25ml3MH2SO4,水浴加热 30min 至反应基本无气泡,抽滤,滤 液加 1ml3MH2SO4 备用。 2.硫酸亚铁铵的制备 加适量(NH4)2SO4 于上述硫酸亚铁溶液中,水浴加热至全溶,继续蒸发浓 缩至表面出现晶膜为止,静置、冷却、析晶、抽滤,洗涤、二次抽滤,称重, 计算产率。 教学重点、 难点及教 学方法 重点:控制反应温度、抽滤操作 难点:控制蒸发浓缩时的反应温度 方法:讲解;演示;学生动手操作;个别指导;签字并检查;总结;打扫卫生; 实验结束。 作业、思考 题(讨论 题)、阅读 材料 1. 为何制备产品时溶液必须呈酸性?蒸发浓缩时是否需搅拌? 2. 在蒸发浓缩过程中,若发现溶液变为黄色,是什么原因?应如何处理? 3. 制备产品时,如何判断反应基本完成?为何最后还要加入 1ml1MH2SO4? 题 后 记 1. 本次实验课教学内容完成情况: ①很好 √②良好: ③一般: ④较差: ⑤其它: 2. 学生课堂纪律: ①良好 √②一般 ③较差: 3.实验操作的指导:√①到位 ②较到位 ③不到位 4.其它: 注:课后记包括学生课堂纪律、教学内容完成情况及教学体会等
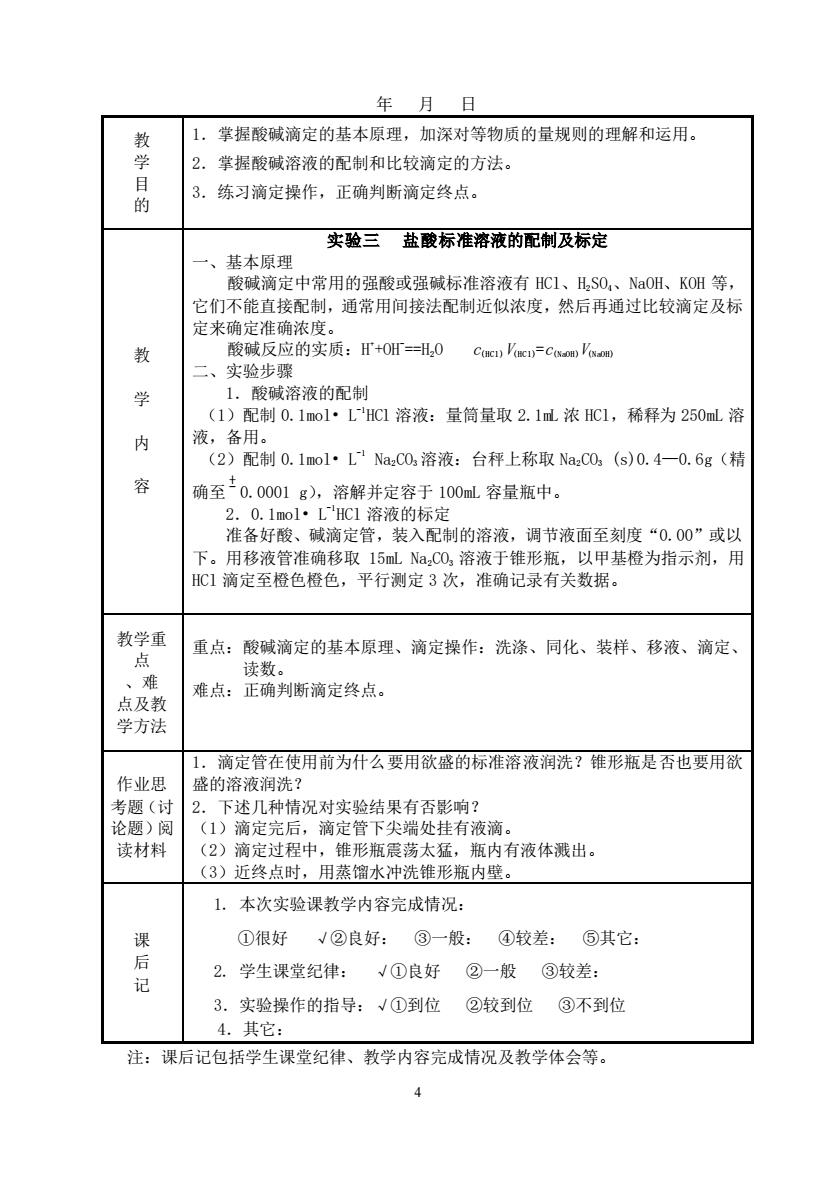
年月日1.掌握酸碱滴定的基本原理,加深对等物质的量规则的理解和运用。教学2.掌握酸碱溶液的配制和比较滴定的方法。目3:练习滴定操作,正确判断滴定终点。的实验三盐酸标准溶液的配制及标定一、基本原理酸碱滴定中常用的强酸或强碱标准溶液有HC1、H,SO,、NaOH、KOH等,它们不能直接配制,通常用间接法配制近似浓度,然后再通过比较滴定及标定来确定准确浓度。酸碱反应的实质:H+OH==H,0C(nc) V(mci)=C(saom)V(oaom教二、实验步骤1.酸碱溶液的配制学(1)配制0.1mol·LHCl溶液:量筒量取2.1mL浓HCl,稀释为250mL溶液,备用。内(2)配制0.1mo1·L"NazCO溶液:台秤上称取NazCO(s)0.4—0.6g(精容确至0.0001g),溶解并定容于100mL容量瓶中。2.0.1mo1·LHC1溶液的标定准备好酸、碱滴定管,装入配制的溶液,调节液面至刻度“0.00”或以下。用移液管准确移取15mLNa,CO,溶液于锥形瓶,以甲基橙为指示剂,用HC1滴定至橙色橙色,平行测定3次,准确记录有关数据。教学重重点:酸碱滴定的基本原理、滴定操作:洗涤、同化、装样、移液、滴定、点读数。、难难点:正确判断滴定终点。点及教学方法1.滴定管在使用前为什么要用欲盛的标准溶液润洗?锥形瓶是否也要用欲作业思盛的溶液润洗?考题(讨2.下述几种情况对实验结果有否影响?论题)阅(1)滴定完后,滴定管下尖端处挂有液滴。读材料(2)滴定过程中,锥形瓶震荡太猛,瓶内有液体溅出。(3)近终点时,用蒸馏水冲洗锥形瓶内壁。1.本次实验课教学内容完成情况:课①很好②良好:③一般:较差:③其它:后√①良好②一般③较差:2.学生课堂纪律:记3.实验操作的指导:√①到位②较到位③不到位4.其它:注:课后记包括学生课堂纪律、教学内容完成情况及教学体会等。4
4 年 月 日 教 学 目 的 1.掌握酸碱滴定的基本原理,加深对等物质的量规则的理解和运用。 2.掌握酸碱溶液的配制和比较滴定的方法。 3.练习滴定操作,正确判断滴定终点。 教 学 内 容 实验三 盐酸标准溶液的配制及标定 一、基本原理 酸碱滴定中常用的强酸或强碱标准溶液有 HCl、H2SO4、NaOH、KOH 等, 它们不能直接配制,通常用间接法配制近似浓度,然后再通过比较滴定及标 定来确定准确浓度。 酸碱反应的实质:H + +OH- ==H2O c(HCl)V(HCl)=c(NaOH)V(NaOH) 二、实验步骤 1.酸碱溶液的配制 (1)配制 0.1mol• L -1 HCl 溶液:量筒量取 2.1mL 浓 HCl,稀释为 250mL 溶 液,备用。 (2)配制 0.1mol• L -1 Na2CO3 溶液:台秤上称取 Na2CO3 (s)0.4—0.6g(精 确至 + - 0.0001 g),溶解并定容于 100mL 容量瓶中。 2.0.1mol• L -1 HCl 溶液的标定 准备好酸、碱滴定管,装入配制的溶液,调节液面至刻度“0.00”或以 下。用移液管准确移取 15mL Na2CO3 溶液于锥形瓶,以甲基橙为指示剂,用 HCl 滴定至橙色橙色,平行测定 3 次,准确记录有关数据。 教学重 点 、难 点及教 学方法 重点:酸碱滴定的基本原理、滴定操作:洗涤、同化、装样、移液、滴定、 读数。 难点:正确判断滴定终点。 作业思 考题(讨 论题)阅 读材料 1.滴定管在使用前为什么要用欲盛的标准溶液润洗?锥形瓶是否也要用欲 盛的溶液润洗? 2.下述几种情况对实验结果有否影响? (1)滴定完后,滴定管下尖端处挂有液滴。 (2)滴定过程中,锥形瓶震荡太猛,瓶内有液体溅出。 (3)近终点时,用蒸馏水冲洗锥形瓶内壁。 课 后 记 1. 本次实验课教学内容完成情况: ①很好 √②良好: ③一般: ④较差: ⑤其它: 2. 学生课堂纪律: √①良好 ②一般 ③较差: 3.实验操作的指导:√①到位 ②较到位 ③不到位 4.其它: 注:课后记包括学生课堂纪律、教学内容完成情况及教学体会等