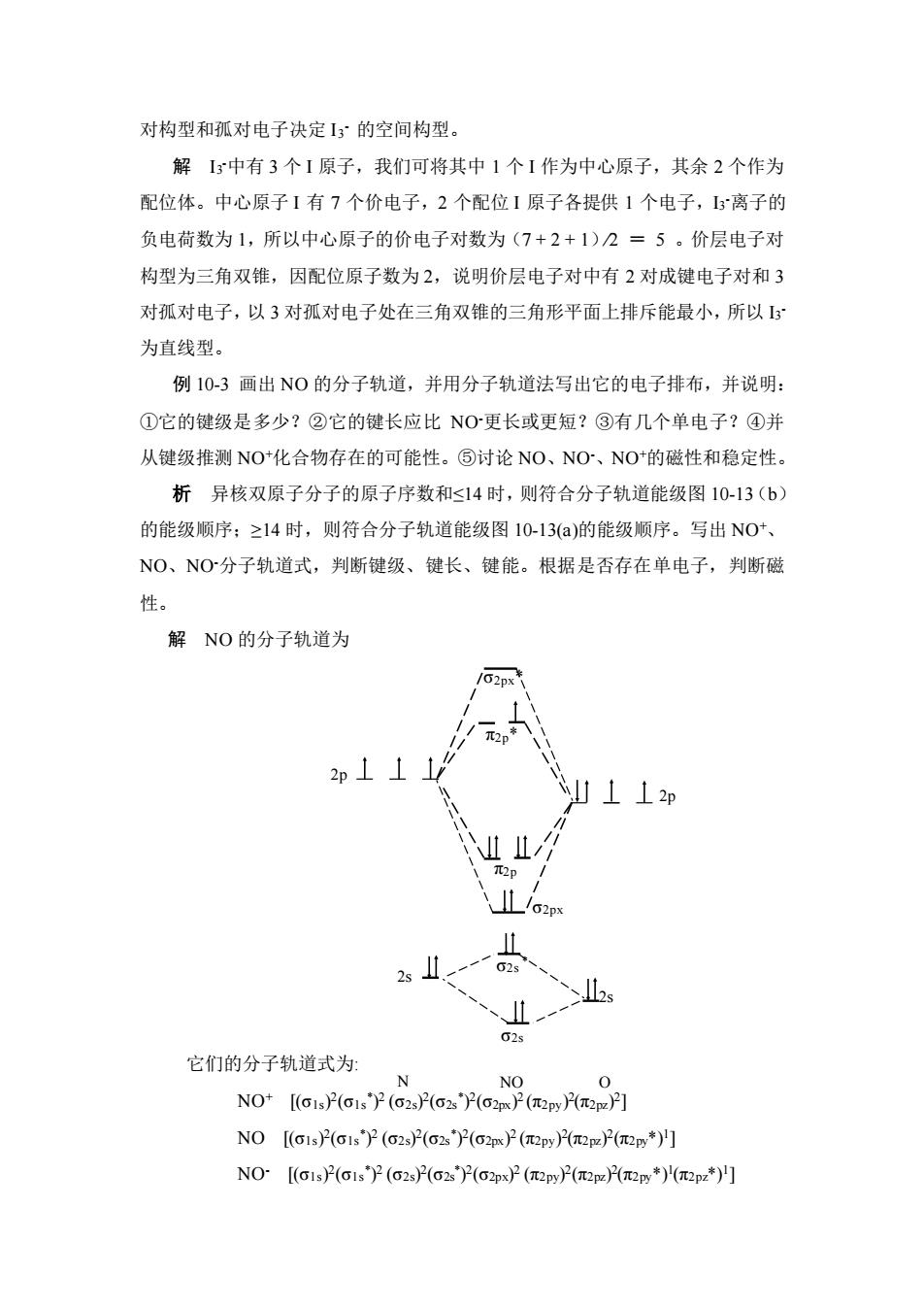
对构型和孤对电子决定I3°的空间构型。解I3中有3个1原子,我们可将其中1个I作为中心原子,其余2个作为配位体。中心原子1有7个价电子,2个配位1原子各提供1个电子,I3离子的负电荷数为1,所以中心原子的价电子对数为(7+2+1)2=5。价层电子对构型为三角双锥,因配位原子数为2,说明价层电子对中有2对成键电子对和3对孤对电子,以3对孤对电子处在三角双锥的三角形平面上排斥能最小,所以I3为直线型。例10-3画出NO的分子轨道,并用分子轨道法写出它的电子排布,并说明:①它的键级是多少?②它的键长应比NO-更长或更短?③有几个单电子?④并从键级推测NO+化合物存在的可能性。③讨论NO、NO-、NO+的磁性和稳定性。析异核双原子分子的原子序数和<14时,则符合分子轨道能级图10-13(b)的能级顺序;≥14时,则符合分子轨道能级图10-13(a)的能级顺序。写出NO+、NO、NO-分子轨道式,判断键级、键长、键能。根据是否存在单电子,判断磁性。解NO的分子轨道为/02px112p士12p/L1元2pIf02s它们的分子轨道式为:NNO0NO+[(α1s)(01s)2 (02s)(02s)2(02px)(元/2py)(元2pz)]NO[(α1s)(α1s ) (02s)(α2s)(@2px)(元2py)(元2pz)(元2py*)’]NO-[(α1s)(α1s*)2 (α2s)(α2s)(@2px)2 (元2py)P(元2pz)(元2py*)(元2pz*)"]
对构型和孤对电子决定 I3 - 的空间构型。 解 I3 -中有 3 个 I 原子,我们可将其中 1 个 I 作为中心原子,其余 2 个作为 配位体。中心原子 I 有 7 个价电子,2 个配位 I 原子各提供 1 个电子,I3 -离子的 负电荷数为 1,所以中心原子的价电子对数为(7 + 2 + 1)∕2 = 5 。价层电子对 构型为三角双锥,因配位原子数为 2,说明价层电子对中有 2 对成键电子对和 3 对孤对电子,以 3 对孤对电子处在三角双锥的三角形平面上排斥能最小,所以 I3 - 为直线型。 例 10-3 画出 NO 的分子轨道,并用分子轨道法写出它的电子排布,并说明: ①它的键级是多少?②它的键长应比 NO-更长或更短?③有几个单电子?④并 从键级推测 NO+化合物存在的可能性。⑤讨论 NO、NO-、NO+的磁性和稳定性。 析 异核双原子分子的原子序数和≤14 时,则符合分子轨道能级图 10-13(b) 的能级顺序;≥14 时,则符合分子轨道能级图 10-13(a)的能级顺序。写出 NO+、 NO、NO-分子轨道式,判断键级、键长、键能。根据是否存在单电子,判断磁 性。 解 NO 的分子轨道为 它们的分子轨道式为: NO+ [(σ1s) 2 (σ1s* ) 2 (σ2s) 2 (σ2s* ) 2 (σ2px) 2 (π2py) 2 (π2pz) 2 ] NO [(σ1s) 2 (σ1s * ) 2 (σ2s) 2 (σ2s * ) 2 (σ2px) 2 (π2py) 2 (π2pz) 2 (π2py*)1 ] NO- [(σ1s) 2 (σ1s * ) 2 (σ2s) 2 (σ2s * ) 2 (σ2px) 2 (π2py) 2 (π2pz) 2 (π2py*)1 (π2pz*)1 ] 2p 2s 2p σ2px* σ2px σ2s * σ2s π2p π2p* 2s N NO O

①NO 的键级=10=5=2.5;NO-的键级=10=2:NO+的键级=10-4=3。222②由于NO-的键级比NO的键级小,故NO-的键长比NO的键长长。③NO分子有一个单电子。④从键级3推测,NO+可能存在。③NO有1个单电子,顺磁性;NO有2个单电子,顺磁性:NO+没有单电子,反磁性。一般而言,键级愈大,键愈牢固,故它们的稳定性顺序为NO+>NO>NO例10-4下列说法是否正确?说明理由。(1)非极性分子中不含极性键。(2)直线型分子一定是非极性分子。(3)非金属单质的分子间只存在色散力。(4)对羟基苯甲醛的熔点比邻羟基苯甲醛的熔点高。解(1)说法不正确。有的分子含极性键,但空间构型完全对称,键的极性可以相互抵消,因而是非极性分子。(2)说法不正确。双原子分子都是直线型,同核双原子分子化学键无极性,分子非极性;异核双原子分子化学键有极性,分子极性。多原子直线型分子中,若相同原子所形成的空间构型对称、键的极性可以相互抵消,分子非极性。如CO2:O=C=O。而由不同原子所形成的及空间构型不对称,键的极性不能相互抵消,为极性分子。如H一C=N。(3)说法不正确。非金属单质分子通常是非极性分子,分子间的作用力通常为色散力。但臭氧(O3)分子的空间构型为V形,>0,为极性分子,故分子之间存在取向力、诱导力和色散力。(4)说法正确。对羟基苯甲醛存在着分子间氢键,而邻羟基苯甲醛存在着分子内氢键,对羟基苯甲醛分子间的作用力远大于邻羟基苯甲醛分子间的作用力,熔化对羟基苯甲醛时必须消耗额外的能量去破坏分子间氢键,故对羟基苯甲醛的熔点高于邻羟基苯甲醛的熔点。例10-5某一化合物的分子式为AB2,A属第六主族元素,B属第七主族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98。试回答下列问题:(1)已知AB2分子的键角为103.3,推测AB2分子的中心原子A成键时采取
①NO 的键级= 2.5 2 10 5 = - ;NO-的键级= 2 2 10 6 = - ;NO+的键级= 3 2 10 4 = - 。 ②由于 NO-的键级比 NO 的键级小,故 NO-的键长比 NO 的键长长。 ③NO 分子有一个单电子。 ④从键级 3 推测,NO+可能存在。 ⑤NO 有 1 个单电子,顺磁性;NO-有 2 个单电子,顺磁性;NO+没有单电 子,反磁性。一般而言,键级愈大,键愈牢固,故它们的稳定性顺序为 NO+ >NO > NO- 例 10-4 下列说法是否正确?说明理由。 (1) 非极性分子中不含极性键。 (2) 直线型分子一定是非极性分子。 (3) 非金属单质的分子间只存在色散力。 (4) 对羟基苯甲醛的熔点比邻羟基苯甲醛的熔点高。 解 (1) 说法不正确。有的分子含极性键,但空间构型完全对称,键的极性 可以相互抵消,因而是非极性分子。 (2) 说法不正确。双原子分子都是直线型,同核双原子分子化学键无极性, 分子非极性;异核双原子分子化学键有极性,分子极性。多原子直线型分子中, 若相同原子所形成的空间构型对称、键的极性可以相互抵消,分子非极性。如 CO2:O=C=O。而由不同原子所形成的及空间构型不对称,键的极性不能相互抵 消,为极性分子。如 H—C≡N。 (3) 说法不正确。非金属单质分子通常是非极性分子,分子间的作用力通常 为色散力。但臭氧(O3) 分子的空间构型为 V 形,μ> 0,为极性分子,故分子之 间存在取向力、诱导力和色散力。 (4) 说法正确。对羟基苯甲醛存在着分子间氢键,而邻羟基苯甲醛存在着分 子内氢键,对羟基苯甲醛分子间的作用力远大于邻羟基苯甲醛分子间的作用力, 熔化对羟基苯甲醛时必须消耗额外的能量去破坏分子间氢键,故对羟基苯甲醛的 熔点高于邻羟基苯甲醛的熔点。 例 10-5 某一化合物的分子式为 AB2,A 属第六主族元素,B 属第七主族元 素,A 和 B 在同一周期,它们的电负性值分别为 3.44 和 3.98 。试回答下列问题: (1) 已知 AB2 分子的键角为 103.3º,推测 AB2 分子的中心原子 A 成键时采取

的杂化类型及AB2分子的空间构型。(2)A-B键的极性如何?AB2分子的极性如何?(3)AB2分子间存在哪些作用力?(5)AB2与H2O相比,何者的熔点、沸点较高?解(1)根据A、B的电负性值,可判断A元素为O,B元素为F,该分子为OF2。根据键角103.3°,知道该分子中O原子以不等性sp3杂化轨道与F原子成键,两个单电子sp3杂化轨道各与1个F原子的单电子2px轨道重叠形成sp3-p的键,余下的2个sp3杂化轨道各被1对孤对电子占据,对成键电子对产生较大的排斥,致使键角压缩(<109°28"),故OF2分子的空间构型为V形。(2)0一F键为极性共价键。OF2分子中键的极性不能抵消,为极性分子。(3)OF2分子间存在取向力、诱导力及色散力,其中色散力是主要的。(4)OF2分子中无H原子,分子间不能形成氢键,而H2O分子间能形成氢键,故OF2的熔点、沸点比H2O的低。相关知识介绍酶超分子结构化学一软化学键超分子化学已成为化学、生命科学、材料科学和信息科学等领域研究的热点和纽带。超分子化学至少有两点启示:一是分子间弱相互作用力在一定条件下可转化为强结合能:二是分子组装成的超分子体系可具有完全不同于原组成成分的全新性能。在众多化学和生物超分子体系中,酶超分子是最理想的模型超分子。不同结构类型的酶聚集体在动力学特征和生物学功能上很不相同。随着酶结构复杂程度的提升,相应新的性能不断突现。酶超分子体系与单体酶比较,功能上有如下优越性:反应方向和速率的高调节效率;体系化特征(一个信号可多方向传递等);反馈调控机制;多样性功能;高层次的识别反应等。对酶超分子体系的这些神奇功能的解释,依赖于对“软化学键的认识。酶超分子系统所具有的独特有序结构和新的宏观特性正是以其组分分子间非共价键弱相互作用力一一软化学键为基础的。有别于分子和配合物,超分子是主体和客体在满足能量匹配、几何匹配等条件下非共价键力的作用。(1)弱相互作用力的类型一一主要指范德华力(包括静电力、诱导力、色散力)、氢键、堆砌作用力(包括元-元堆积、n-元堆积、阳离子-元作用和疏水作用力等)
的杂化类型及 AB2 分子的空间构型。 (2) A-B 键的极性如何?AB2 分子的极性如何? (3) AB2 分子间存在哪些作用力? (5) AB2 与 H2O 相比,何者的熔点、沸点较高? 解 (1) 根据 A、B 的电负性值,可判断 A 元素为 O,B 元素为 F,该分子 为 OF2 。根据键角 103.3º,知道该分子中 O 原子以不等性 sp3 杂化轨道与 F 原子 成键,两个单电子 sp3 杂化轨道各与 1 个 F 原子的单电子 2px 轨道重叠形成 sp3 -p 的 σ 键,余下的 2 个 sp3 杂化轨道各被 1 对孤对电子占据,对成键电子对产生较 大的排斥,致使键角压缩(<109º28’),故 OF2 分子的空间构型为“V”形。 (2) O—F 键为极性共价键。OF2 分子中键的极性不能抵消,为极性分子。 (3) OF2 分子间存在取向力、诱导力及色散力,其中色散力是主要的。 (4) OF2 分子中无 H 原子,分子间不能形成氢键,而 H2O 分子间能形成氢键, 故 OF2 的熔点、沸点比 H2O 的低。 相关知识介绍 酶超分子结构化学——软化学键 超分子化学已成为化学、生命科学、材料科学和信息科学等领域研究的热点 和纽带。超分子化学至少有两点启示:一是分子间弱相互作用力在一定条件下可 转化为强结合能;二是分子组装成的超分子体系可具有完全不同于原组成成分的 全新性能。在众多化学和生物超分子体系中,酶超分子是最理想的模型超分子。 不同结构类型的酶聚集体在动力学特征和生物学功能上很不相同。随着酶结 构复杂程度的提升,相应新的性能不断突现。酶超分子体系与单体酶比较,功能 上有如下优越性:反应方向和速率的高调节效率;体系化特征(一个信号可多方 向传递等);反馈调控机制;多样性功能;高层次的识别反应等。对酶超分子体 系的这些神奇功能的解释,依赖于对“软化学键”的认识。 酶超分子系统所具有的独特有序结构和新的宏观特性正是以其组分分子间 非共价键弱相互作用力——软化学键为基础的。有别于分子和配合物,超分子是 主体和客体在满足能量匹配、几何匹配等条件下非共价键力的作用。 (1)弱相互作用力的类型——主要指范德华力(包括静电力、诱导力、色散力)、 氢键、堆砌作用力(包括 π-π 堆积、n-π 堆积、阳离子-π 作用和疏水作用力等)