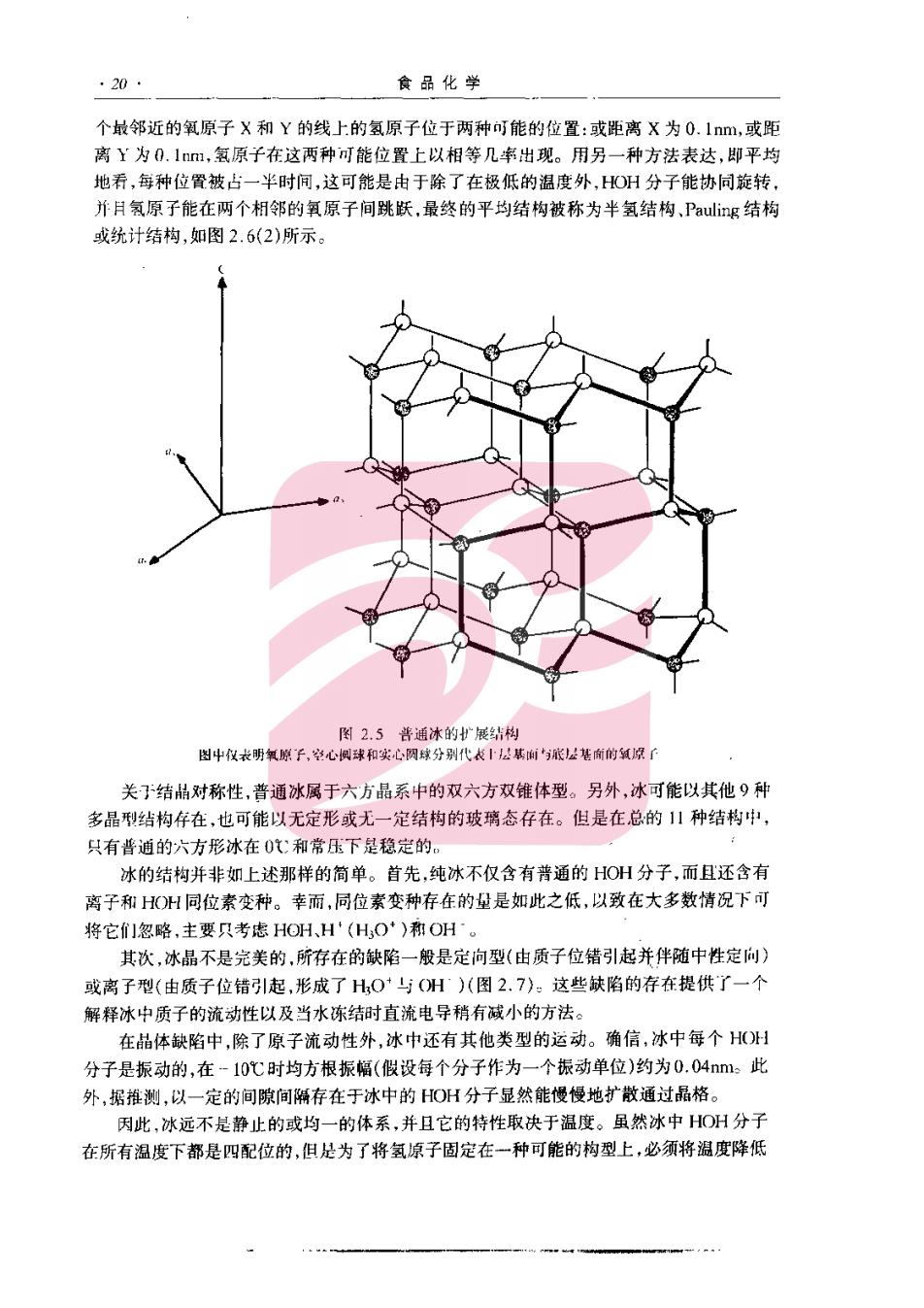
20 食品化学 个城邻近的氧原子X和Y的线上的氢原子位于两种可能的位置:或距离X为0.ln,或距 离Y为0.11,氢原子在这两种可能位置上以相等几率出现。用另一种方法表达,即平均 地看,每种位置被占一半时间,这可能是由于除了在极低的温度外,HO州分子能协同旋转, 并月氢原子能在两个相邻的氧原子间跳跃,最终的平均结构被称为半氢结构,Pauling结构 或纺计结构,如图2.6(2)所示。 图2.5普通冰的展结构 图中仪表明氧原子,学心枫球和实心阴球分别代长松基与底2基商馆氧深了 关于结品对称性,普通冰属于六方品系中的双六方双锥体型。另外,冰可能以其他9种 多品结构年在,也可能以无定形或无一定结构的玻璃态存在。但是在总的种结构中 只有普逍的六方形冰在0此和常压下是稳定的。 冰的结构并非如上述那样的简单。首先,纯冰不仅含有带通的HO州分子,而且还含有 离子和H州同位素变种。幸而,同位素变种存在的量是如此之低,以致在大多数情况下可 将它们忽略,主要只考虑HOH,H(H,O)和OH。 其次,冰晶不是完美的,所存在的缺陷一般是定向型(由质子位错引起并伴随中性定向) 或离子型(由质子位错引起,形成了H,0与(州)(图2.7)。这些缺陷的存在提供了一个 解释冰中质子的流动性以及当水冻结时直流电导稍有减小的方法。 在品体缺陷中,除了原子流动性外,冰中还有其他类型的运动。确信,冰中每个H( 分子是振动的,在-10℃时均方根振幅(假设每个分子作为一个振动单位)约为0.04m。此 外,据推测,以一定的间隙间隔存在于冰中的HO州分子显然能慢慢地扩散通过晶格。 因此,冰远不是静止的或均一的体系,并且它的特性取决于温度。虽然冰中HOH分子 在所有温度下都是四配位的,但是为了将氢原子固定在一种可能的构型上,必须将温度降低

2水和冰 至约-180代或更低。内此,仅在温度近-I80℃或更低时,所有的氢键才是完整的,随者温 度升高,完整的(固定的)氢键平均数将逐渐地减少。 H.0 从洗跃至? 2 图27冰中质块陷的示图 实载和速线分别代表化学锥和氢肆 2.5.2溶质存在时的冰 溶质的含量和种类能影响冰晶数量,大小结构、位置和定向,这里仅考虑溶质对冰结构 的形响。Ly和他的洞事5,刊研究了在各种溶质(包括流.甘油、明胶、白蛋白和肌球蛋 白等)存在情况下形成的冰晶性质。他!根据形态学对称元素以及产生各种类型冰结构所 需的冷却速率设计了一个分类方法。由他们所确定的4种主要类型的冰结构是六方形品 体,不规则的树枝状晶体,粗的球晶和瞬息球晶。 只要能避免极端快速的冷冻,仅含一类溶质以及它的浓度不会过分地妨碍水分千的渝 动性,那么,六方形晶型是存在于食品中最有次序的结品形式。 2.6水的结构 当流动性是液体状态的本质时,讨论一种液体的结构对丁某些人来说似乎感到奇怪, 液体水具有结构,显然它不足以产生长距离范图的喇性,但是肯定比蒸汽态分子的排列有规 则得多,因此,某个水分子的定向与流动性显著地受到与它相邻分子的影响,这是-一个被大 家所熟悉而又能被接受的概念% 支持上述观点的证据是令人信服的。例如,水是一种“散开“的液体,它的密度仅相当于 根据紧密堆积推算的60%,此种紧密堆积在非结构液体中是普遍存在的。水部分地保留了

·2 食品化学 冰的散开,氢键和四面体排列,根据这一点就易于解释水的低密度。虽然冰的熔化热是异常 地高,但是只能打断冰中约15%的氢键。尽管不一一定需要原存在于冰中的氢键的85%保 留在水中(例如,更多的氢键可能断裂,而同时增加的范德华相互作用可能掩盖了能量的变 化),然而许多研究结果仍然支持确实存在着众多水一水氯键的见解。 阑明纯水的结构是非常复杂的问题。已经提出了许多理论,然面它们都不完全和过于 简单,它们的弱点很快地被竞争性理论的支持者所引用。当然,这是一种健康的学术状况 它将最终地形成对水结构的正确描述。在此期间,几乎没有陈述能保证在它]被提出之后 的数年之内不被修改。因此,本节仪简略地论述这个题目。 已经提出3个一般模型:混合,间隙和连续模型(也被称为均一模型):。混合模型的 主要概念如下:分子间氢键服时地放生在庞大成簇的水分子申,后者与其他更閤密的水分千 处在动态平衡平均瞬间一10" 连续模型包含如下的概念:分子间氧键均)地分布在整个试样中,原存在于冰中的许 多键在冰熔化时简单地粗曲而不是裂。此模型认为存在着一个由水分子构成的连续网 当然具有动态本质m,10)。 间隙模型涉及如下的概念:水保留一种似冰或笼形物结构,而个别水分子填允在笼形 物的间隙中。在所有的3种模型中,占优势的结构特证是液体水分子以短暂,扭曲的网面体 形方式形成氢键缔合。所有的模型也容许各个水分子颜繁地改变它们的排列,即1个氢键 快速地终止面代之以】个新的氢健,而在温度不变的条件下,整个体系维持一定的氢键键合 和结构的程度。 水分子中分子间氢健键合的程度当然取决于温度。冰在t时具有4的配位数(最接 近的水分子的数目).与最接近的水分子距离为0.276m。当输入熔化潜热时冰熔化,即 些氢键断裂(最接近的水分子间的距离增加),而其他氯键变形,水分子是缔合的流体状态 总体上它们更加紧密。随着温度提高,配位数从0℃冰时的4.0增加至1.5水时的4.4 时,随后83℃水时的4.9。同时,最接近的水分子间的距离从0t冰时的0.276m增加至 【.5水时的0.29m,随后83t水时的0.305nm7. 显然,冰向水转变伴随着最接近的水分子间的距离的增加(密度下降)和最接近的水分 子的平均数目的增加(密度增加),当后一个因素占优势时就导致大家所熟悉的净密度增加」 当进-步加热使温度超过熔点时,水的密度在3.98℃达到最大后逐渐下降。显然,配位数 增加的效应在0心和3,98℃之间是占优势的,而最接近的水分子间的距离增加的效应(热膨 胀)在湿度超过了3.98后占优势。 水的低黏度特点与前已描述的它的结构类型相一致,这是因为水分子的氢键键合排列 是高度动态的,允许各个水分子在毫微秒至微微秒的时间间隔内改变它们与邻近水分子间 的氧健键合关系,于是增加了水的流动性。 2.7水-溶质相互作用 2.7.1宏观水平(水结合、水合和持水力) 在分子水平上论述水-溶质相互作用之前,先讨论被称为水结合(water binding)、水合

2水和冰 23 (hydration)和持水力(water holding)等与水相关的现象是恰当的 就食品而:,常采用术语“水结合”和“水合”表示水与亲水物质缔合的一般倾向,亲水物 质包括细胞物质。当按此方式使用这些术语时,它适合于宏观水平。虽然有一些更为专 门化的术语是按定量方式被定义的,如“水结合位”(water binding potential),但是它们仍然 仅适用于宏观水平。水结合或水合的程度和强度取决于包括非水组分的本质,盐组成、H 和温度等很多因素 术语“持水力“常被用来描述由分子(通常由低浓度的大分子)所构成的基质物理截留大 量水以防止渗出的能力。以此方式截留水而被大家所熟悉的食品包括果胶和淀粉凝胶以及 动物和植物组织细胞 被物理截留的水,甚至当组织状食品被切割或剁碎时仍然不会流出。另一方面,这部分 水在食品加工中的性质几乎与纯水相似:在干燥时它易被除去,在冷冻时易转变成冰,可以 作为溶剂。虽然这部分水的整体流动受到严格地限制,但是各个分子的运动基本上与在稀 盐溶液中的水分子相同。 在组织和凝胶中几平所有的水可被归类为物理截留,食品截留能力(持水力)的损害对 食品质城产生重大的影响。凝胶脱水收缩,冷冻食品的解冻渗出以及因在宰后正常生理活 动中肌肉pH下降而造成的香肠中动物组织的不良特性都是因持水力损害而引起的质量缺 陷的实例 在别的章节中将详细地讨论凝胶结构和持水力 2.7.2分子水平:-殷概念 溶质和水的混合同时改变了这两种成分的性质。亲水溶质造成邻近水分子的结构和流 动性的变化:水造成亲水溶质的反应性和有时结构的变化。加人溶质的疏水基团仅与邻近 水微盼地相互作用,它们优先地选择一个非水环境。 水与各类溶质之间的结合力具有重要的意义,它们被总结任表2.3中。 表2.3 水一溶质相互作用的分类 类型 实 例 与水一水键“比的相作用 极-离子 水·游离离了 较人心 水一有机分千上的带电基团 倒极-偶极 水-蛋白质H 近乎相等 水-量白质( 水一影链(0H 水水分 水+R*R(水合的) 较小4△:>0】 我水相生作用 R(水合的)+水合的)R(水介的)+) 不时比(>琉水相红作用:△G<0) 法:①约2 ④水相作州动的。线一离f和级偶极相互作用格的

食品化学 2.7.3分子水平:结合水 结合水不是一种均一的和易于识别的实体,解释这个术诗是困难的,已经提出了许多定 义.还没有就哪一个定义是最好取得一致的意见.这个术语是相互矛盾的,常是混淆的,而 且一般来说是不易理解的,因此,愈来愈多的科学家建议停止使用这个术语。虽然这个建议 是吸引人的,们术语“结合水”在文献中是划此地被普遍使用,因此必须讨论它。从下而已提 出的“结合水”的许多定义也可以说明为什么这个术语户生:了混淆3,5: (1)结合水是样品在一定的温度和低相对湿度下的平衡水分含量 (2)结合水对高频电场下的介电常数没有显著的影响,因而它的转动受到了与它结合 的物质的限制 (3)结合水在某一指定的低温(通常为-40心或史低)下不会冻结。 (4)结合水不能作为所加入溶质的溶剂。 (5)结合水在质子核磁共振(NMR)试验屮使谱线变宽 (6)在沉降速度,黏度与扩散实验中,结合水与大分子一起运动。 ()结合水存在于溶质及其他非水物质的邻近处,它的性质显著地不同于同一体系中 “体相”水的性质。 所有这些定义都是有根据的,但是根据这些定义对同一样品进行分析所得到的值几乎 都不相同 从一个理论观点来看,有必要将结合水君作为存在于溶质和其他非水组分邻近处的水 并呈现与同一体系中的“体相水”显不同的性质。与体和相水比较,应该认为结合水具有“被 阴碍的流动性”而不是“被固定的”。在一个典型的高水分含量的食品中,这类水仅包括总水 分中的.个微小部分,大致相当于邻近亲水基团的第一层水分子。在论述冷冻体系中分子 流动性(M)的章节中将进一步讨论结合水(被阻碍的水)这一勉目。 下面将讨论水与各类溶质之间的相互作用。 2.7.4水与离子和离子基团的相互作用 离了和有机分子的离子基团比任何其他类型的溶质在史大程度上阻碍水分子的流动 性。水离子键的强度大于水一水氢键的强度,但是远小于共价键的强度。加入可以离解 的溶质会打破纯水的正常结构(基于气键的四面体排列)。水和简单的无机离子产生偶极 离子相互.作用。图2.8所示的例子包括N(1离子对的水合。图中仅描述了纸平面上的第 一层水分子。在一个稀离子水溶液中,由于第一层水分子和处在更远的以四面体方式定向 的“体相”水所产生的相万矛盾的结构的影响,因此,可以认为第二层水是以结构被扰乱的状 态存在。在浓盐溶液中,或许不存在体相水,而离子或许支配着水的结构。 大量证据表明些离子在稀水溶液中具有净结构破坏效应(溶液比纯水具有较高的流 动性),而另一些离子具有净结构形成效应(溶液比纯水其行较低的流动性)。应将术语“纯 结构“理解为它涉及所有种类的结构,包括正常的或新类型的水结构。从“正常"的水结构规 点来看,所有离子都是破坏性的。 一种指定的离子改变净结构的能力紧密地关系到它的极化力(电街除以半径)或简单地 它的电场强度。小和/或多价离子(大多数阳离子,如Li',Na,HO,Ca2,Ba2·,Mg2