
2水和冰 A·.F和OH)具有强电场,是净结构形成者这些离子形成的结构超过了对正常水结 构的任何损失的补偿。这些离子强烈地 6个第·层水分子相互作用,导致它们比纯水 (o● 中的H○州具有较低的流动性和包装得更紧 帝。大和单价离子(大多数阴离子和大阳离子 如K,Rb+.s,NH,C,Br·,I-,N) BrO,和C)具有類弱的电场,是净纷 构打破者,尽管对于K'来说此效应是很微弱 的。这些离子打破水的正常结构,并且新的结 构义不足以补偿这种结构上的损失, ● (0◆ 当然,离子的效应远超过它们对水结构的 图2.8邻近N(1的水分子的可能择列方式 影响。离子具有不同的水合(争夺水),改变水 图中仅城示摄平面中的水分了 结构、影响水介质的介电常数以及决定胶体周围双电层的厚度等能力,因而显著地影响了具 他非水溶质和悬浮在介质中的物质的“相容程度”。于是,蛋白质的构象与胶体的稳定性(与 Hofmeister或感胶离子序相一致的盐溶和盐析)也大大地受到共存的离子的种类和数量的 }影向11s.64. 2.7.5水与具有形成氢键能力的中性基团亲水溶质)的相互作用 水与非离子、亲水溶质的相互作用弱于水一离子相互作用,而与水一水氢键相互作用的 强度大致相同。取决于水一溶质氢健的强度,第一层水与体相水相比,显示或不显示较低的 流动性和其他不同的性质。 人们或许可以预料能形成氢键的溶质会促进或至少不会打破纯水的正常结构。然而 在某些情况下,已发现溶质氢键部位的分布和定向在几何上与在正常水中所存在的是不相 容的。于是,这些类型的溶质对水的正常结构往往具有一种破坏作用。尿素可作为一个具 有形成键能力的小分子溶质的很好例子,血于儿何上的原因,它对水的正常结构其显著 的破坏作用。 应当指出,加人一种能破坏水的正常结构的具有形成氢键能力的溶质,并不显著地改变 每摩尔溶液中氧键的总数,这可能是由于遭破坏的水一水氢键被水一溶质氢键所替代的缘 故。因此,这些溶质对上节所定义的净结构的影响是很小的。 水能与各种潜在的合适基团(如羟基,氨基,羰基,酰肢或亚氨基)形成氢键。有时形成 “水桥”,这是指1个水分子与1个或多个溶质分子的2个合适的氢键部位相互作用。水与 蛋白质中两类功能团形成氢键(虚线)如下所示: H 一NH0·H()-(C 结构3水与蛋白质中两类功能团形成氧键(虚线) 一个更详尽的例子涉及木瓜蛋白酶主链单元之间的三-HOH桥,如图2.9所示。 已经发现,在许多结晶大分子中的亲水基团彼此相隔一定℉离,这个距离与纯水中最相 邻近的氧的间隔相等。如果在水合的大分子中普遍存在这种间隔,有可能在第一层和第
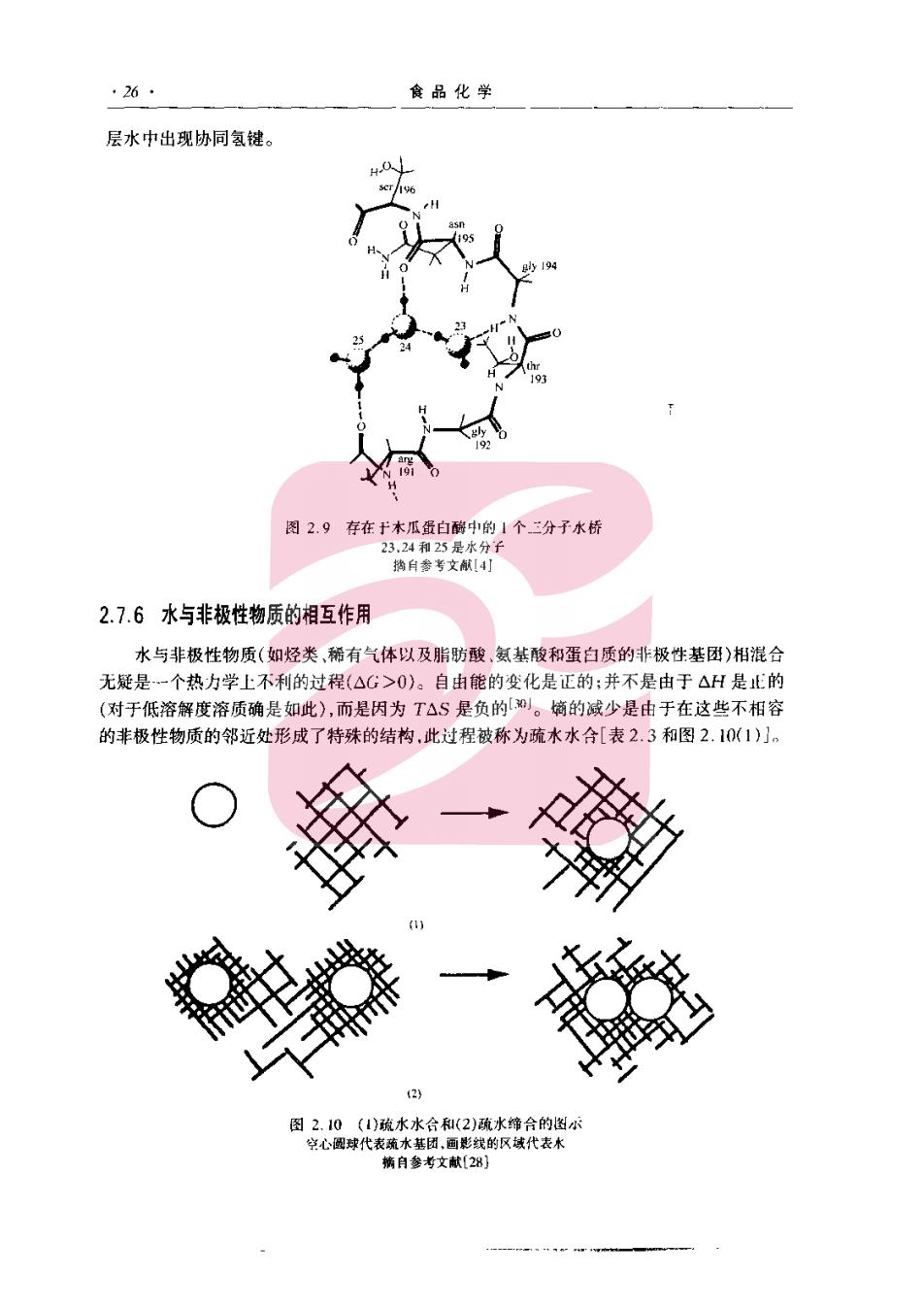
·26 食品化学 层水中出现协同氢键。 图2.9存在于木瓜蛋白中的1个二分子水桥 32H相25是分 热白参考文航14] 2.7.6水与非极性物质的相互作用 水与非极性物质(如烃类,稀有气体以及脂肪酸,氨基酸和蛋白质的非极性基团)相混合 无疑是一个热力学上不利的过程(△G>0)。自由能的变化是正的:并不是由于△H是止的 (对于低溶解度溶质确是如此),而是因为T△S是负的。墒的减少是由于在这些不相容 的非极性物质的邻近处形成了特殊的结构,此过程被称为疏水水合[表2.3和图2.10(1)]。 图2.10《》政水水合和(2)疏水幢合的图小 学心球代表疏水基团,面影线的诚代表木 月参考文献2

2水和冰 .271 由于疏水水合在热力学上是不利的,因此,可以理解水会倾向于尽可能地诚少与共存的 非极性物质缔合。于是,当两个分离的非极性基团存在时,不相容的水环境会促使它们缔 合,从而减小了水-非极性界面,这是一个热力学上有利的过程(△G<0)。此过程是疏水水 合的部分逆转,被称为“疏水相互作用”,并可用下式描述它的最简单形式: R(水合的)+R(水合的)→R(水合的)+2O 式中R是一个非极性基团[表2.3和图2.10(2)】 由于水和非极性基团具有相对抗的关系,因此,水调整自身的结构以便尽可能少地与非 极性基团接触。图2.11描述了确信存在于邻近非极性基团的水层中的这类水结构。水和 疏水基团间相对抗关系的两个方面是值得加以详尽地描述:笼状水合物的形成和水与蛋白 质分子中的疏水基团的缔合。 笼状水合物是冰状包合物,其中水 为“主体”物质,通过氢键形成了笼状结 构,后者物理截留了另一种被称为“客 体的非极性小分子。笼状水合物的意 义在于它们代表了水对非极性物质的最 ⑧ 大程度的结构形成响应,而且在生物物 质中天然地存在着相似类型的超微结 构,事实上,笼状水合物是结晶,它们易 于生长至可见大小,只要压力是足够地 ⊙ 高,一些笼状水合物在温度高于0℃时仍 然是稳定的。 ⊙ 笼状水合物的客体分子是低相对分 子质量化合物,它们的大小和形状适合于 由20一74个水分子构成的主体水笼子的 大小。典型的客体分子包括低相对分子 质量烃和卤代烃,稀有气体、短链第一、第 图2设水分子的定向 二和第三肢烷基俄、统和,盐。水和客 体之间的相互作用是轻微的,通常不超过弱范德华力。笼状水合物是水力图避免与疏水基团 接触而形成的特殊产物。 有证据表明,类似于结晶笼状水合物的结构可能天然地存在于生物物质中,如果正是如 此,由于这些结构可能影响知蛋白质这样的分子的构象,反应性和稳定性而比结晶水合物重 要得多。例如,有人认为在暴露的蛋白质的疏水基团存在着部分笼状结构。水的笼状结构 在像氙这样的惰性气体的麻醉作用中也可能有一定的作用。读者可从Davidson15j的综述 中了解更多的有关笼状物的信息。 水与蛋白质的疏水基团之间不可避免的缔合对于蛋白质功能性质具有重要的影 响,2x1。由于在典型的低聚食品蛋白质中约40%氨基酸侧链是非极性的,因此,这些不可 避免的接触的程度可能是相当大的。这些非极性基团包括丙氨酸的甲基、苯丙氨酸的苯基 缬氨酸的异丙基,半胱氨酸的统基甲基和亮氨酸的第二丁基和异丁基。其他化合物如醇、脂 肪酸和游离氨基酸的非极性基团也能参与疏水相互作用,但是这些相互作用的结果的重要

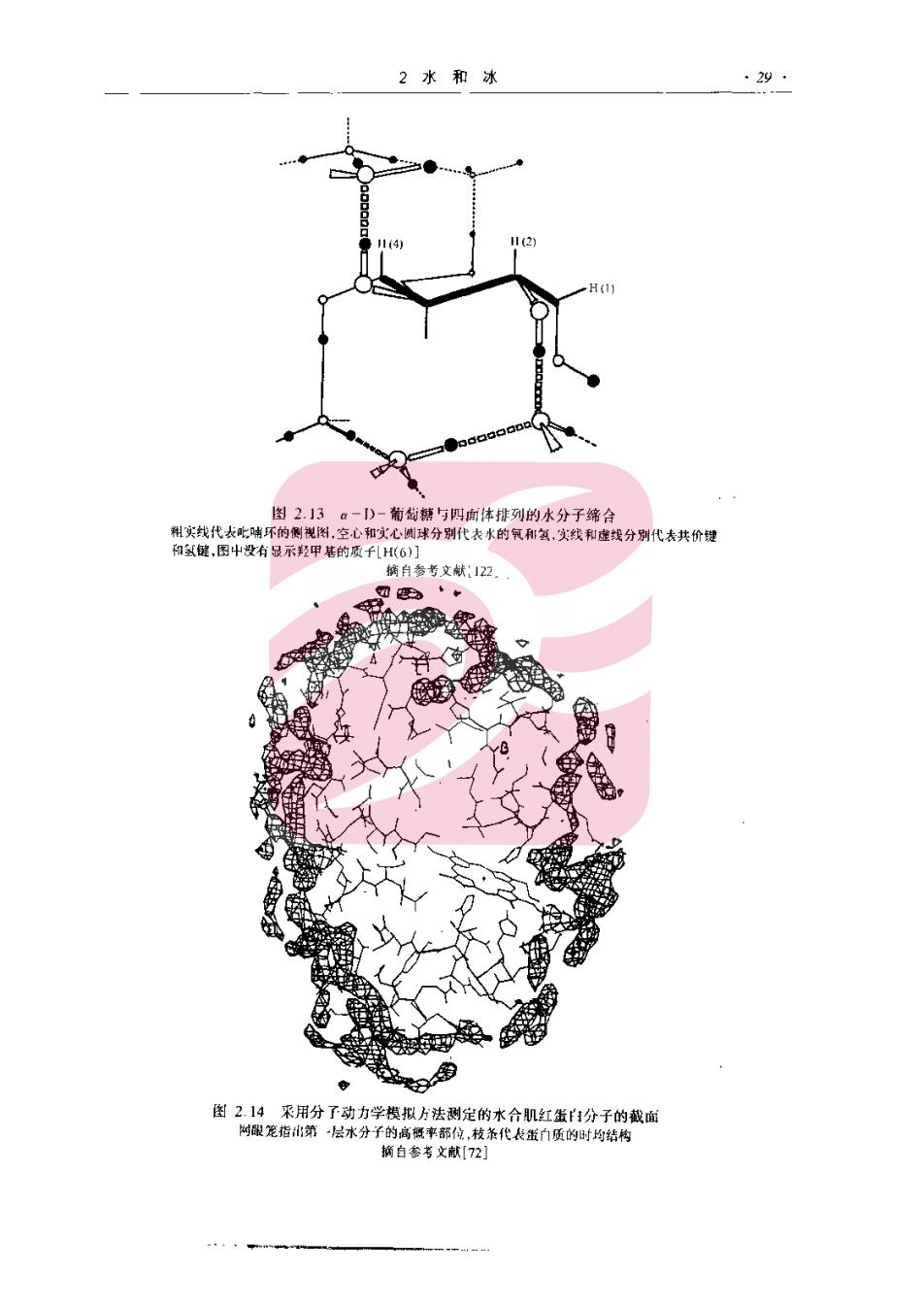
食品化学 性肯定不如涉及蛋白质的那些相互作用的结果的重要性 由于蛋白质的非极性基团暴露于水中在热力学上是不利的,因此,就会出现如图2:12 所示的疏水基团的缔合或“疏水相互作用”,疏水相互作用提供了使蛋白质折叠的一个重要 的驱动力,导致使许多疏水残基处在蛋白质分子的内部。尽管存在着疏水相互作用,然而球 状蛋白质中的非极性基团一般仍占据约40%一50%的表面积。疏水相互作用也被认为在 维持大多数蛋白质的-级结构中起者肯要的作用9,2四。因此,降低温度会导致疏水相 互作用变弱和氢键变强是相当重要的。 图2.12 一个经受疏水相4作用的球状蛋白质的图示 2.7.7邻近有机分子的水分子定向的细节 虽然确定邻近有机分子的水分子的排列在实验上是困难的,但是,这是一个活跃的研究 领域并已获得有用的数据。水合吡喃糖环如图2.13所示,而计算机模拟的水合肌球蛋白截 面如图2.14所示。假设水合部位之间的分隔距离为0.28m,并且这些部位都被占满,那 么,约360HOH分子存在于肌球蛋白的主水合壳1
2水和冰 29 参文献:122 摘自参考文航[72]