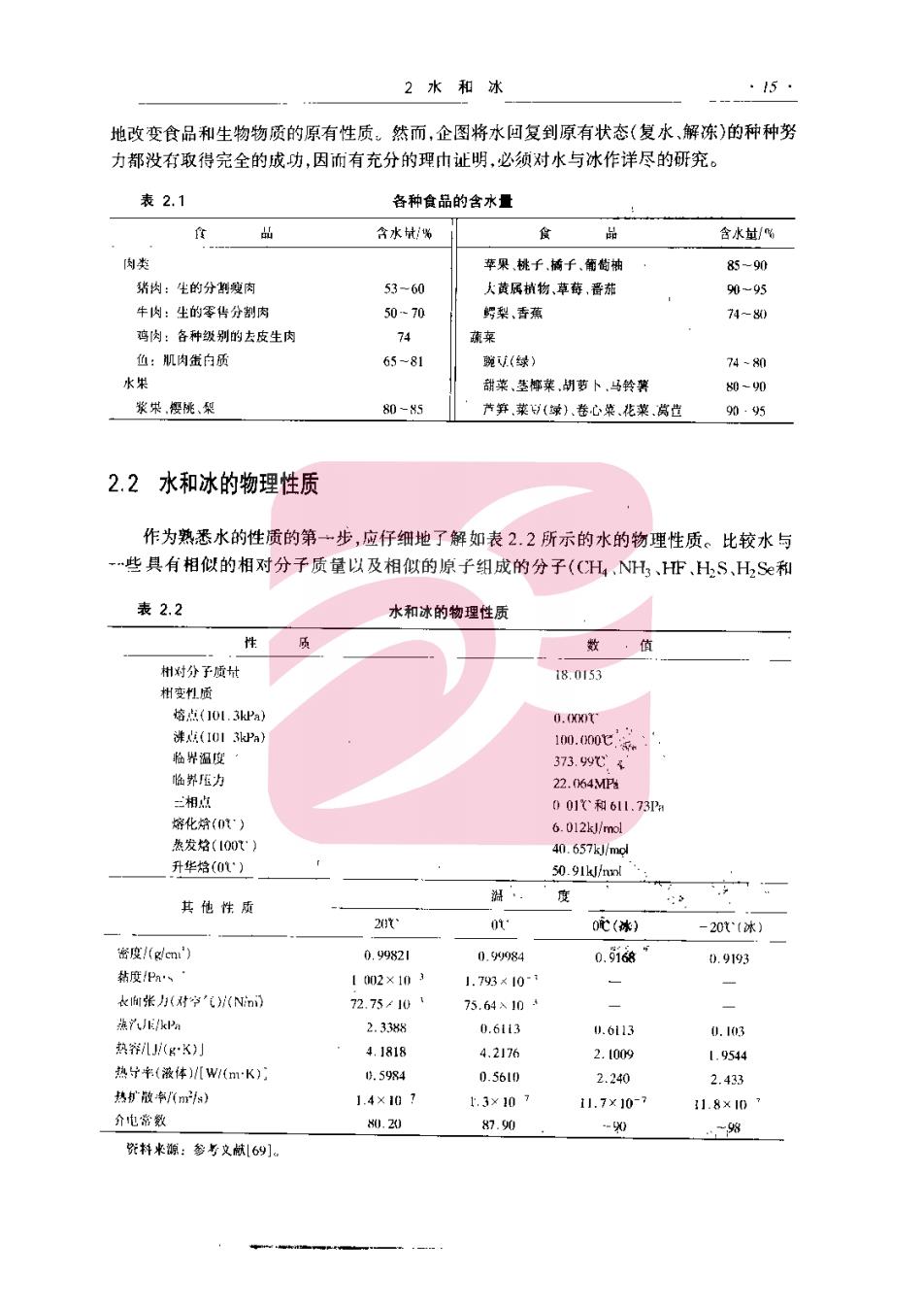
2水和冰 ·15. 地改变食品和生物物质的原有性质。然而,企图将水回复到原有状态(复水、解冻)的种种努 力都没有取得完全的城功,因而有充分的理h证明,必须对水与冰作详尽的研究。 表2.1 各种食品的含水量 食出 含水城% 含水敏/% 肉类 琴果桃千插千.而萄衲 85一90 猪肉:生的分售瘦肉 53-60 人蓝属梢物,意荷,器茄 90-95 牛肉:生的零华分割肉 50-70 鳄架、香燕 74-80 鸡肉:各种级别的去皮生肉 74 :机肉蚩白质 65-81 (续) 70 甜来是椰米,胡卜.马铃 0-0 80-85 节笋,莱(卷心来花菜赏位 90.95 2.2水和冰的物理性质 作为熟悉水的性质的第→步,应仔细地了解如表22所示的水的物理性质。比较水与 些具有相似的相对分子质量以及相似的原子细成的分子(CH,、NH、HFHS,HS和 表2.2 水和冰的物理性质 性质 数 削对分子质 18.0153 点10L.3 10.60c 临界压力 22. 一相内 001和61.73那 缩化01) 质发效(10t 升华络(01') 其他性质 度 2t· 0t(*) -20(*) 密度(cm) 0.9g82I 008a 0.9163 0.9193 枯度P%、 1002×103 1.793<10- k张归对学'气(Ni 72.75/10 75.6410 fpe 2.338 0.6113 h,611 0.103 热辩U(K) ,J816 4.2176 2.1009 1.9544 热(液体)[w(mK) 10.5984 0.5610 2.30 2.433 热扩放卓ms) 1.4×1h7 上.3×10 11.7×10 1.8x10 介电常数 0.20 8.90 ,一% 米:参与文69]

·16 食品化学 HT©)的性质之后,才有可能确定水是否具有正常的性质。通过比较后发现:水具有异常高 的熔点和沸点,水具有特别大的表面张力、介电常数,热容以及相变热(熔化热,蒸发热以及 升华热)值,水的密度相当小,水在凝固时具有异常的膨张性:与前述的水的异常性质相对照 的是它的黏度知是正常的 此外,与其他液体相比,水的热导率是大的:而与其他非金属固体相比,冰具有中等程度 的热导率。最有意义的实验事实是在0心时冰的热导率为同温下水的热导率的4倍,这意 味着冰传导热能比非流动水(例如,在组织中)快得多。水与冰的热扩散率具有更重要的老 义,这是因为这些数值指出了固态和液态的HOH经受温度改变的速度。冰的热扩散率比 水近乎大9倍,这表明在一定的环境中,冰经受温度变化的速率比水快得多。水与冰在热号 率和热扩散率上的显著差别为解释下述现象提供了一个允分的依据:当采用数值相等而方 向相反的温差时,冻结的速度远比解冻的速度来得快。 2.3水分子 从水的异常性质可以推测水分子间存在着强烈的吸引力以及水和冰具有不寻常的结 构。首先研究单个水分子的性质,然后再研究一小群水分子的性质才能最清楚地解释水的 这些特性。当两个氢原子接近氧的两个SP成键轨道就形成了两个共价σ键(具有40%的 离子特性),于是形成了水分子,其中每一个。键的解离能为4.6×10kJ/mol。定域分子轨 道绕着原有轨道轴保持对称定向,形成一个近似四面体的结构。水分子的轨道模型示意图 见图2.1(1),而它的范德华半径见图2.1(2)。 分离的水分子(蒸汽状态)的键角为104.5°,此值接近完美的四面体角109°28',0-H 核间的距离是0.096nm,氧和氢的范德华半径分别为0.14nm和0.12nm。 此刻有必要若重指出,目前所提供的图是过分地简化了。纯水不仅含有普通的H(归

2水和冰 7 分子,还含有许多其他的微量成分,除了普通的同位素60和H外,还存在”0、80,H(氘) 以及H(筑),产生HOH分子的18种同位素变种。水还含有离子质点如氢离子(以H()'形 式存在),羟基离子及它们的同位素变种。因此,水33种以.上的HO1化学变种组成.然 而这些变种仅以微不足道的量存在于白然界。 2.4水分子的缔合 KH分子的V字形式以及O一H键的极性导致电荷的不对称分布和蒸汽态纯水分子的 偶极矩为1.84。此极性程度使水分子间产生:引力,因而水分子以相当大的强度缔合。然而 水分子间异常大的引力并不能完全它的大偶极矩来解释,这是不足为奇的,因为偶极不能 反映电荷暴露的程度和分了的几何形状,当然这些方面与分子缔合强度有重娄的关系 水分子具有在三维空间内形成许多氢键的能力可充分地解释水分子间存在大的引力 与共价键(平均键能约355k/mdl)相比,氧键是弱键(一般为2~40kJ/nk),它有着较K而多 变的键长,氧一氢键的离解能约13~25k1ih0 由于静电力对氢键键能作出了主要的贡献(也许是最大的贡献),又由于水的静电模型 是简单的,而且当水以冰的形式存在时,导出个基本正确的H1的几何图形,因此,进 比论由水分子合形成的面 模武时将着重于静电作用 虽然 就目前的意图而,这种简化处理 的方法是完全满意的但是如果装 满意地解释水的其他特性,必须对 这个方法进行改良。 可以将水分子中电负性高的 氧设想为从两个其价结合的氢原 子部分地引取单个电子,这样使得 每个氢原子都带有部分正电前,而 H电子诉蔽达到虽小,也就是说 每个氯原子具有-些赤棵质子的 特性,由于氢一氧成链轨道定域 在想象的四面体的两根轴上[ 2.1(1)],这两根轴被认为是正作 用力(氢键给子休的部位)的表 线,在想象的四面体的另两根轴 上西出了氧的两个弧对由子勃首 这两根轴是负作用力(氢键接受体 部位)的表示线。根据这4条力 线,每个水分子至多能与4个其他 实球是氢原千子,莲代表氢键 的分了形成氢键,由此而形成的四面体排列如图2.2所示。 因为每个水分子具有数量相等的氢键给予体和氢键接受体的部位,并且这些部位的排

·18 食品化学 列可以形成三维氢键,因此,甚至与其他一些也形成氢键的小分子(如NH或H)相比,存 在于水分子间的吸引力仍然特别大。氨含有3个氢和】个接受体部位,氟化氢含有】个氢 和3个接受体部位。虽然它们都具有四面体排列,但是没有相等数敏的给予体和接受体部 位,因此只能形成二维氢键网,每分子氢键的数日比水少。 如果考虑同位素变种,水合氢离子和羟基离子时,可以想象到一些水分子的缔合是极其 复杂的。由于水合氢离子(结构1)带止电荷,因此,可以预料它比非离子化水具有更大的会 键给予能力:由于羟基离子(结构2)带负电荷,因此,可以预料它比非离子化水具有更大的 氢健接受能力。 H(0 R 结构1水合氢离子的结构和形成氯键的可能性。虚线代表氢键。 X H (0·H H 结构2羟基离子的结构和形成氢继的可能性。虚线代表氢键,而X代表溶质或水 分子 水具有形成二维健的能力,这为它的许多异常性质提供了·个合乎逻辑的解释。例 如,水具有高热容,高熔点,高沸点、高表面张力和高相变热,这些都与打破分子间氢键所需 额外的能量有关 水的介电常数也受氢键的影响。虽然水是偶极分了,似是单纯用偶极并不能解释水的 介电常数的大小。显然,水分子的成簇氯键产生了多分子偶极,它能显著地提高水的介电常 数。将在稍后的章节中讨论水的黏度。 2.5冰的结构 在讨论水的结构前将乳考虑冰的结构,这是因为对冰的结构的了解远远超过对水的结 构的了解,而且冰的结构代表了上节中所述资料合乎逻辑的延伸。 2.5.1纯冰 含有四面体指向作用力的水在结晶时形成开放(低密度)结构,后者已被精确地阑明。 冰中00核间最邻近的距离为0.276m。而0一00键角约为109,或者非常接近于完 美的四面体角10928'(图2.3)。仔细观察分子W和与它最邻近的1,2,3和W分子就可以 看清楚1个HH分子与其余4个水分子(配位数4)在1个品胞中缔合的方式。 当一些晶胞重叠起来,并从顶部沿着C轴观察时,冰的六角形的对称结构[如图2.4
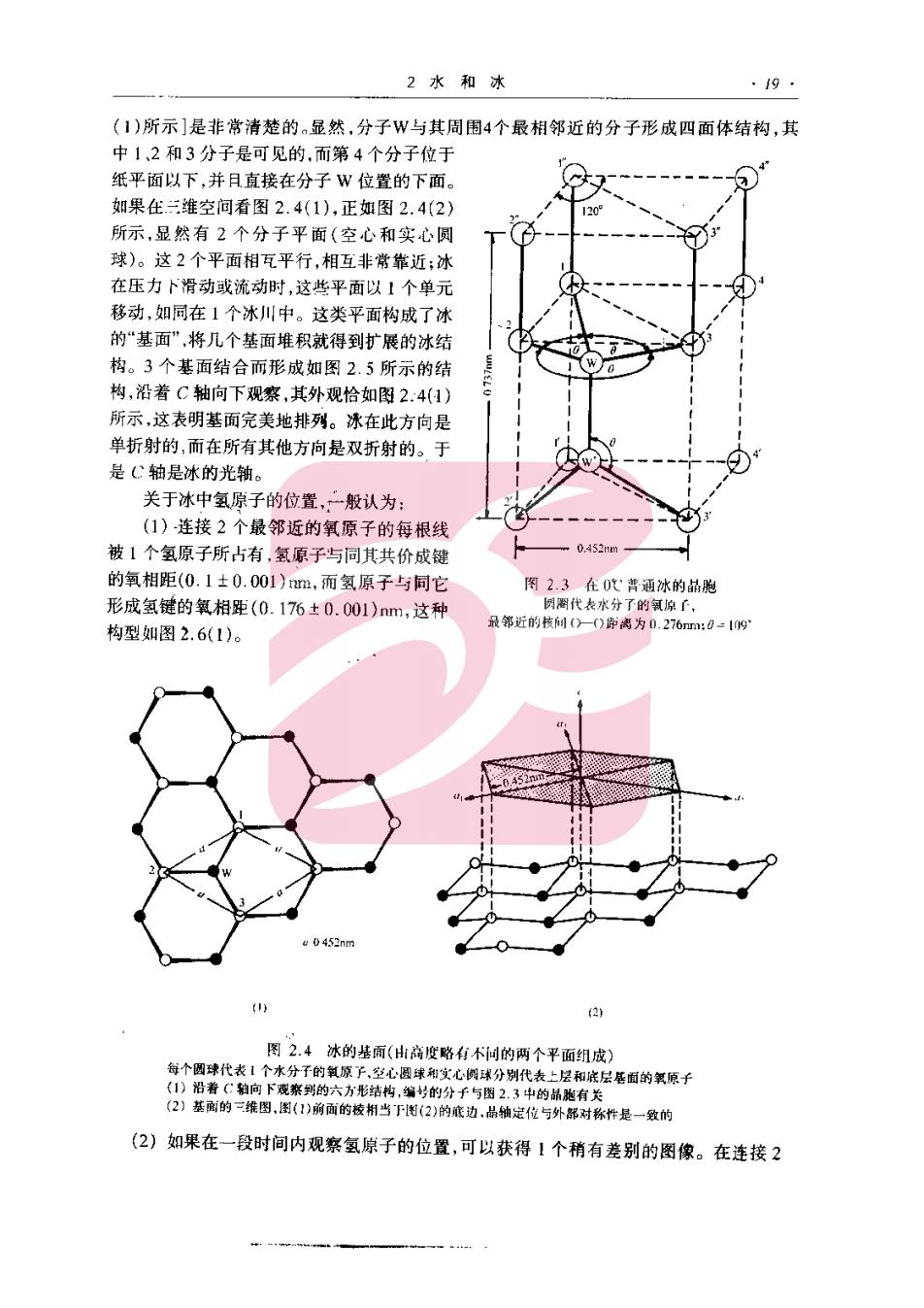
2水和冰 ·19 (1)所示]是非常清楚的。显然,分子W与其周围4个最相邻近的分子形成四面体结构,其 中1、2和3分于是可见的,而第4个分子位于 纸平面以下,并月直接在分子W位置的下面 如果在三潍空间看图2.4(1),正如图2.4(2 所示,显然有2个分子平面(空心和实心圆 球)。这2个平面相瓦平行,相互非常靠近:冰 在压力卜滑动或流动时,这些平面以1个单元 移动,如同在1个冰川中。这类平面构成了冰 的“基面”,将几个基面堆积就得到扩展的冰结 构。3个基面结合而形成如图2.5所示的结 构,沿C轴向下观察,其外观恰如图2.:4(1〉 所示,这表明基面完美地排列。泳在此方向是 单折射的,而在所有其他方向是双折射的。于 是C轴是冰的光轴。 关于冰中氢原子的位置,二般认为: (1)连接2个最邻近的氧原子的每根线 被1个氢原子所占有,氢原子与问其共价成键 0452 的氧相距(0.1±0.001),而氢原子与同它 形成氢键的氧相理(0.176±0.001)nm,这种 录邻近的核间0一O即离为0,276m:0=0g 构型如图2.6(1)。 0452rm 个两球代表1 图2.4冰的基面(山商度略有不问的两个平面组成) (2)如果在一段时间内观察氢原子的位置,可以获得1个稍有差别的图像。在连接2