
Kcat: 催化常数(酶的转化数) 每秒种每个酶分子转换底物的微摩尔数 Kcat/Km: 专一性常数 Km, Kcat, and kcat /Km
Kcat: 催化常数(酶的转化数) 每秒种每个酶分子转换底物的微摩尔数 Kcat/Km: 专一性常数 Km, Kcat, and kcat /Km

米氏方程的意义 ◼ 米氏常数为反应速度是最大反应速度一半时的 底物浓度,Km单位为摩尔浓度(mol/L) ◼ Km对于特定的反应条件而言是一个特征常数。 它只与酶的性质有关而与酶的浓度无关,不同 的酶,具有不同的Km值。 ◼ Km值作为常数只是对固定的底物、一定的温度、 一定的pH等条件而言的。 ◼ Km值可以反映酶同底物的亲和力
米氏方程的意义 ◼ 米氏常数为反应速度是最大反应速度一半时的 底物浓度,Km单位为摩尔浓度(mol/L) ◼ Km对于特定的反应条件而言是一个特征常数。 它只与酶的性质有关而与酶的浓度无关,不同 的酶,具有不同的Km值。 ◼ Km值作为常数只是对固定的底物、一定的温度、 一定的pH等条件而言的。 ◼ Km值可以反映酶同底物的亲和力

Km在实际应用中的作用 ◼ 鉴定酶 ◼ 判断酶的最适底物 ◼ 计算一定反应速度下的底物浓度 ◼ 了解酶的底物在体内具有的浓度水平 ◼ 判断反应方向或趋势 ◼ 判断抑制类型 是否复合MM方程 Note part2-10
Km在实际应用中的作用 ◼ 鉴定酶 ◼ 判断酶的最适底物 ◼ 计算一定反应速度下的底物浓度 ◼ 了解酶的底物在体内具有的浓度水平 ◼ 判断反应方向或趋势 ◼ 判断抑制类型 是否复合MM方程 Note part2-10

某酶促反应遵从Michaelis-Menten动力 学,酶的Km为2.4 × 10-4mol/L,当底物浓度 为0.05mol/L时,其反应速度为128mol毫升-1 分钟-1,若底物浓度为10-4mol/L后,其反应速 度为多少? 如果一酶促反应[S]=0.5Km,则V值等于 多少Vmax?
某酶促反应遵从Michaelis-Menten动力 学,酶的Km为2.4 × 10-4mol/L,当底物浓度 为0.05mol/L时,其反应速度为128mol毫升-1 分钟-1,若底物浓度为10-4mol/L后,其反应速 度为多少? 如果一酶促反应[S]=0.5Km,则V值等于 多少Vmax?
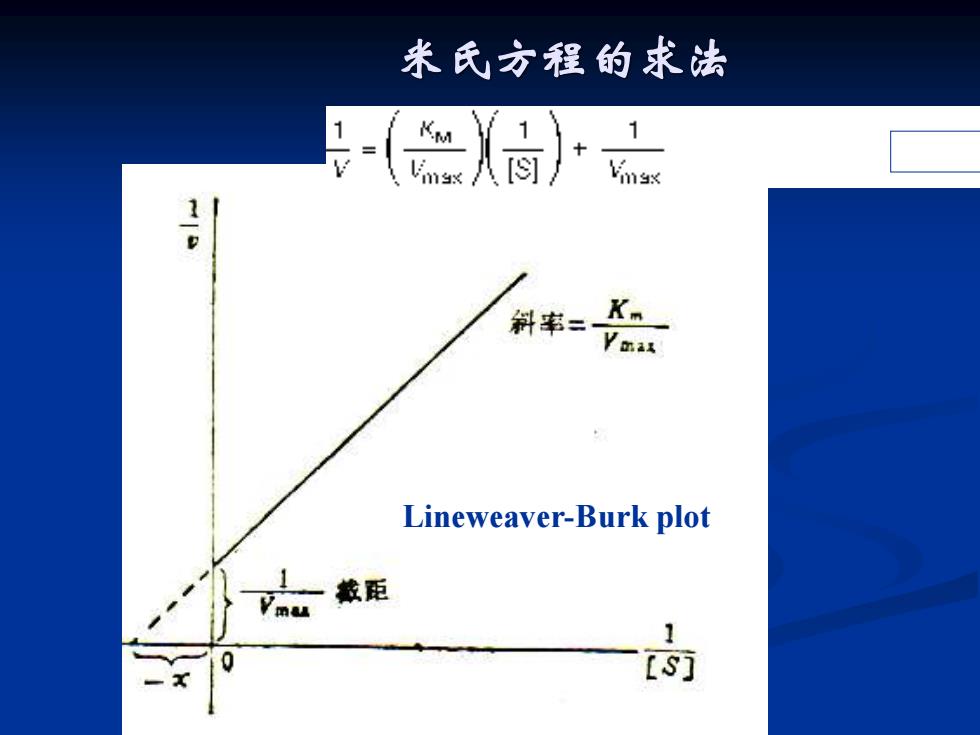
米氏方程的求法 Lineweaver-Burk plot
米氏方程的求法 Lineweaver-Burk plot