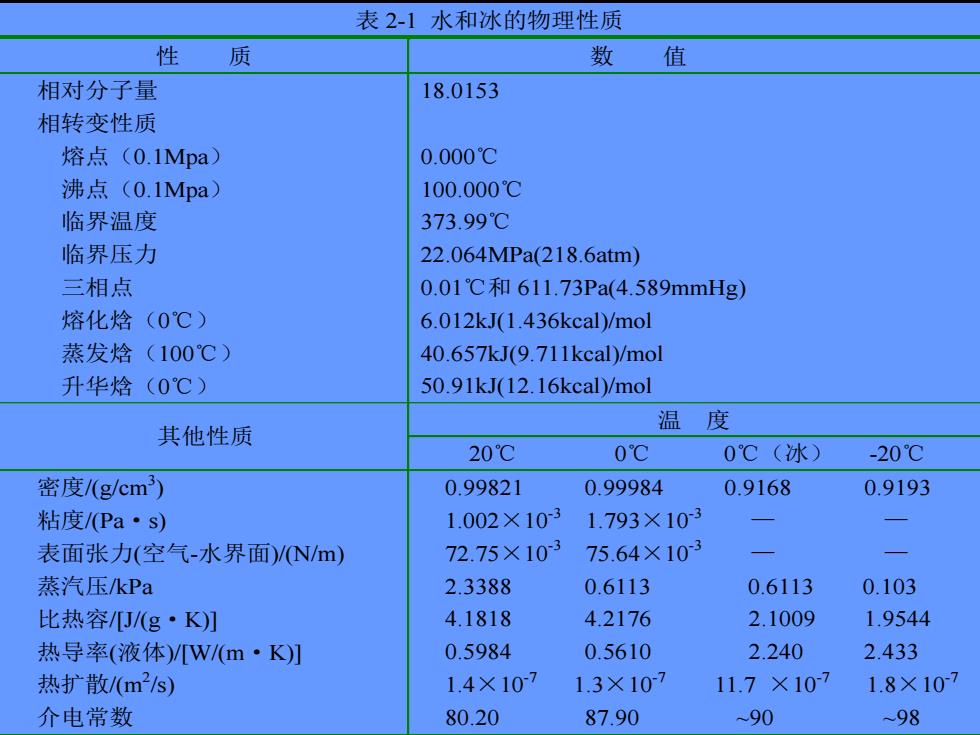
表 2-1 水和冰的物理性质 性 质 数 值 相对分子量 18.0153 相转变性质 熔点(0.1Mpa) 0.000℃ 沸点(0.1Mpa) 100.000℃ 临界温度 373.99℃ 临界压力 22.064MPa(218.6atm) 三相点 0.01℃和 611.73Pa(4.589mmHg) 熔化焓(0℃) 6.012kJ(1.436kcal)/mol 蒸发焓(100℃) 40.657kJ(9.711kcal)/mol 升华焓(0℃) 50.91kJ(12.16kcal)/mol 温 度 其他性质 20℃ 0℃ 0℃(冰) -20℃ 密度/(g/cm3 ) 0.99821 0.99984 0.9168 0.9193 粘度/(Pa·s) 1.002×10-3 1.793×10-3 — — 表面张力(空气-水界面)/(N/m) 72.75×10-3 75.64×10-3 — — 蒸汽压/kPa 2.3388 0.6113 0.6113 0.103 比热容/[J/(g·K)] 4.1818 4.2176 2.1009 1.9544 热导率(液体)/[W/(m·K)] 0.5984 0.5610 2.240 2.433 热扩散/(m2 /s) 1.4×10-7 1.3×10-7 11.7 ×10-7 1.8×10-7 介电常数 80.20 87.90 ~90 ~98
表 2-1 水和冰的物理性质 性 质 数 值 相对分子量 18.0153 相转变性质 熔点(0.1Mpa) 0.000℃ 沸点(0.1Mpa) 100.000℃ 临界温度 373.99℃ 临界压力 22.064MPa(218.6atm) 三相点 0.01℃和 611.73Pa(4.589mmHg) 熔化焓(0℃) 6.012kJ(1.436kcal)/mol 蒸发焓(100℃) 40.657kJ(9.711kcal)/mol 升华焓(0℃) 50.91kJ(12.16kcal)/mol 温 度 其他性质 20℃ 0℃ 0℃(冰) -20℃ 密度/(g/cm3 ) 0.99821 0.99984 0.9168 0.9193 粘度/(Pa·s) 1.002×10-3 1.793×10-3 — — 表面张力(空气-水界面)/(N/m) 72.75×10-3 75.64×10-3 — — 蒸汽压/kPa 2.3388 0.6113 0.6113 0.103 比热容/[J/(g·K)] 4.1818 4.2176 2.1009 1.9544 热导率(液体)/[W/(m·K)] 0.5984 0.5610 2.240 2.433 热扩散/(m2 /s) 1.4×10-7 1.3×10-7 11.7 ×10-7 1.8×10-7 介电常数 80.20 87.90 ~90 ~98
2.水和冰的结构 Structure of water and ice ➢水的异常性质可以推测水 分子间存在强烈的吸引力以 及水和冰具有不寻常结构
2.水和冰的结构 Structure of water and ice ➢水的异常性质可以推测水 分子间存在强烈的吸引力以 及水和冰具有不寻常结构
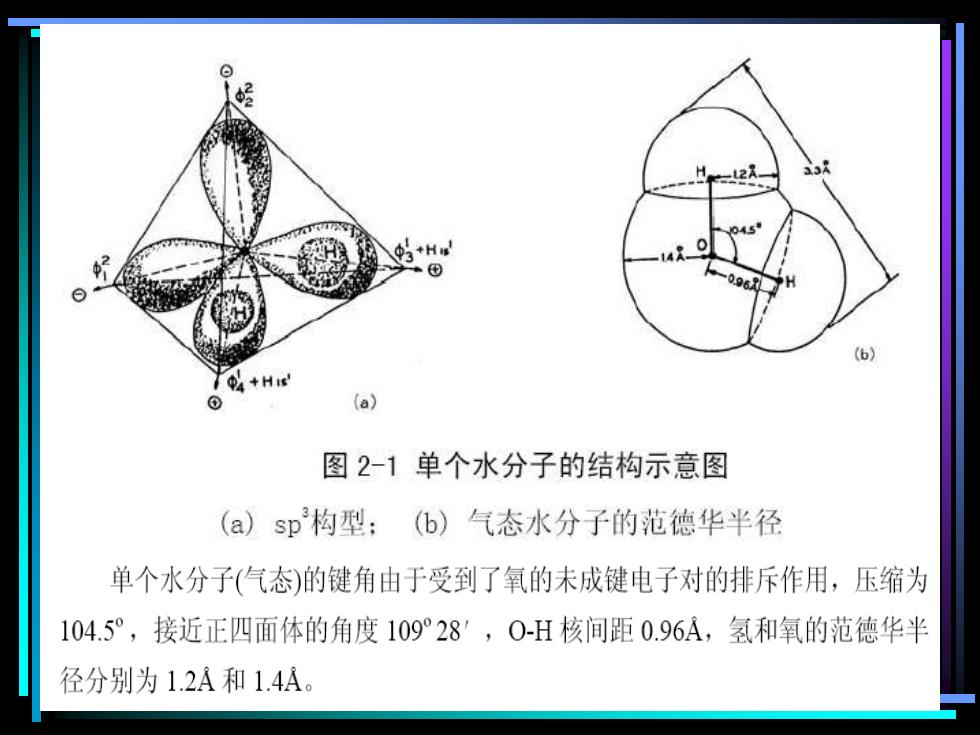
好 3+H 06 (6) 4+H (a) 图2-1单个水分子的结构示意图 (a)sp构型: (b)气态水分子的范德华半径 单个水分子(气态)的键角由于受到了氧的未成键电子对的排斥作用,压缩为 104.5°,接近正四面体的角度109°28′,0-H核间距0.96A,氢和氧的范德华半 径分别为1.2A和1.4A
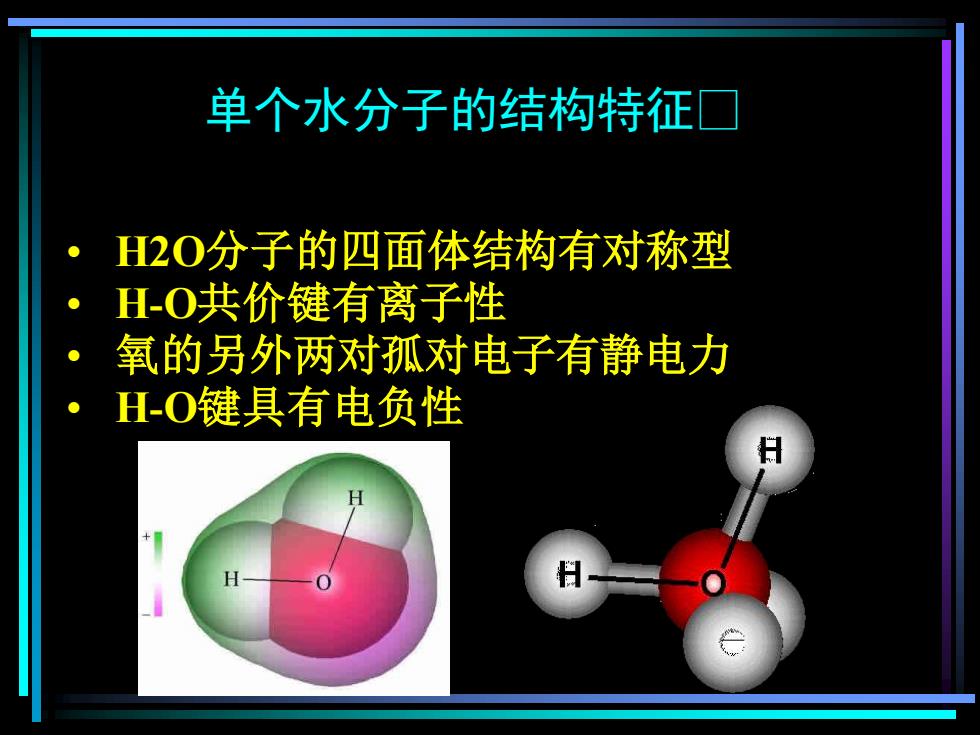
单个水分子的结构特征� • H2O分子的四面体结构有对称型 • H-O共价键有离子性 • 氧的另外两对孤对电子有静电力 • H-O键具有电负性
单个水分子的结构特征� • H2O分子的四面体结构有对称型 • H-O共价键有离子性 • 氧的另外两对孤对电子有静电力 • H-O键具有电负性
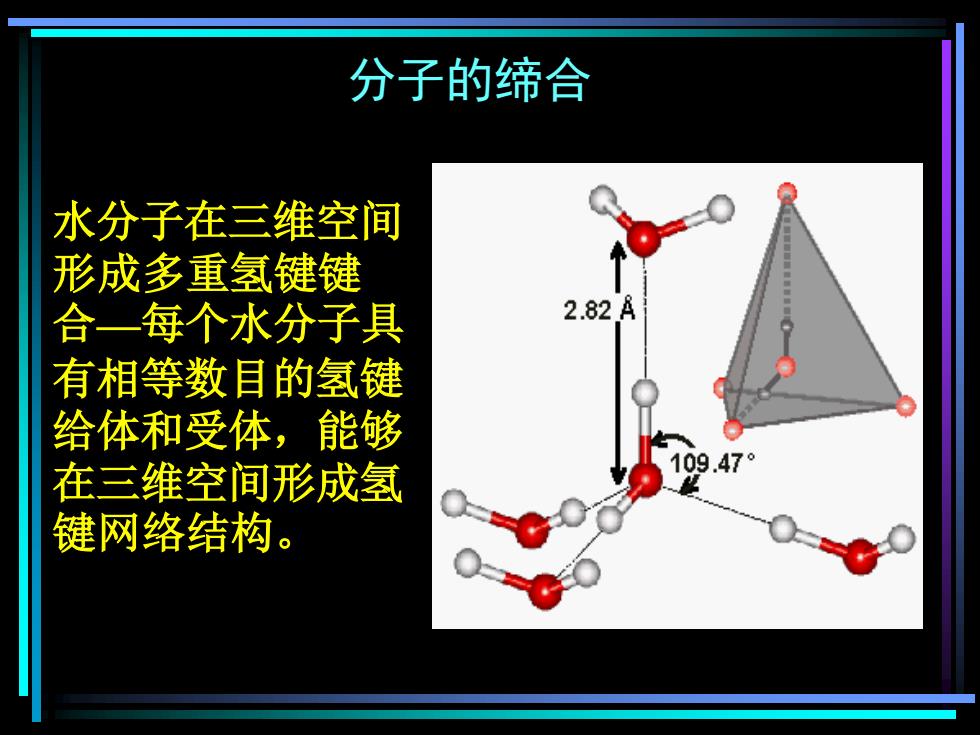
分子的缔合 水分子在三维空间 形成多重氢键键 合—每个水分子具 有相等数目的氢键 给体和受体,能够 在三维空间形成氢 键网络结构
分子的缔合 水分子在三维空间 形成多重氢键键 合—每个水分子具 有相等数目的氢键 给体和受体,能够 在三维空间形成氢 键网络结构