
2.接触电势差 电子逸出功(中)不同,逸出电子的数量不同 当两金属相间不再出现电子的净转移时,其间 建立了双电层,该双电层的电势差就是接触电势 差,用楼触表示。P接触∝中e,1中。,2 金属1 金属2 相间电势差(金属一金属接触电势)
+ + + + + + + + + + 金属1 金属2 相间电势差(金属⎯金属接触电势) 2.接触电势差 电子逸出功(φe)不同,逸出电子的数量不同 当两金属相间不再出现电子的净转移时,其间 建立了双电层,该双电层的电势差就是接触电势 差,用 接触表示。 接触 ∝φe,1-φe,2
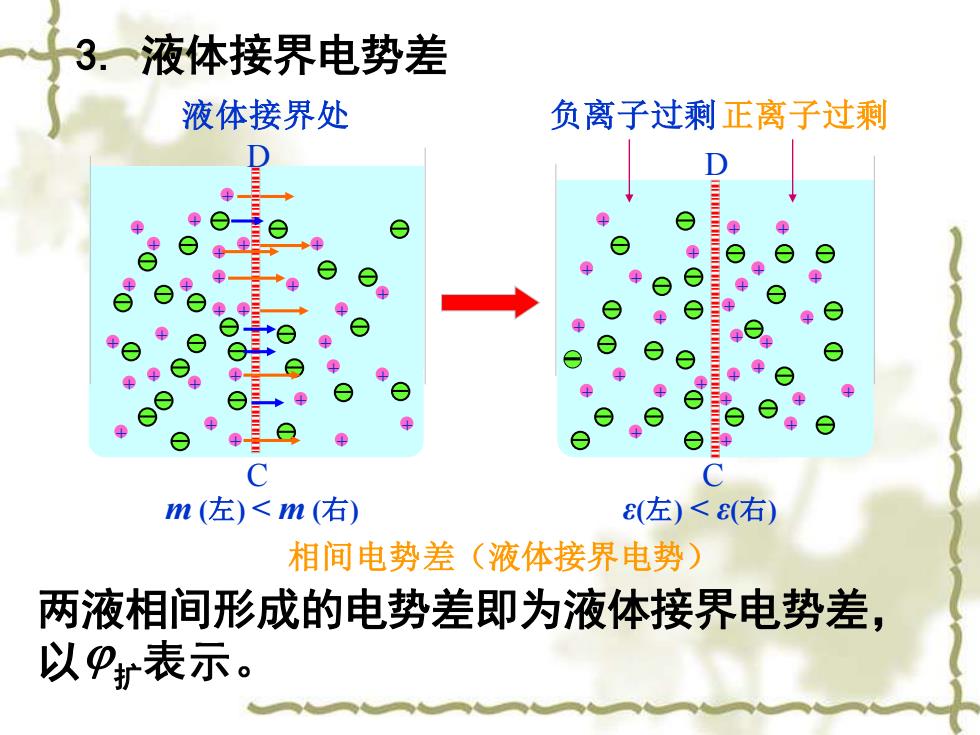
3.一液体接界电势差 液体接界处 负离子过剩正离子过剩 D e m(左)<m(右) (左)<(右) 相间电势差(液体接界电势) 两液相间形成的电势差即为液体接界电势差 以P扩表示
3. 液体接界电势差 相间电势差(液体接界电势) 液体接界处 负离子过剩正离子过剩 ε(左) < ε(右) + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + m (左) < m (右) C D D C + 两液相间形成的电势差即为液体接界电势差, 以 扩

4.电动势的产生 图2.2所表示的原电池符号为 )Cu I Zn(s)ZnSO2(a)CusO2(a2)Cu(s)(+ P接 9_ 甲扩 原电池的电动势E则为 E=P接+P,+P+P扩=E+E+P扩 式中E、E分别表示正、负两极的电势。 通过盐桥可消除液解电势,即P≈0,则: E=E.-E. 一 般要求E>0,若E<0,则认为原电池正、 负极设计反了
4. 电动势的产生 图2.2 -)Cu|Zn(s)|ZnSO2 (a1 )‖CuSO2 (a2 )|Cu(s)(+ 接 扩 原电池的电动势E E = 接 + + + 扩 = E+- E- + 扩 式中E+、 E- 分别表示正、负两极的电势。 − + + − 通过盐桥可消除液解电势,即 ,则: E = E+ - E- 一般要求E > 0,若E < 0,则认为原电池正、 负极设计反了。 扩 0

四、一源电池电动势的测定 1.可逆电池电动势的测定 补偿法→I≈O,因为E=IR+IR内,R内<<R, 所以,当I≈O时,IR内≈0,则E≈IR 。 E、=E。R x Ex:标准电池电动势 2.标准电池 韦斯顿标准电池,特点:在一定温度下电动势 稳定不变、且能精确测出;电动势随温度变化 小;可逆程度高、重现性好、易于制备
四、原电池电动势的测定 1.可逆电池电动势的测定 补偿法 → I≈0,因为E = IR + IR内,R内<<R, 所以,当I≈0时,IR内≈0,则 E ≈ IR 。 S X X S R R E = E EX:标准电池电动势 韦斯顿标准电池,特点:在一定温度下电动势 稳定不变、且能精确测出;电动势随温度变化 小;可逆程度高、重现性好、易于制备。 2. 标准电池

负极为镉汞齐(12.5%Cd),正极为Hg与Hg2S02 的糊状物,糊状物下面放有液汞作为导体。在 糊状物和Cd-Hg齐上面均放有CdSO28/3H,O的 晶体和CdSO2的饱和溶液。 -)Cd(12.5%Cd-Hg1CdS02·gH,0饱和溶液|HgS02S,Hg(1(d 负极 Cd(12.5%Cd-Hg齐)→Cd2++2e 正极 Hg2SO(s)+2e2Hg(1)+SO 电池反应 Cd(Cd-Hg齐)+Hg2SO4s) ====CdS04(s)+2Hg(1) 总反应 Cd(Cd-Hg)+Hg2SO(s)+HO ==CdS049H,0s)+2Hg()
负极为镉汞齐(12.5%Cd),正极为Hg与Hg2SO2 的糊状物,糊状物下面放有液汞作为导体。在 糊状物和Cd-Hg齐上面均放有CdSO2·8/3H2O的 晶体和CdSO2的饱和溶液。 -)Cd(12.5%Cd-Hg) | CdSO2· H2O饱和溶液|Hg2SO2 (s), Hg(1)(+ 8 3 负极 Cd(12.5%Cd-Hg齐) → Cd2+ + 2e- 正极 Hg2SO4 (s) + 2e- → 2Hg(1)+ SO4 = 电池反应 Cd(Cd-Hg齐)+Hg2SO4 (s) ==== CdSO4 (s)+2Hg(1) 总反应 Cd(Cd-Hg齐)+Hg2SO4 (s) + H2O ==== CdSO4 · H2O(s) + 2Hg(1) 8 3 8 3