
第三章 化学平衡热力学原理
第三章 化学平衡热力学原理

由△G的符号可判断过程的方向,△G是化 学反应体系中产物Gibbs自由能与作用物Gibbs自 由能之差,随着反应进行△G,趋向于零,反应 趋向平衡。当外界条件发生改变时,原平衡被破 坏,即发生平衡移动,直至达到新条件下的新平 衡。那么,平衡移动的方向?新平衡点(限度)? 与外界影响因素的关系?一本章要解决的问题
由△rGT,p的符号可判断过程的方向,△rGT,p是化 学反应体系中产物Gibbs自由能与作用物Gibbs自 由能之差,随着反应进行△rGT,p趋向于零,反应 趋向平衡。当外界条件发生改变时,原平衡被破 坏,即发生平衡移动,直至达到新条件下的新平 衡。那么,平衡移动的方向?新平衡点(限度)? 与外界影响因素的关系?——本章要解决的问题

§1.化学反应的等温方程式 一、化学反应等温方程式的导出 1.化学平衡的条件 T,卫 aA+dD-L-xX+yY 或0=2=∑yB 不作有效功的条件下,反应过程的任意瞬间: dGx,p=∑4edng=∑4B(yBd5) 得 =∑y4a=△,Gm和 T.p
§1. 化学反应的等温方程式 一、化学反应等温方程式的导出 1.化学平衡的条件 aA +d D ==== xX + yY 或 不作有效功的条件下,反应过程的任意瞬间: 0 ==== B B T, p T, p d d ( d ) GT , p = B nB = B B 得 B B r m , G G T p = = 和 = r Gm G T
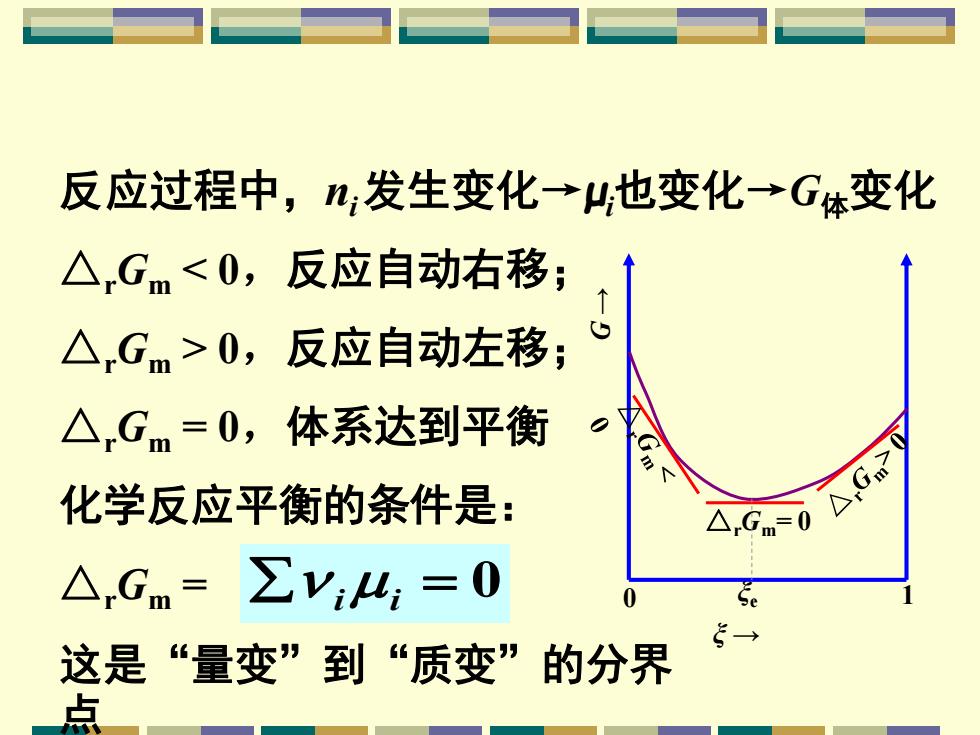
反应过程中,发生变化→H也变化→G体变化 △Gm<0,反应自动右移; △Gm>0,反应自动左移; △Gm=0,体系达到平衡 化学反应平衡的条件是: △,Gm △Gm=0 △,Gm=∑V4,=0 这是“量变”到“质变”的分界 点
反应过程中,ni 发生变化→μi也变化→G体变化 △rGm= 0 G → ξ → 0 ξe 1 △rGm < 0,反应自动右移; △rGm > 0,反应自动左移; △rGm = 0,体系达到平衡 化学反应平衡的条件是: △rGm = 这是“量变”到“质变”的分界 点 i i = 0

-∑y4=-△Gm也被定义为“化学亲和势” “化学亲和势”描述了物质间化学反应的趋势, 贝特洛原理(早期: 反应放热(△Hm<0)愈多, 如何解释? “亲和势”愈大。 实际情况: 有大量的吸热(△Hm>O) 反应存在
− i i = −r Gm 也被定义为“化学亲和势” “化学亲和势” 描述了物质间化学反应的趋势, 贝特洛原理(早期) : 反应放热(△rHm<0)愈多, “亲和势”愈大。 实际情况: 有大量的吸热(△rHm> 0) 反应存在 如何解释?