
第六章电化学 电化学是研究电能与化学能之间相互转化及其规律的科 学。 实现电能与化学能之间相互转化的装置是电解池和原电池,把 电能转变为化学能的装置称为电解池,而把化学能转变为电能 的装置则称为原电池。 本章的内容包括以下四个部分: 电解质溶液:导电及溶液中电解质的热力学性质 可逆电池热力学:在有非体积功的条件下化学反应的热力 学问题; 不可逆电极过程:非平衡条件下的电极过程: 电化学的应用
第六章 电化学 电化学是研究电能与化学能之间相互转化及其规律的科 学。 实现电能与化学能之间相互转化的装置是电解池和原电池,把 电能转变为化学能的装置称为电解池,而把化学能转变为电能 的装置则称为原电池。 本章的内容包括以下四个部分: 电解质溶液:导电及溶液中电解质的热力学性质 可逆电池热力学:在有非体积功的条件下化学反应的热力 学问题; 不可逆电极过程:非平衡条件下的电极过程; 电化学的应用

§6-1电解质溶液 电解质溶液是指溶质在溶剂剂中溶解后完全或部分离解成 离子的溶液,该溶质则称为电解质。在溶液中完全离解的电解 质,称为强电解质。在溶液中只有部分离解,即便在较稀的溶 液中都有未离解成离子的电解质,称为弱电解质。 1.电解质溶液的导电机理 导体分类: 第一类导体:如金属及其某些化和物,是由于电子在电场作 用下移动而传导电流,在导电过程中,导体本身不发生变化, 且温度升高,其导电能力下降。 第二类导体:如电解质溶液和熔融电解质,是由于正、负离 子在电场作用下定向移动而传导电流,第二类导体在传导电流 的同时在两极发生电极反应,且温度升高其导电能力增大
§6 -1 电解质溶液 电解质溶液是指溶质在溶剂剂中溶解后完全或部分离解成 离子的溶液,该溶质则称为电解质。在溶液中完全离解的电解 质,称为强电解质。在溶液中只有部分离解,即便在较稀的溶 液中都有未离解成离子的电解质,称为弱电解质。 1.电解质溶液的导电机理 导体分类: 第一类导体:如金属及其某些化和物,是由于电子在电场作 用下移动而传导电流,在导电过程中,导体本身不发生变化, 且温度升高,其导电能力下降。 第二类导体:如电解质溶液和熔融电解质,是由于正、负离 子在电场作用下定向移动而传导电流,第二类导体在传导电流 的同时在两极发生电极反应,且温度升高其导电能力增大
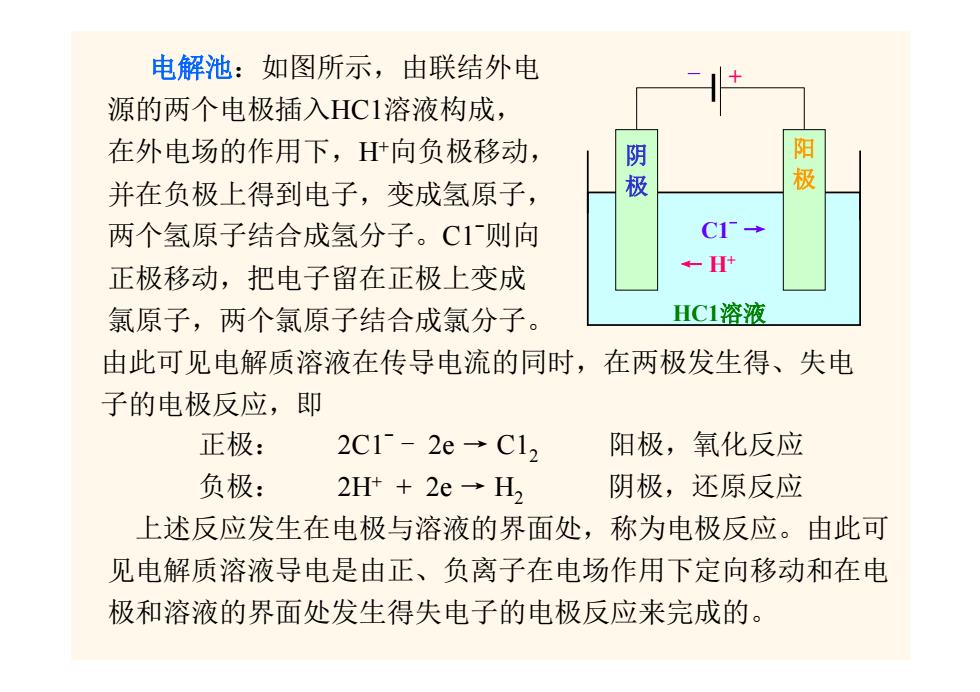
电解池:如图所示,由联结外电 源的两个电极插入HC1溶液构成, 在外电场的作用下,H+向负极移动, 现 阳 并在负极上得到电子,变成氢原子, 极 两个氢原子结合成氢分子。C1则向 C1→ 正极移动,把电子留在正极上变成 ←H 氯原子,两个氯原子结合成氯分子。 HC1溶液 由此可见电解质溶液在传导电流的同时,在两极发生得、失电 子的电极反应,即 正极: 2C1-2e→C1, 阳极,氧化反应 负极: 2Ht+2e→H2 阴极,还原反应 上述反应发生在电极与溶液的界面处,称为电极反应。由此可 见电解质溶液导电是由正、负离子在电场作用下定向移动和在电 极和溶液的界面处发生得失电子的电极反应来完成的
电解池:如图所示,由联结外电 源的两个电极插入HC1溶液构成, 在外电场的作用下,H+向负极移动, 并在负极上得到电子,变成氢原子, 两个氢原子结合成氢分子。C1-则向 正极移动,把电子留在正极上变成 氯原子,两个氯原子结合成氯分子。 由此可见电解质溶液在传导电流的同时,在两极发生得、失电 子的电极反应,即 正极: 2C1- - 2e → C12 阳极,氧化反应 负极: 2H+ + 2e → H2 阴极,还原反应 上述反应发生在电极与溶液的界面处,称为电极反应。由此可 见电解质溶液导电是由正、负离子在电场作用下定向移动和在电 极和溶液的界面处发生得失电子的电极反应来完成的。 HC1溶液 C1- → ← H+ - + 阴 极 阳 极
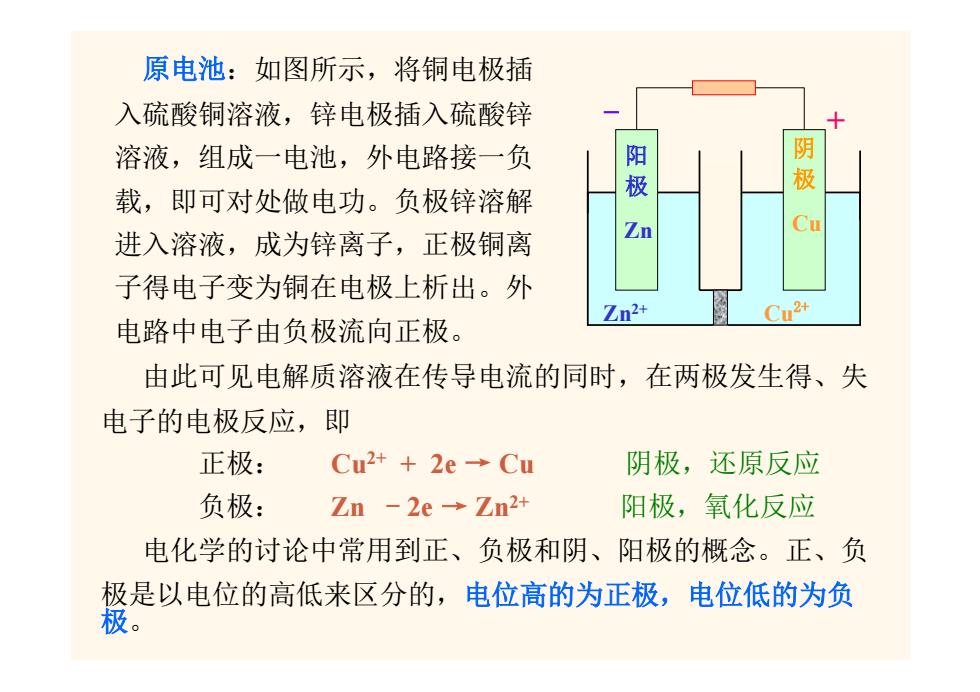
原电池:如图所示,将铜电极插 入硫酸铜溶液,锌电极插入硫酸锌 溶液,组成一电池,外电路接一负 阳极 阴 极 载,即可对处做电功。负极锌溶解 进入溶液,成为锌离子,正极铜离 子得电子变为铜在电极上析出。外 Zn2+ Cu2+ 电路中电子由负极流向正极。 由此可见电解质溶液在传导电流的同时,在两极发生得、失 电子的电极反应,即 正极: Cu2++2e→Cu 阴极,还原反应 负极: Zn-2e→Zn2+ 阳极,氧化反应 电化学的讨论中常用到正、负极和阴、阳极的概念。正、负 极是以电位的高低来区分的,电位高的为正极,电位低的为负
原电池:如图所示, 由此可见电解质溶液在传导电流的同时,在两极发生得、失 电子的电极反应,即 正极: Cu2+ + 2e → Cu 阴极,还原反应 负极: Zn - 2e → Zn2+ 阳极,氧化反应 电化学的讨论中常用到正、负极和阴、阳极的概念。正、负 极是以电位的高低来区分的,电位高的为正极,电位低的为负 极。 Cu2+ Zn2+ + 阳 极 阴 极 - Zn Cu 将铜电极插 入硫酸铜溶液,锌电极插入硫酸锌 溶液,组成一电池,外电路接一负 载,即可对处做电功。负极锌溶解 进入溶液,成为锌离子,正极铜离 子得电子变为铜在电极上析出。外 电路中电子由负极流向正极

而阴、阳极则是以电极反应来区分的,发生氧化反应(失 去电子的反应)的电极称为阳极,发生还原反应(得到电子的 反应)的电极称为阴极。 在电解池中正极发生氧化反应,正极是阳极,负极发生还 原反应,负极是阴极。以后将会看到,在原电池中正极发生还 原反应,正极是阴极,负极发生氧化反应,负极是阳极。 2.法拉第定律 法拉第(Faraday)在总结大量实验结果的基础上于l833年提出 了著名的法拉第定律,该定律内容如下: 1)在电极上发生电极反应的物质的量与通过溶液的电量成 正比。 2)对于串联电解池,每一个电解池的每一个电极上发生电 极反应的物质的量相等
而阴、阳极则是以电极反应来区分的,发生氧化反应(失 去电子的反应)的电极称为阳极,发生还原反应(得到电子的 反应)的电极称为阴极。 在电解池中正极发生氧化反应,正极是阳极,负极发生还 原反应,负极是阴极。以后将会看到,在原电池中正极发生还 原反应,正极是阴极,负极发生氧化反应,负极是阳极。 2.法拉第定律 法拉第(Faraday)在总结大量实验结果的基础上于1833年提出 了著名的法拉第定律,该定律内容如下: 1)在电极上发生电极反应的物质的量与通过溶液的电量成 正比。 2)对于串联电解池,每一个电解池的每一个电极上发生电 极反应的物质的量相等