
的 电极过程
第七章 电 极 过 程

§1.引言 一、电极过程中的电极过程步骤 (1),(2), (3),(4),(5) (3)—电化学反应,其余一 次级反应 电极过程特征: ①电极电势影响反应速率 电极对反应有催化作用(加速或减速) 墨 形状、大小、性质等均有影响
§1. 引 言 (1), (2), (3), (4), (5) (3)——电化学反应,其余—— 次级反应 电极过程特征: ① 电极电势影响反应速率 ② 电极对反应有催化作用(加速或减速), 形状、大小、性质等均有影响 一、电极过程中的电极过程步骤

电极反应速率的表示 1 dn I△t r= 而△n= A dt F zF 1 故r= 即roci A F 所以, 实际中以电流密度i表示电极反应速率 三、不可逆电极电势 还原电流密度 电极反应:M++e= M 氧化电流密度
二、电极反应速率的表示 t n A r d 1 d s = 而 zF I t zF Q n = = 故 zF i zF I A r = = s 1 即 r i 所以,实际中以电流密度 i 表示电极反应速率 三、不可逆电极电势 电极反应: - M ze z + + M ic ia 氧化电流密度 还原电流密度

电池或电极处于平衡状态 (可逆):r=ra 即i。=i,此时令。=i=”,称为交换电流密度 通过电极(池)的净电流为零,即i=。一il=0。 实际电极过程,i卡0,即i卡ia,电极的工作 条件不可逆→不可逆电极→不可逆电极电势。 E±,不可逆≠E±,可逆造成这一结果的因素有多种, 如杂质反应等。(见P511) 实际电势偏离平衡电势的现象一 电极极化 图
电池或电极处于平衡状态(可逆): rc = ra, 即 i c = ia,此时令i c = ia = i 0 ,称为交换电流密度 通过电极(池)的净电流为零,即 i = |i c- ia | =0。 实际电极过程,i ≠0,即 i c ≠ia,电极的工作 条件不可逆→不可逆电极→不可逆电极电势。 E±,不可逆≠ E±, 可逆造成这一结果的因素有多种, 如杂质反应等。(见P511) 实际电势偏离平衡电势的现象—— 电极极化
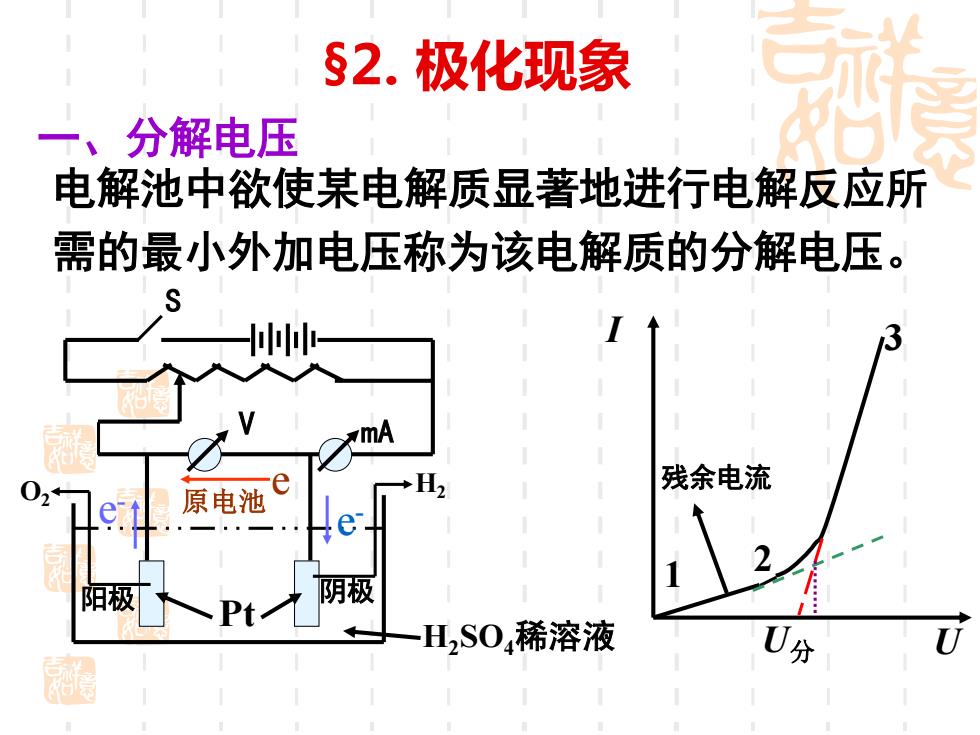
§2.极化现象 一、分解电压 电解池中欲使某电解质显著地进行电解反应所 需的最小外加电压称为该电解质的分解电压。 mA 02 残余电流 原电池 阳极 阴极 Pt 一H,S04稀溶液 0分
§2. 极化现象 一、分解电压 电解池中欲使某电解质显著地进行电解反应所 需的最小外加电压称为该电解质的分解电压。 S V mA H2SO4稀溶液 Pt O2 阴极 e - 原电池 e - e I U 1 2 3 U分 H2 残余电流 阳极