韦斯顿电池的电动势 随温度的变化关系式 可用式(9-2)和(9-3) 表示。 Hg Cd Hg-Cd二元系相图(示意图)
Hg Cd T 韦斯顿电池的电动势 随温度的变化关系式 可用式(9-2)和(9-3) 表示。 Hg-Cd二元系相图(示意图)

§2可逆原电池热力学 、友应吉布斯自由能变化值 与原电他电动势的关系 -△,G。=-W一最大可逆电功 当←1mol时,-W=EQE=zEF 所以,△,Gmp=-zEF;z:1mol反应中电荷计 量系数,故△Gm.Ip与反应方程的写法有关
§2 可逆原电池热力学 一、反应吉布斯自由能变化值 与原电池电动势的关系 ' − r GT , p = −W max ——最大可逆电功 当ξ= 1mol 时,-W’ = I·E·τ= Q·E = zEF 所以,△rGm,T,p= -zEF; z:1mol反应中电荷计 量系数,故△rGm,T,p与反应方程的写法有关
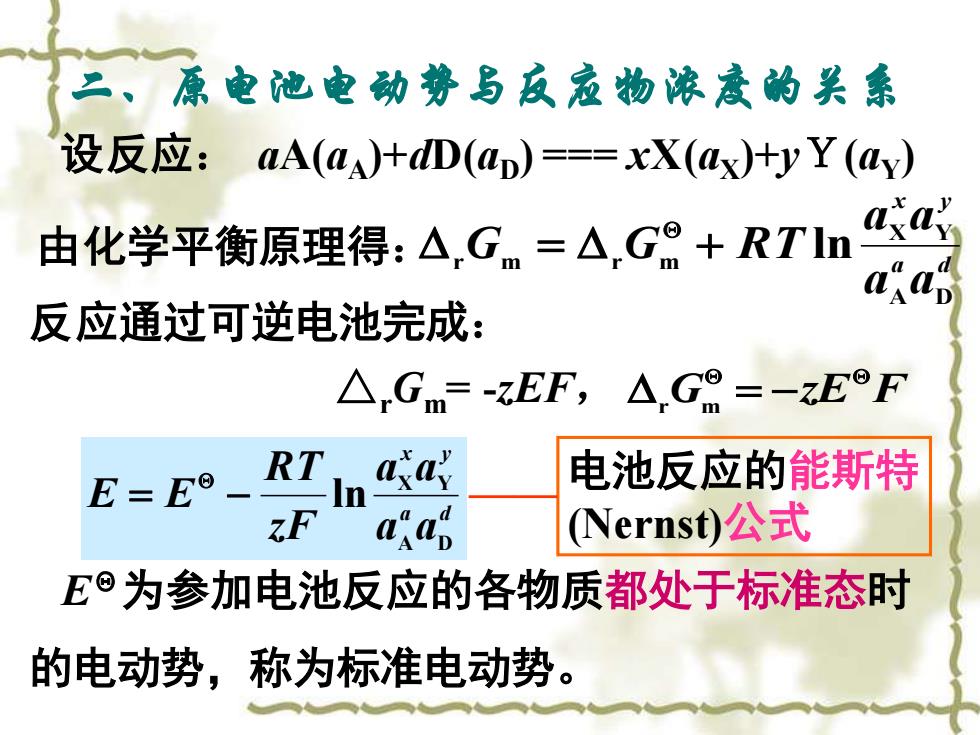
二、原电池电动势与友寇物浓意的关 设反应:aA(aA)+D(aD)==xX(ax)+yY(ay) 由化学平衡原理得:△Gm=△G9+RTln 反应通过可逆电池完成: △.Gm=-zEF,△,G8=-zEF E=EO RT aay 电池反应的能斯特 F a叹ad Nernst)公式 E©为参加电池反应的各物质都处于标准态时 的电动势,称为标准电动势
二、原电池电动势与反应物浓度的关系 设反应: aA(aA)+dD(aD) === xX(aX)+yY(aY) 由化学平衡原理得: a d x y a a a a G G R T A D X Y r m r m = + ln 反应通过可逆电池完成: △rGm= -zEF, G zE F r m = − a d x y a a a a zF RT E E A D X Y = − ln EΘ为参加电池反应的各物质都处于标准态时 的电动势,称为标准电动势。 电池反应的能斯特 (Nernst)公式 ——

RT △.Ga=-RTIn K9 .Eo F [例]已知电池Pt,H2po)1HL2S04(稀)川Au203(S),Au 在298.15K时的电动势E=1.362V,而该温度下H,0的 标准生成吉布斯自由能为-236.66kJmo1。求: (1)在298.15K时,Au203的标准生成吉布斯自由能; (2)在298.15K时,02与Au和Au203达到平衡时的平衡压。 解:()写出电极反应与电池反应 负极3H2po)一→6H+(a+)+6e 正极Au203(S)+6H+(a+)+6e一→2Au(S)+3H20 电池3H2po)+Au203(S)==2Au(S)+3H20
= − a = K a zF R T r G m R T ln K E ln [例] 已知电池 Pt, H2 (pΘ) | H2SO4 (稀) | Au2O3 (s), Au 在298.15K时的电动势 E = 1.362V,而该温度下H2O的 标准生成吉布斯自由能为-236.66kJ·mol-1。求: (1)在298.15K时,Au2O3的标准生成吉布斯自由能; (2)在298.15K时,O2与Au和Au2O3达到平衡时的平衡压。 解:(1)写出电极反应与电池反应 负极 3H2 (pΘ) —→ 6H+ (a+ ) + 6e- 正极 Au2O3 (s) + 6H+ (a+ ) + 6e- —→ 2Au(s) + 3H2O 电池 3H2 (pΘ) + Au2O3 (s) === 2Au(s) + 3H2O

E=E- RT 10 aF 0u,0,(pH,/p) 0au=1,a0,=1,4H,0=1,(pm,/p)=1 故E=E0=1.362V,即: △,Gm=△.G8=-zEF=3△,G8H,o-△,G0a,0, △,G8m,0,)=3×(-236.6⑥+6×1.362×96500x103 =78.62kJ.m0l- (2)写出平衡关系式 2Au+30,(p。)=Au,0,(6)
( / ) ln 2 3 2 2 A u O H 2 A u 3 H O = − a p p a a zF R T E E 1, 1, 1, ( / ) 1 Au Au2 O3 H2 O H2 = = = = a a a p p 故 E = EΘ= 1.362V,即: (Au O ) f m (H O) r m r m 3 f m 2 2 3 G = G = −zEF = G − G 1 3 (Au O ) f m 7 8.6 2k J mol 2 3 3 ( 236.6 6) 6 1.362 96500 1 0 − − = G = − + (2)写出平衡关系式 O ( ) Au O (s) 2 3 2Au + 2 pO2 === 2 3