
实验名称:Na,CO,和NaHCO3混合碱含量的测定(双指示剂法)
实验名称:Na2CO3和NaHCO3混合碱 含量的测定(双指示剂法)

一、实验目的1.了解多元弱碱滴定过程中pH值变化及指示剂的选择。2.掌握用双指示剂法测定混合碱中碳酸钠及碳酸氢钠含量的原理和方法
一、实验目的 1.了解多元弱碱滴定过程中pH值变化及指示 剂的选择。 2.掌握用双指示剂法测定混合碱中碳酸钠及碳 酸氢钠含量的原理和方法

二、实验原理混合碱中碳酸钠及碳酸氢钠可采用双指示剂法进行测定。所谓双指示剂法,就是利用两种指示剂在不同等量点时颜色变化得到两个化学计量点,分别根据各化学计量点时所消耗的标准酸溶液的体积,计算各成分的含量。在含有Na,CO,和NaHCO,混合碱的试液中,加入酚指示剂,用盐酸标准溶液滴定时,其中碳酸钠首先被中和,反应式如下Na,CO,+HCI-NaHCO,+NaCI达到第一个等量点时,CO.2-离子完全变为HCO,离子,这时溶液pH值相当于NaHCO,溶液的pH值为8.31。再加入甲基橙指示剂,继续用盐酸滴定到第二个等量点时,HCO离子完全变为COz,反应式为:NaHCO,+HCI-NaCI+CO,1+H,O溶液的pH为3.88,其各自含量按下图计算
混合碱中碳酸钠及碳酸氢钠可采用双指示剂法进行测定。 所谓双指示剂法,就是利用两种指示剂在不同等量点时颜色变化, 得到两个化学计量点,分别根据各化学计量点时所消耗的标准酸 溶液的体积,计算各成分的含量。 在含有Na2CO3和NaHCO3混合碱的试液中,加入酚酞指示剂, 用盐酸标准溶液滴定时,其中碳酸钠首先被中和,反应式如下: Na2CO3+HCl=NaHCO3+NaCl 达到第一个等量点时,CO3 2-离子完全变为HCO3 -离子,这 时溶液pH值相当于NaHCO3溶液的pH值为8.31。再加入甲基橙 指示剂,继续用盐酸滴定到第二个等量点时,HCO3 -离子完全变 为CO2,反应式为: NaHCO3+HCl=NaCl+CO2↑+H2O 溶液的pH为3.88,其各自含量按下图计算: 二、实验原理
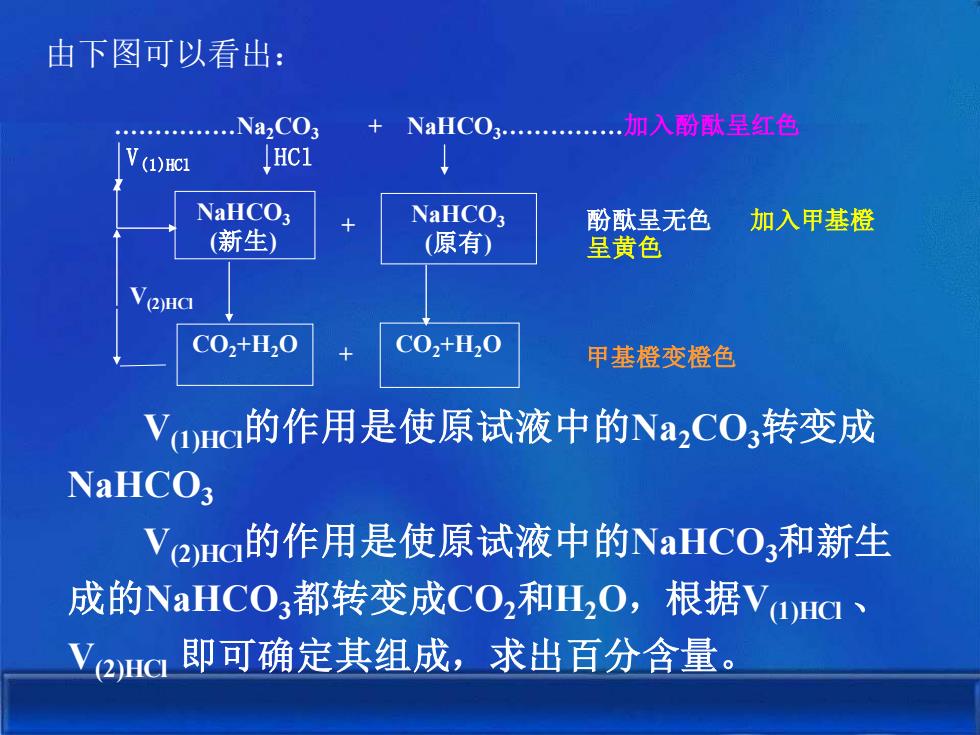
由下图可以看出:加入酚呈红色Na,CO3NaHCOIHC1V(1)HCINaHCO3NaHCO3酚呈无色加入甲基橙(新生)(原有)呈黄色(2)HCICO,+H,0CO2+H,0甲基橙变橙色Va)Hc的作用是使原试液中的Na,CO,转变成NaHCO3V(2)Hci的作用是使原试液中的NaHCO,和新生成的NaHCO,都转变成CO,和H,O,根据V(a)HCV(2)HCI 即可确定其组成,求出百分含量
由下图可以看出: V(1)HCl的作用是使原试液中的Na2CO3转变成 NaHCO3 V(2)HCl的作用是使原试液中的NaHCO3和新生 成的NaHCO3都转变成CO2和H2O,根据V(1)HCl 、 V(2)HCl 即可确定其组成,求出百分含量。 .Na2CO3 + NaHCO3.加入酚酞呈红色 V(1)HCl HCl NaHCO3 (新生) NaHCO3 (原有) CO2+H2O CO2+H2O + 酚酞呈无色 加入甲基橙 呈黄色 + 甲基橙变橙色 V(2)HCl

三、实验内容1.HCI标准溶液的标定(1)硼砂Na,B4O·10HO与HCI完全中和时,反应如下:Na,B4O,+2HCl+5H,O=4H,BO,+2NaCl根据上式计算中和2OmL0.1mol/HCI溶液所需硼砂Na,B.O10H,O的重量,在分析天平上准确称取三份分别放入三个已编号的250毫升锥形瓶中,各加20-30mL水,加热使其溶解,然后冷却至室温。(2)在锥形瓶中加入2滴0.1%的甲基红指示剂,用0.1mol/LHCI溶液滴定至溶液的黄色转变为橙色。记下所消耗的HCI溶液的体积,计算HCI溶液的摩尔浓度。在重复滴定两次,要求相对平均偏差在0.2%以内,取平均值
三、实验内容 1.HCl标准溶液的标定 (1) 硼砂Na2B4O7·10H2O与HCl完全中和时,反应如下: Na2B4O7+2HCl+5H2O=4H2BO3+2NaCl 根据上式计算中和20mL0.1mol/HCl溶液所需硼砂 Na2B4O7·10H2O的重量,在分析天平上准确称取三份分别放入三个 已编号的250毫升锥形瓶中,各加20-30mL水,加热使其溶解,然 后冷却至室温。 (2) 在锥形瓶中加入2滴0.1%的甲基红指示剂,用 0.1mol/LHCl溶液滴定至溶液的黄色转变为橙色。记下所消耗的 HCl溶液的体积,计算HCl溶液的摩尔浓度。在重复滴定两次,要 求相对平均偏差在0.2%以内,取平均值