
醋酸电离度和电离平衡常数测定
醋酸电离度和电离 平衡常数测定

一、实验目的>1.学会正确使用酸度计测定溶液的pH值,了解用酸度计法测定HAc电离度和电离平衡常数的原理和方法;》2.进一步熟悉滴定、移液、定容等基本操作
一、实验目的 ➢1. 学会正确使用酸度计测定溶液的pH值, 了解用酸度计法测定HAc电离度和电离平衡 常数的原理和方法; ➢ 2. 进一步熟悉滴定、移液、定容等基本操 作

二、实验原理7HAc是弱电解质,在水溶液中部分电离,存在下列平衡:HAC=H++Ac起始浓度00C平衡浓度C-CaCaCaCαC(H+)·C(Ac)其平衡常数表达式为:Ka=C(HAc)1-αCH+醋酸的总浓度可用标准NaOH溶液滴定测得,溶液中的H+浓度可用酸度计测定!从而可求得醋酸的电离度a和电离平衡常数
二、实验原理 ➢ HAc是弱电解质,在水溶液中部分电离,存在下列 平衡: HAc = H+ + Ac- 起始浓度 C 0 0 平衡浓度 C-Cα Cα Cα 其平衡常数表达式为: 2 ( ) ( ) ( ) 1 C H C Ac C Ka C HAc + − = = − C H( ) C + = 醋酸的总浓度可用标准NaOH溶液滴定测得,溶液中 的H+浓度可用酸度计测定,从而可求得醋酸的电离度a 和电离平衡常数

三、实验内容>1.测定HAC溶液的浓度用移液管分别取25.00mLHAc溶液于两个洁净的250mL锥形瓶中,各加2~3滴酚指示剂,用NaOH标准溶液滴定至微红且半分钟不褪色即可,准确记录滴定消耗的NaOH标准溶液的体积
三、实验内容 ➢1.测定HAc溶液的浓度 用移液管分别取25.00 mLHAc溶液 于两个洁净的250 mL锥形瓶中,各加2~ 3滴酚酞指示剂,用NaOH标准溶液滴定至 微红且半分钟不褪色即可,准确记录滴定 消耗的NaOH标准溶液的体积
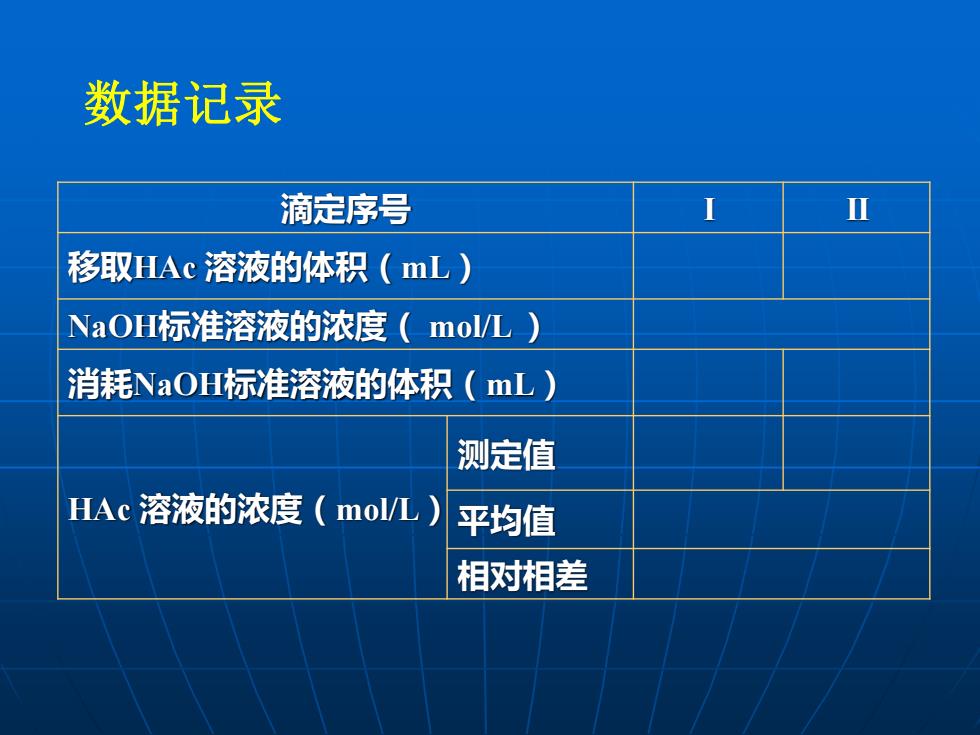
数据记录ⅡI滴定序号T移取HAc溶液的体积(mL)NaOH标准溶液的浓度(mol/L)消耗NaOH标准溶液的体积(mL)测定值HAc溶液的浓度(mol/L)平均值相对相差
滴定序号 I II 移取HAc 溶液的体积(mL) NaOH标准溶液的浓度( mol/L ) 消耗NaOH标准溶液的体积(mL) HAc 溶液的浓度(mol/L) 测定值 平均值 相对相差 数据记录