
电解质溶液
电 解 质 溶 液

目的要求1。进一步理解电解质电离的特点,了解影响电离平衡移动的因素·2掌握缓冲溶液的配制和性质·3.了解盐类水解和影响盐类水解的因素
一、目的要求 • 1.进一步理解电解质电离的特点,了解影 响电离平衡移动的因素。 • 2.掌握缓冲溶液的配制和性质。 • 3. 了解盐类水解和影响盐类水解的因素

基本原理二、1.强电解质和弱电解质强电解质在水溶液中是完全电离的,不存在电离平衡,弱电解质是部分电离,存在电离平衡。2.同离子效应和缓冲溶液在弱电解质溶液中,加入含有共同离子的强电解质,可使弱电解质的电离度降低,这种效应称为同离子效应缓冲溶液是指弱酸或弱碱及其盐所组成的溶液能够抵抗少量外加酸、碱或稀释,pH值基本保持不变。3.弱电解质的电离平衡与盐的水解有些离子能够与水反应,给出质子或接受质子形成难电离的弱电解质,使溶液显出不同的酸碱性,此即为盐的水解
二、基本原理 1.强电解质和弱电解质。 强电解质在水溶液中是完全电离的,不存在电离 平衡,弱电解质是部分电离,存在电离平衡。 2.同离子效应和缓冲溶液 在弱电解质溶液中,加入含有共同离子的强电解 质,可使弱电解质的电离度降低,这种效应称为同 离子效应。 缓冲溶液是指弱酸或弱碱及其盐所组成的溶液, 能够抵抗少量外加酸、碱或稀释,pH值基本保持 不变。 3.弱电解质的电离平衡与盐的水解 有些离子能够与水反应,给出质子或接受质子, 形成难电离的弱电解质,使溶液显出不同的酸碱性, 此即为盐的水解

4.难溶电解质的沉淀溶解平衡与溶度积常数难溶电解质的饱和水溶液中,存在沉淀和溶解的多相平衡,例如:AgC1 (S)Ag(aq)+Cl(aq)溶度积常数Ksp=C(Agt)·C(CI)。5.沉淀的次序与转化当溶液中含有几种可被同一种沉淀剂沉淀的离子时,加入沉淀剂,由于被沉淀离子的浓度和溶度积不同,所以形成沉淀的先后顺序不同。同理,一种难溶物在一定条件下,也可以转化成另一种难溶物
4.难溶电解质的沉淀溶解平衡与溶度积常数 难溶电解质的饱和水溶液中,存在沉淀和溶解 的多相平衡,例如: AgCl(S)Ag+ (aq)+Cl- (aq) 溶度积常数 Ksp=C(Ag+ )·C(Cl- )。 5.沉淀的次序与转化 当溶液中含有几种可被同一种沉淀剂沉淀的离 子时,加入沉淀剂,由于被沉淀离子的浓度和溶度 积不同,所以形成沉淀的先后顺序不同。同理,一 种难溶物在一定条件下,也可以转化成另一种难溶 物
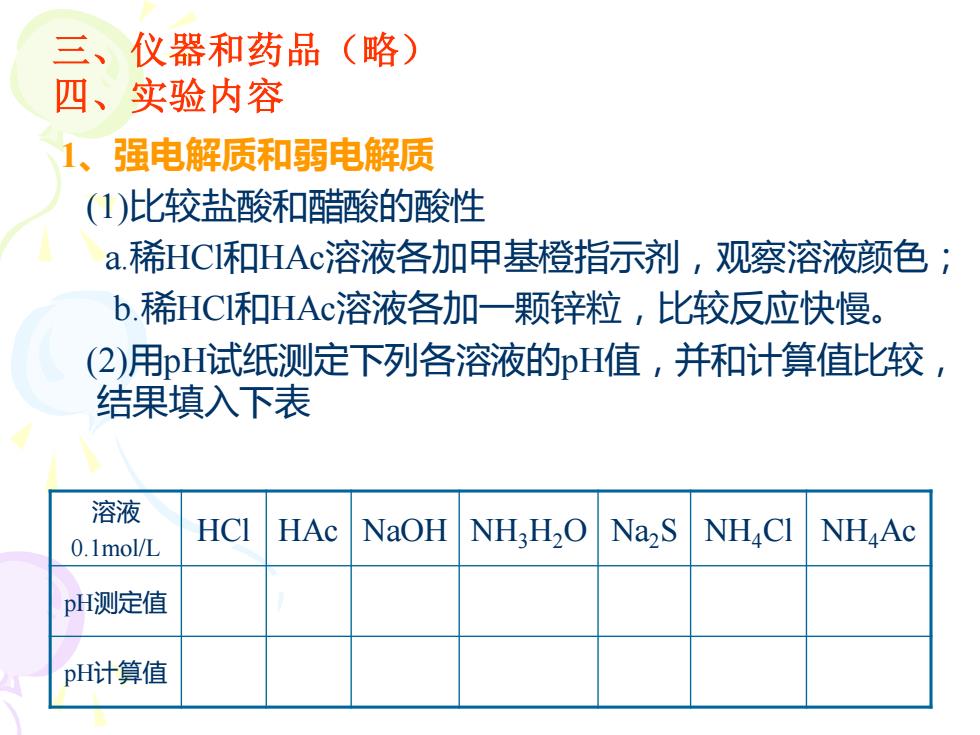
(略)仪器和药品三、←四、实验内容强电解质和弱电解质(1)比较盐酸和醋酸的酸性a.稀HCI和HAc溶液各加甲基橙指示剂,观察溶液颜色;b.稀HCI和HAc溶液各加一颗锌粒,比较反应快慢(2)用pH试纸测定下列各溶液的pH值,并和计算值比较结果填入下表溶液HC1HAcNaOHNa,S NHCINH,H,ONHAc0.1mol/LpH测定值pH计算值
1、强电解质和弱电解质 (1)比较盐酸和醋酸的酸性 a.稀HCl和HAc溶液各加甲基橙指示剂,观察溶液颜色; b.稀HCl和HAc溶液各加一颗锌粒,比较反应快慢。 (2)用pH试纸测定下列各溶液的pH值,并和计算值比较, 结果填入下表 三、仪器和药品(略) 四、实验内容 溶液 0.1mol/L HCl HAc NaOH NH3H2O Na2S NH4Cl NH4Ac pH测定值 pH计算值