
石河子大学教案课程名称实 验化 学 A-1任课班级、动医10-2、生科10-3任课教师夏新福化学化工学院,化学系2010一一2011学年第一学期
石 河 子 大 学 教 案 课程名称 实 验 化 学 A-1 任课班级 动医 10-2、生科 10-3 任课教师 夏新福 化学化工 学院 化学系 2010——2011 学年第一学期
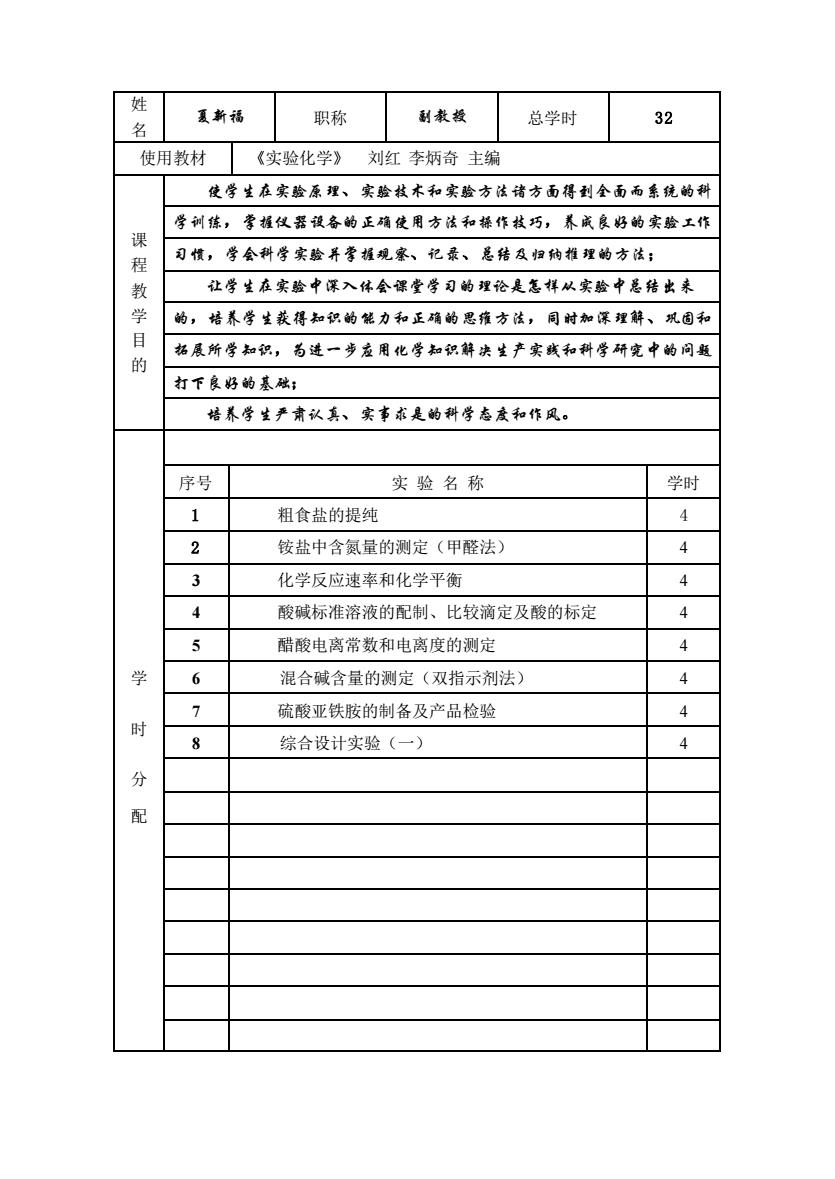
姓夏新福副教投职称32总学时名使用教材《实验化学》刘红李炳奇主编使学生在实验原理、实验技木和实验方法诸方面得到全面而系统的科学训练,学握仪器设备的正确使用方法和操作技巧,养成良好的实验工作课习惯,学会科学实验并学握观察、记录、总结及归纳推理的方法;程教让学生在实验中深入体会课堂学习的理论是怎样从实验中总结出来学的,培养学生获得知识的能力和正确的思维方法,同时加深理解、巩固和目拓展所学知识,为进一步应用化学知识解决生产实践和科学研究中的间题的打下良好的基础;培养学生严肃认真、实事求是的科学态度和作风。序号实验名称学时14粗食盐的提纯24铵盐中含氮量的测定(甲醛法)34化学反应速率和化学平衡44酸碱标准溶液的配制、比较滴定及酸的标定54醋酸电离常数和电离度的测定学64混合碱含量的测定(双指示剂法)74硫酸亚铁胺的制备及产品检验时84综合设计实验(一)分配
姓 名 夏新福 职称 副教授 总学时 32 使用教材 《实验化学》 刘红 李炳奇 主编 课 程 教 学 目 的 使学生在实验原理、实验技术和实验方法诸方面得到全面而系统的科 学训练,掌握仪器设备的正确使用方法和操作技巧,养成良好的实验工作 习惯,学会科学实验并掌握观察、记录、总结及归纳推理的方法; 让学生在实验中深入体会课堂学习的理论是怎样从实验中总结出来 的,培养学生获得知识的能力和正确的思维方法,同时加深理解、巩固和 拓展所学知识,为进一步应用化学知识解决生产实践和科学研究中的问题 打下良好的基础; 培养学生严肃认真、实事求是的科学态度和作风。 学 时 分 配 序号 实 验 名 称 学时 1 粗食盐的提纯 4 2 铵盐中含氮量的测定(甲醛法) 4 3 化学反应速率和化学平衡 4 4 酸碱标准溶液的配制、比较滴定及酸的标定 4 5 醋酸电离常数和电离度的测定 4 6 混合碱含量的测定(双指示剂法) 4 7 硫酸亚铁胺的制备及产品检验 4 8 综合设计实验(一) 4
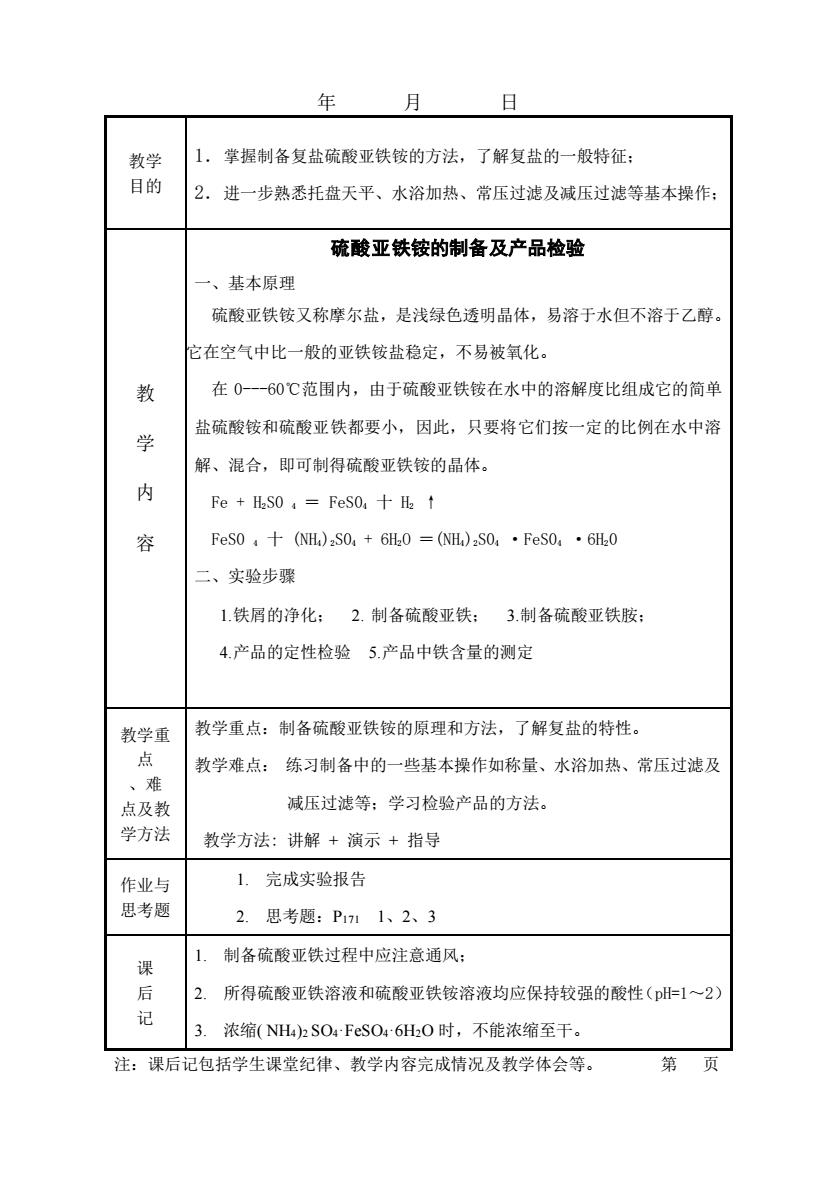
年日月1掌握制备复盐硫酸亚铁铵的方法,了解复盐的一般特征;教学目的2.进一步熟悉托盘天平、水浴加热、常压过滤及减压过滤等基本操作;硫酸亚铁铵的制备及产品检验一、基本原理硫酸亚铁铵又称摩尔盐,是浅绿色透明晶体,易溶于水但不溶于乙醇。它在空气中比一般的亚铁铵盐稳定,不易被氧化。在0---60℃范围内,由于硫酸亚铁铵在水中的溶解度比组成它的简单教盐硫酸铵和硫酸亚铁都要小,因此,只要将它们按一定的比例在水中溶学解、混合,即可制得硫酸亚铁铵的晶体。内Fe+HSo=FesO,+HztFeS0+(NH)2SO,+6H20=(NH)2S04FeS0·6H20容二、实验步骤1.铁屑的净化;2.制备硫酸亚铁;3.制备硫酸亚铁胺;4.产品的定性检验5.产品中铁含量的测定教学重点:制备硫酸亚铁铵的原理和方法,了解复盐的特性。教学重点教学难点:练习制备中的一些基本操作如称量、水浴加热、常压过滤及、难减压过滤等;学习检验产品的方法。点及教学方法教学方法:讲解+演示+指导1.完成实验报告作业与思考题2.思考题:P1711、2、3制备硫酸亚铁过程中应注意通风;1.课后2.所得硫酸亚铁溶液和硫酸亚铁铵溶液均应保持较强的酸性(pH=1~2)记3.浓缩(NH4)2SO4FeSO4-6H2O时,不能浓缩至干。第页注:课后记包括学生课堂纪律、教学内容完成情况及教学体会等
年 月 日 教学 目的 1.掌握制备复盐硫酸亚铁铵的方法,了解复盐的一般特征; 2.进一步熟悉托盘天平、水浴加热、常压过滤及减压过滤等基本操作; 教 学 内 容 硫酸亚铁铵的制备及产品检验 一、基本原理 硫酸亚铁铵又称摩尔盐,是浅绿色透明晶体,易溶于水但不溶于乙醇。 它在空气中比一般的亚铁铵盐稳定,不易被氧化。 在 0-60℃范围内,由于硫酸亚铁铵在水中的溶解度比组成它的简单 盐硫酸铵和硫酸亚铁都要小,因此,只要将它们按一定的比例在水中溶 解、混合,即可制得硫酸亚铁铵的晶体。 Fe + H2S0 4 = FeS04 十 H2 ↑ FeS0 4 十 (NH4)2S04 + 6H2O =(NH4)2S04 ·FeS04 ·6H20 二、实验步骤 1.铁屑的净化; 2. 制备硫酸亚铁; 3.制备硫酸亚铁胺; 4.产品的定性检验 5.产品中铁含量的测定 教学重 点 、难 点及教 学方法 教学重点:制备硫酸亚铁铵的原理和方法,了解复盐的特性。 教学难点: 练习制备中的一些基本操作如称量、水浴加热、常压过滤及 减压过滤等;学习检验产品的方法。 教学方法: 讲解 + 演示 + 指导 作业与 思考题 1. 完成实验报告 2. 思考题:P171 1、2、3 课 后 记 1. 制备硫酸亚铁过程中应注意通风; 2. 所得硫酸亚铁溶液和硫酸亚铁铵溶液均应保持较强的酸性(pH=1~2) 3. 浓缩( NH4)2 SO4·FeSO4·6H2O 时,不能浓缩至干。 注:课后记包括学生课堂纪律、教学内容完成情况及教学体会等。 第 页

日年月1.了解多元弱碱滴定过程中pH值变化及指示剂的选择。教学2.掌握双指示剂法测定混合碱的原理和方法。目的3.进一步练习称量、滴定、移液、定容等基本操作。混合碱含量的测定一、基本原理以HCI标准溶液为滴定剂,酚酰为第一计量点指示剂,甲基橙为第二计量点指示剂。Na2CO的K%=1.8×10-4,K=2.4×10-8HCI + NazCO;第一计量点 NaHCO: + NaCIHCI + NaHCO3 第二计量点 NaCI + H2O + CO2教二、实验步骤准确称取样品0.7g左右,溶解后定容于150.00mL容量瓶中。移取学25.00mL,加入酚酞滴至由红色变为无色为第一计量点,再加入甲基橙继续滴至由黄色变为橙色为第二计量点内(NaC:)HC)(HC)×10MNa,)0.0x10025.00容W样 (NaHCO:)= HC)()-)HC)×10 x M(NaHCO,) , 50.0,×10025.00W¥c(HCI)×(V, +V)(HCI)×10-3 × M(Na,CO,)150.0(总碱量)=×10025.00W教学重教学重点:双指示剂法测定混合碱的原理和方法;点理解多元弱碱滴定过程中,pH值变化及指示剂的选择。、难教学难点:称量、定容、移液、滴定等基本操作点及教教学方法:讲解+演示+指导学方法1.完成实验报告作业、思考题2.思考题:Pi241、2、3酚由红色到无色不很敏锐,过程较长,应缓慢耐心地滴定,且滴定课速度宜慢,近终点每加1滴后摇匀,至颜色稳定后再加第2滴。否则,后记因为颜色变化较慢,容易过量。第页注:课后记包括学生课堂纪律、教学内容完成情况及教学体会等
年 月 日 教学 目的 1.了解多元弱碱滴定过程中 pH 值变化及指示剂的选择。 2.掌握双指示剂法测定混合碱的原理和方法。 3.进一步练习称量、滴定、移液、定容等基本操作。 教 学 内 容 混合碱含量的测定 一、基本原理 以 HCl 标准溶液为滴定剂,酚酞为第一计量点指示剂,甲基橙为第 二计量点指示剂。Na2CO3 的 K o b1 =1.8×10-4,K o b2 =2.4×10-8 HCl + Na2CO3 ⎯第一计量点 ⎯⎯ ⎯→ NaHCO3 + NaCl HCl + NaHCO3 ⎯第二计量点 ⎯⎯ ⎯→ NaCl + H2O + CO2 二、实验步骤 准确称取样品 0.7g 左右,溶解后定容于 150.00mL 容量瓶中。移取 25.00mL,加入酚酞滴至由红色变为无色为第一计量点,再加入甲基橙继 续滴至由黄色变为橙色为第二计量点 ω(Na2CO3)= 100 25.00 150.0 W (HCl) (HCl) 10 (Na CO ) 2 3 3 1 − 样 c V M ω(NaHCO3)= 100 25.00 150.0 W (HCl) ( )(HCl) 10 (NaHCO )3 3 2 1 − − 样 c V V M ω(总碱量)= 100 25.00 150.0 W (HCl) ( )(HCl) 10 ( Na CO ) 2 2 3 3 1 2 1 + − 样 c V V M 教学重 点 、难 点及教 学方法 教学重点:双指示剂法测定混合碱的原理和方法; 理解多元弱碱滴定过程中,pH 值变化及指示剂的选择。 教学难点:称量、定容、移液、滴定等基本操作 教学方法: 讲解 + 演示 + 指导 作业、 思考题 1. 完成实验报告 2. 思考题:P124 1、2、3 课 后 记 酚酞由红色到无色不很敏锐,过程较长,应缓慢耐心地滴定,且滴定 速度宜慢,近终点每加1滴后摇匀,至颜色稳定后再加第2滴。否则, 因为颜色变化较慢,容易过量。 注:课后记包括学生课堂纪律、教学内容完成情况及教学体会等。 第 页

年月日1.练习容量瓶的洗涤、定容等基本操作。教学目的2.掌握甲醛法测定铵盐中含氮量的原理和方法。铵盐中含氮量的测定甲醛法、基本原理由于NH4+的酸性太弱(K°=5.6×10-10),不能用NaOH标准溶液直接滴定,甲醛法简便快速应用广泛。4NH4++6HCHO====(CH2)6N4H++3H++6H2O生成的酸可用NaOH标准溶液直接滴定教(CH2)6N4H*+3H++ 4OH-====(CH2)6N4 +4H2O以酚酞为指示剂,滴定至微粉红色,且半分钟不褪色即为终点。学二、实验步骤1.NaOH标准溶液的标定内2.准确称量0.50~0.60g(NH4)2SO4样品定容于150mL容量瓶。①检验是否有游离酸取25.00mL,加2d甲基橙,若呈橙色示无容游离酸,若呈红色,则用NaOH滴定至橙色,消耗体积记为Vi。②另取25.00mL(NH4)SO4于锥形瓶中+5mL18%中性甲醛,摇匀后静置5min,以酚酞为指示剂,用NaOH滴定至微粉红色,且半分钟不褪色即为终点。消耗体积记为V2。含氮量按下式计算N%=(NaH)×(5-WNaOH)x10-× M(M150.0%×100%25.00W样教学重教学重点、难点:点甲醛法测定铵盐中含氮量的原理1.、难2.学习并掌握电子天平称量、容量瓶的洗涤与定容、移液管及滴定管点及教的正确使用学方法教学方法:讲解+演示+指导作业思1.完成实验报告考题(讨2.思考题:P1211、2、3、4论题)该实验整个操作过程中所用仪器精确性高,因此对学生的操作要求课后也高,包括称量、定容、移液、滴定、数据记录等都要求精准,锻炼了记学生认真、耐心、细致的能力。第页注:课后记包括学生课堂纪律、教学内容完成情况及教学体会等
年 月 日 教学 目的 1.练习容量瓶的洗涤、定容等基本操作。 2.掌握甲醛法测定铵盐中含氮量的原理和方法。 教 学 内 容 铵盐中含氮量的测定——甲醛法 一、基本原理 由于 NH4 +的酸性太弱(K o a =5.6×10-10),不能用 NaOH 标准溶液直 接滴定,甲醛法简便快速应用广泛。 4NH4 + + 6HCHO ===== (CH2)6N4H+ + 3H+ + 6H2O 生成的酸可用 NaOH 标准溶液直接滴定 (CH2)6N4H+ + 3H+ + 4OH- ===== (CH2)6N4 + 4H2O 以酚酞为指示剂,滴定至微粉红色,且半分钟不褪色即为终点。 二、实验步骤 1.NaOH 标准溶液的标定 2.准确称量 0.50~0.60g (NH4)2SO4 样品定容于 150mL 容量瓶。 ①检验是否有游离酸 取 25.00mL,加 2d 甲基橙,若呈橙色示无 游离酸,若呈红色,则用 NaOH 滴定至橙色,消耗体积记为 V1。 ②另取 25.00mL (NH4)2SO4 于锥形瓶中+5mL18%中性甲醛,摇匀后 静置 5min,以酚酞为指示剂,用 NaOH 滴定至微粉红色,且半分钟不 褪色即为终点。消耗体积记为 V2。 含氮量按下式计算 N%= 100 25.00 ( ) ( )( ) 10 ( ) 150.0 3 2 1 − − W样 c NaOH V V NaOH M N % 教学重 点 、难 点及教 学方法 教学重点、难点: 1. 甲醛法测定铵盐中含氮量的原理 2. 学习并掌握电子天平称量、容量瓶的洗涤与定容、移液管及滴定管 的正确使用 教学方法: 讲解 + 演示 + 指导 作业思 考题(讨 论题) 1. 完成实验报告 2. 思考题:P121 1、2、3、4 课 后 记 该实验整个操作过程中所用仪器精确性高,因此对学生的操作要求 也高,包括称量、定容、移液、滴定、数据记录等都要求精准,锻炼了 学生认真、耐心、细致的能力。 注:课后记包括学生课堂纪律、教学内容完成情况及教学体会等。 第 页