
第十章调节机制 如同机动车交通,用信号调节代谢途径流动效率更高。CTP是一个多步骤反应的最终产物。 CTP抑制限速步骤催化酶(即天冬氨酸-氨基甲酰转移酶ATCase)活性能够控制这个代谢途 径。 为了在合适的时间和地点发挥作用,必须调节酶的活性。这种调节对于协调生物体内一 直发生的大量生化过程而言是必需的。酶活性的调节方式主要有五种。 1,变构控制。变构蛋白质含有独特的调节位点和多个活性位点。信号小分子与调节位点的 结合是控制这些酶蛋白活性的主要手段。而且,变构蛋白有协同性:一个活性位,点的活 性会影响其它活性位点。因此有变构控制能力的蛋白质也是信息转导分子:能够将信号 分子或同一酶蛋白活性位点的信息传递给蛋白质,调节酶蛋白活性。本章介绍研究最深 入的变构蛋白,即天冬氨酸-氨基甲酰转移酶(ATCase)。该酶催化嘧啶合成途径的第一 步反应,即氨基甲酰转移给天冬氨酸的化学反应。这个酶受该途径终产物CTP的反馈抑 制。在第7章我们已经介绍了一种变构蛋白(即运送氧气的血红蛋白)。 2.酶的多重形式。同功酶(isozyme,isoenzyme)是在不同位置或时间调节酶活性的另一 种形式。同功酶是同一生物体内存在的催化同一反应的同源酶,它们之间在结构上稍有 差异,但是催化反应的Km和Vmax,以及调节特性差异显著。通常同功酶随表达的时 间、地点和发育状态而改变。 3.可逆共价修饰。有很多酶共价连接一个基团后催化活性显著改变,最常见的修饰基团是 磷酸。ATP作为这些修饰反应的磷酸供体,催化的酶是蛋白激酶。蛋白磷酸酯酶负责删 除蛋白质的磷酸基团。本章介绍蛋白激酶的结构、特异性和活性调节。PKA是真核生物 广泛存在的蛋白激酶,能够调节不同的目标蛋白质。 4.蛋白裂解活化。有些调节使酶蛋白活性能够来回变化,使之处于有活性和无活性两种状 态。还有一种调节方式是酶蛋白活性不可逆转地激活。只要水解少数几个肽键甚至一个 肽键就能够酶激活的蛋白质称为酶原(ymogen,.or proenzyme)。这种机制能够产生消化 酶如胰凝乳蛋白酶、胰蛋白酶、和胃蛋白酶。血液凝固就是酶原激活的级联反应。特异 抑制蛋白与分子靶标不可逆结合关闭凝血过程。 5.酶量控制。调节酶量也是调节酶活性的一种方法。通常在转录水平进行这种调节。在31 章我们将介绍这种调节模式。 下面,我们首先介绍天冬氨酸-氨基甲酰转移酶,一种变构调节的蛋白质。 10.1天冬氨酸-氨基甲酰转移酶是一种变构调节酶,受该途径终端产物抑制。 天冬氨酸-氨基甲酰转移酶催化嘧啶合成的第一步,天冬氨酸和氨基羧酸磷酸缩合形成 N-氨羰基天冬氨酸和磷酸(图101)。该反应是嘧啶合成途径的限速步骤。如何精确调节这
第十章 调节机制 如同机动车交通,用信号调节代谢途径流动效率更高。CTP 是一个多步骤反应的最终产物。 CTP 抑制限速步骤催化酶(即天冬氨酸-氨基甲酰转移酶 ATCase)活性能够控制这个代谢途 径。 为了在合适的时间和地点发挥作用,必须调节酶的活性。这种调节对于协调生物体内一 直发生的大量生化过程而言是必需的。酶活性的调节方式主要有五种。 1. 变构控制。变构蛋白质含有独特的调节位点和多个活性位点。信号小分子与调节位点的 结合是控制这些酶蛋白活性的主要手段。而且,变构蛋白有协同性:一个活性位点的活 性会影响其它活性位点。因此有变构控制能力的蛋白质也是信息转导分子:能够将信号 分子或同一酶蛋白活性位点的信息传递给蛋白质,调节酶蛋白活性。本章介绍研究最深 入的变构蛋白,即天冬氨酸-氨基甲酰转移酶(ATCase)。该酶催化嘧啶合成途径的第一 步反应,即氨基甲酰转移给天冬氨酸的化学反应。这个酶受该途径终产物 CTP 的反馈抑 制。在第 7 章我们已经介绍了一种变构蛋白(即运送氧气的血红蛋白)。 2. 酶的多重形式。同功酶(isozyme,isoenzyme)是在不同位置或时间调节酶活性的另一 种形式。同功酶是同一生物体内存在的催化同一反应的同源酶,它们之间在结构上稍有 差异,但是催化反应的 Km 和 Vmax,以及调节特性差异显著。通常同功酶随表达的时 间、地点和发育状态而改变。 3. 可逆共价修饰。有很多酶共价连接一个基团后催化活性显著改变,最常见的修饰基团是 磷酸。ATP 作为这些修饰反应的磷酸供体,催化的酶是蛋白激酶。蛋白磷酸酯酶负责删 除蛋白质的磷酸基团。本章介绍蛋白激酶的结构、特异性和活性调节。PKA 是真核生物 广泛存在的蛋白激酶,能够调节不同的目标蛋白质。 4. 蛋白裂解活化。有些调节使酶蛋白活性能够来回变化,使之处于有活性和无活性两种状 态。还有一种调节方式是酶蛋白活性不可逆转地激活。只要水解少数几个肽键甚至一个 肽键就能够酶激活的蛋白质称为酶原(zymogen, or proenzyme)。这种机制能够产生消化 酶如胰凝乳蛋白酶、胰蛋白酶、和胃蛋白酶。血液凝固就是酶原激活的级联反应。特异 抑制蛋白与分子靶标不可逆结合关闭凝血过程。 5. 酶量控制。调节酶量也是调节酶活性的一种方法。通常在转录水平进行这种调节。在 31 章我们将介绍这种调节模式。 下面,我们首先介绍天冬氨酸-氨基甲酰转移酶,一种变构调节的蛋白质。 10.1 天冬氨酸-氨基甲酰转移酶是一种变构调节酶,受该途径终端产物抑制。 天冬氨酸-氨基甲酰转移酶催化嘧啶合成的第一步,天冬氨酸和氨基羧酸磷酸缩合形成 N-氨羰基天冬氨酸和磷酸(图 10.1)。该反应是嘧啶合成途径的限速步骤。如何精确调节这
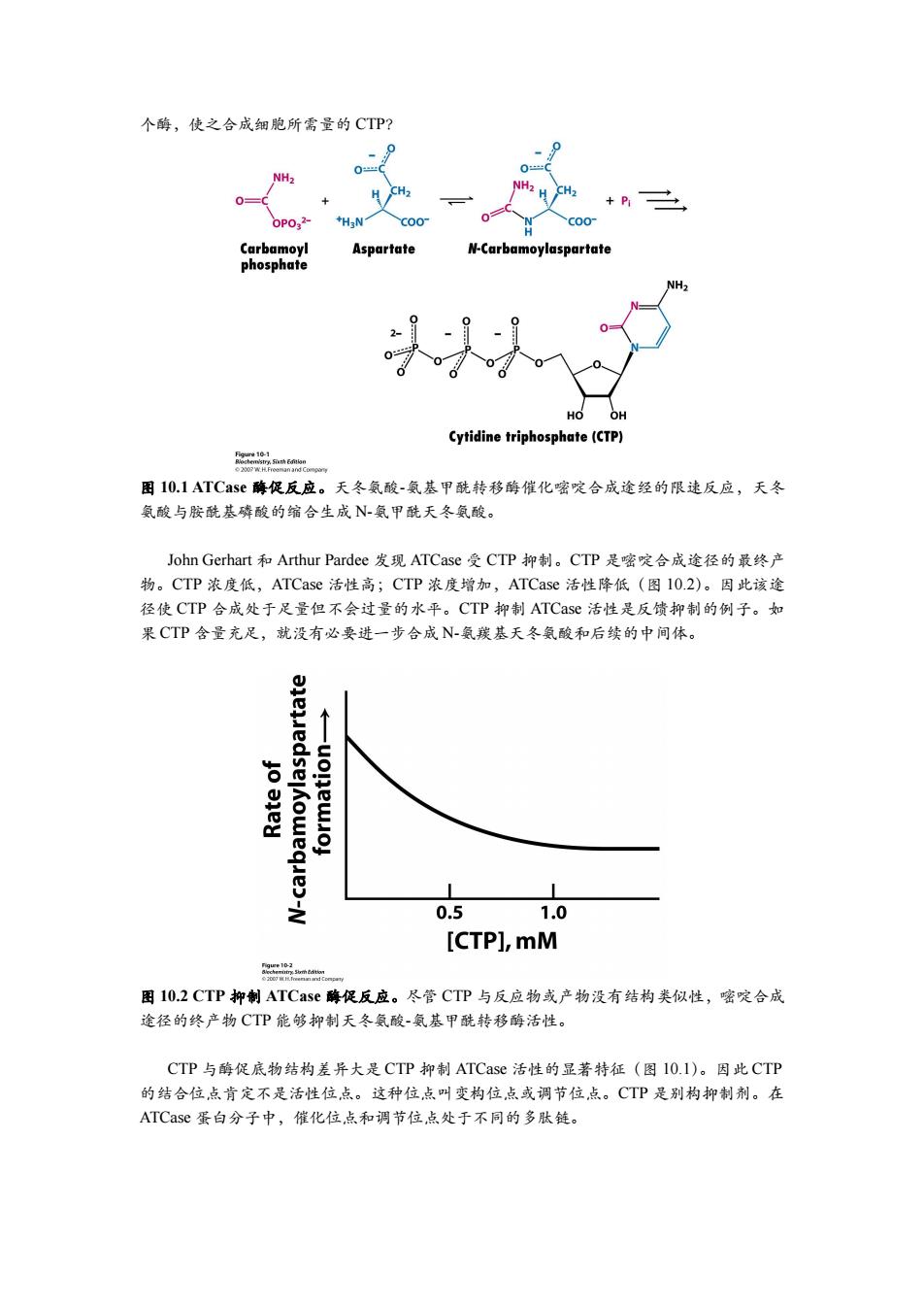
个酶,使之合成细胞所需量的CTP? NH- NH2 +P oP032 C00 Carbamoyl Aspartate N-Carbamoylaspartate phosphate NH- HO OH Cytidine triphosphate(CTP) 图10.1 ATCase酶促反应。天冬氨酸-氨基甲酰转移酶催化嘧啶合成途经的限速反应,天冬 氨酸与胺酰基磷酸的缩合生成N-氨甲酰天冬氨酸。 John Gerhart和Arthur Pardee发现ATCase受CTP抑制。CTP是嘧啶合成途径的最终产 物。CTP浓度低,ATCase活性高;CTP浓度增加,ATCase活性降低(图l0.2)。因此该途 径使CTP合成处于足量但不会过量的水平。CTP抑制ATCase活性是反馈抑制的例子。如 果CTP含量充足,就没有必要进一步合成N-氨羰基天冬氨酸和后续的中间体。 6 之 0.5 1.0 [CTP],mM n 图10.2CTP抑制ATCase酶促反应。尽管CTP与反应物或产物没有结构类似性,嘧啶合成 途径的终产物CTP能够抑制天冬氨酸-氨基甲酰转移酶活性。 CTP与酶促底物结构差异大是CTP抑制ATCase活性的显著特征(图I0.I)。因此CTP 的结合位点肯定不是活性位点。这种位点叫变构位点或调节位点。CTP是别构抑制剂。在 ATCase蛋白分子中,催化位点和调节位点处于不同的多肽链
个酶,使之合成细胞所需量的 CTP? 图 10.1 ATCase 酶促反应。天冬氨酸-氨基甲酰转移酶催化嘧啶合成途经的限速反应,天冬 氨酸与胺酰基磷酸的缩合生成 N-氨甲酰天冬氨酸。 John Gerhart 和 Arthur Pardee 发现 ATCase 受 CTP 抑制。CTP 是嘧啶合成途径的最终产 物。CTP 浓度低,ATCase 活性高;CTP 浓度增加,ATCase 活性降低(图 10.2)。因此该途 径使 CTP 合成处于足量但不会过量的水平。CTP 抑制 ATCase 活性是反馈抑制的例子。如 果 CTP 含量充足,就没有必要进一步合成 N-氨羰基天冬氨酸和后续的中间体。 图 10.2 CTP 抑制 ATCase 酶促反应。尽管 CTP 与反应物或产物没有结构类似性,嘧啶合成 途径的终产物 CTP 能够抑制天冬氨酸-氨基甲酰转移酶活性。 CTP 与酶促底物结构差异大是 CTP 抑制 ATCase 活性的显著特征(图 10.1)。因此 CTP 的结合位点肯定不是活性位点。这种位点叫变构位点或调节位点。CTP 是别构抑制剂。在 ATCase 蛋白分子中,催化位点和调节位点处于不同的多肽链

变构调节酶不遵循米氏动力学 除了酶受其它分子调节之外,变构酶促反应对底物浓度的应答也很有特征。图103是 ATCase酶促反应速度对底物Asp浓度作图的结果。这个动力学曲线与米氏方程不同,形状 像“S”。很多变构酶促动力学曲线呈S型。血红蛋白的有能够结合曲线也是S型,亚基与 氧气的结合是正协同的,即蛋白分子中一个位点与氧气结合增加这个分子其它位点的氧气结 合性能。为了理解ATCase酶促反应动力学和CTP抑制酶活性的基础,我们需要考察ATCase 结构。 ajey 111 10203040 [Aspartate],mM 图10.3 ATCase酶促反应动力学呈S曲线。天冬氨酸-氨基甲酰转移酶催化反应得产物形成 速度对底物AS即浓度作图呈S型曲线,表明一个活性位,点结合底物能够增加这个酶蛋白分 子其它位点的活性。因此这个酶是正协同酶。 ATCase含有独立的催化亚基和调节亚基 ATCase的催化位点和调节位点是什么?用汞类物质如p-羟基汞苯甲酸(只与巯基反应) 处理,能够将ATCase的催化亚基(c)与调节亚基(r)分开(图l0.4)。John Gerhart和Howard Schachman超离心研究显示,汞处理将ATCase分成两种亚基(图l0.5)。由于这两种亚基的 电荷和大小不同,因此可以用离子交换层析(有电荷差异)或蔗糖密度梯度离心(有大小差 异)分离。用沉降系数表述两种亚基,它们的大小分别是2.8S和5.8S。加入过量的巯基乙 醇,能够除去与分离亚基共价连接的P汞苯甲酸基团。因此可以研究分开亚基的功能。 HN Cysteine SH 0 HO -Hydroxy C00 HOH 图10.4半胱氨酸残基的修怖。对羟基汞苯甲酸与天冬氨酸-氨基甲酰转移酶关键的半胱氨酸 反应
变构调节酶不遵循米氏动力学 除了酶受其它分子调节之外,变构酶促反应对底物浓度的应答也很有特征。图 10.3 是 ATCase 酶促反应速度对底物 Asp 浓度作图的结果。这个动力学曲线与米氏方程不同,形状 像“S”。很多变构酶促动力学曲线呈 S 型。血红蛋白的有能够结合曲线也是 S 型,亚基与 氧气的结合是正协同的,即蛋白分子中一个位点与氧气结合增加这个分子其它位点的氧气结 合性能。为了理解 ATCase 酶促反应动力学和 CTP 抑制酶活性的基础,我们需要考察 ATCase 结构。 图 10.3 ATCase 酶促反应动力学呈 S 曲线。天冬氨酸-氨基甲酰转移酶催化反应得产物形成 速度对底物 Asp 浓度作图呈 S 型曲线,表明一个活性位点结合底物能够增加这个酶蛋白分 子其它位点的活性。因此这个酶是正协同酶。 ATCase 含有独立的催化亚基和调节亚基 ATCase 的催化位点和调节位点是什么?用汞类物质如 p-羟基汞苯甲酸(只与巯基反应) 处理,能够将 ATCase 的催化亚基(c)与调节亚基(r)分开(图 10.4)。John Gerhart 和 Howard Schachman 超离心研究显示,汞处理将 ATCase 分成两种亚基(图 10.5)。由于这两种亚基的 电荷和大小不同,因此可以用离子交换层析(有电荷差异)或蔗糖密度梯度离心(有大小差 异)分离。用沉降系数表述两种亚基,它们的大小分别是 2.8S 和 5.8S。加入过量的巯基乙 醇,能够除去与分离亚基共价连接的 p-汞苯甲酸基团。因此可以研究分开亚基的功能。 图 10.4 半胱氨酸残基的修饰。对羟基汞苯甲酸与天冬氨酸-氨基甲酰转移酶关键的半胱氨酸 反应
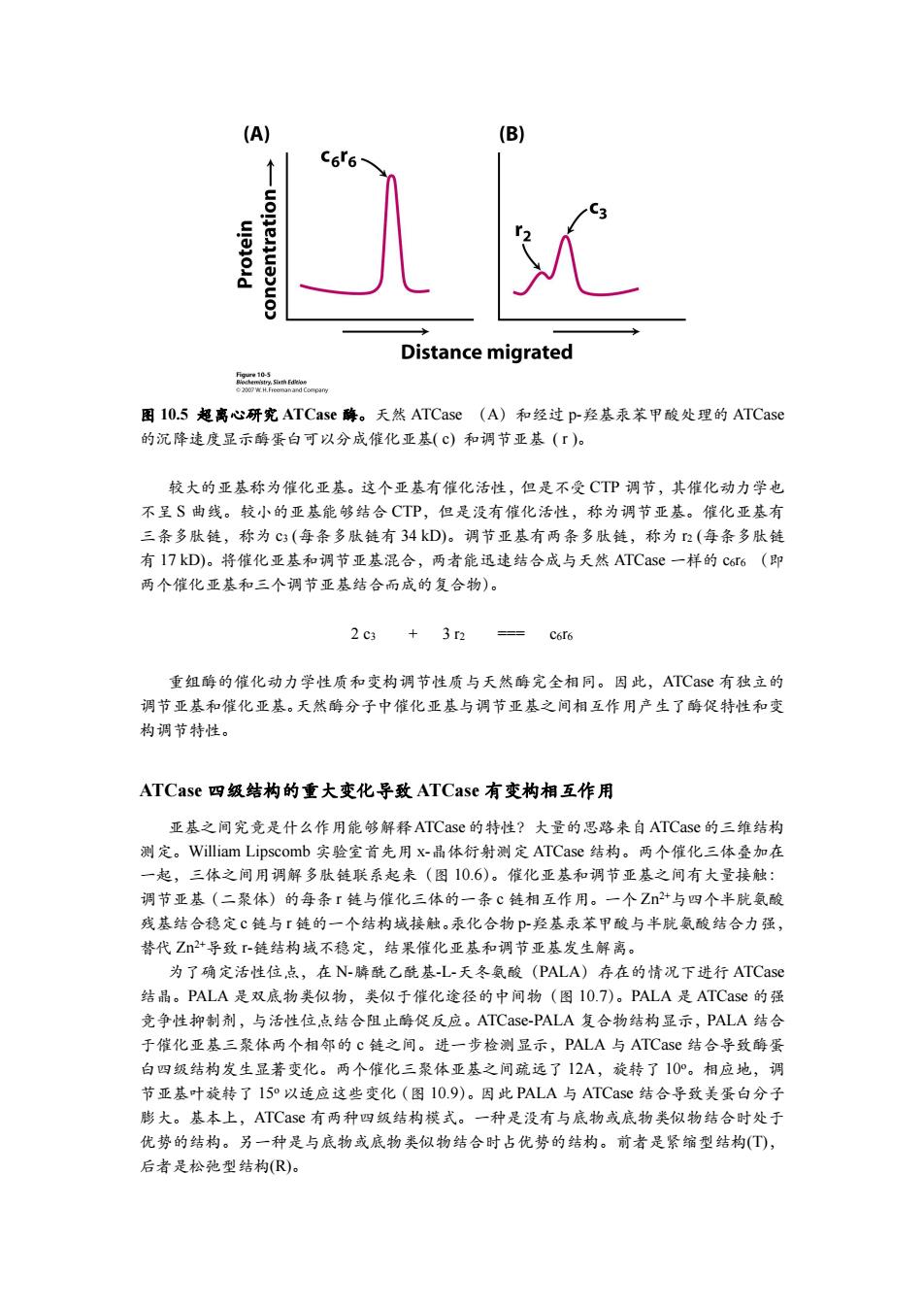
(A) (B) C66 Distance migrated 图10.5超离心研究ATCase酶。天然ATCase(A)和经过p-羟基汞苯甲酸处理的ATCase 的沉降速度显示酶蛋白可以分成催化亚基(c)和调节亚基(「)。 较大的亚基称为催化亚基。这个亚基有催化活性,但是不受CTP调节,其催化动力学也 不呈S曲线。较小的亚基能够结合CTP,但是没有催化活性,称为调节亚基。催化亚基有 三条多肽链,称为C3(每条多肽链有34kD)。调节亚基有两条多肽链,称为n(每条多肽链 有l7kD)。将催化亚基和调节亚基混合,两者能迅速结合成与天然ATCase一样的c6t6(即 两个催化亚基和三个调节亚基结合而成的复合物)。 2c3+3r2==c66 重组酶的催化动力学性质和变构调节性质与天然酶完全相同。因此,ATCase有独立的 调节亚基和催化亚基。天然酶分子中催化亚基与调节亚基之间相互作用产生了酶促特性和变 构调节特性。 ATCase四级结构的重大变化导致ATCase有变构相互作用 亚基之间究竟是什么作用能够解释ATCase的特性?大量的思路来自ATCase的三维结构 测定。William Lipscomb实验室首先用x-晶体衍射测定ATCase结构。两个催化三体叠加在 一起,三体之间用调解多肽链联系起来(图10.6)。催化亚基和调节亚基之间有大量接触: 调节亚基(二聚体)的每条r链与催化三体的一条℃链相互作用。一个Zn2+与四个半胱氨酸 残基结合稳定c链与「链的一个结构域接触。汞化合物P羟基汞苯甲酸与半胱氨酸结合力强, 替代Z+导致r-链结构域不稳定,结果催化亚基和调节亚基发生解离。 为了确定活性位点,在N-膦酰乙酰基-L-天冬氨酸(PALA)存在的情况下进行ATCase 结晶。PALA是双底物类似物,类似于催化途径的中间物(图10.7)。PALA是ATCase的强 竞争性抑制剂,与活性位点结合阻止酶促反应。ATCase-PALA复合物结构显示,PALA结合 于催化亚基三聚体两个相邻的c链之间。进一步检测显示,PALA与ATCase结合导致酶蛋 白四级结构发生显著变化。两个催化三聚体亚基之间疏远了12A,旋转了10°。相应地,调 节亚基叶旋转了I5°以适应这些变化(图I0.9)。因此PALA与ATCase结合导致美蛋白分子 膨大。基本上,ATCase有两种四级结构模式。一种是没有与底物或底物类似物结合时处于 优势的结构。另一种是与底物或底物类似物结合时占优势的结构。前者是紧缩型结构(T), 后者是松弛型结构(R)
图 10.5 超离心研究 ATCase 酶。天然 ATCase (A)和经过 p-羟基汞苯甲酸处理的 ATCase 的沉降速度显示酶蛋白可以分成催化亚基( c) 和调节亚基 ( r )。 较大的亚基称为催化亚基。这个亚基有催化活性,但是不受 CTP 调节,其催化动力学也 不呈 S 曲线。较小的亚基能够结合 CTP,但是没有催化活性,称为调节亚基。催化亚基有 三条多肽链,称为 c3 (每条多肽链有 34 kD)。调节亚基有两条多肽链,称为 r2 (每条多肽链 有 17 kD)。将催化亚基和调节亚基混合,两者能迅速结合成与天然 ATCase 一样的 c6r6 (即 两个催化亚基和三个调节亚基结合而成的复合物)。 2 c3 + 3 r2 === c6r6 重组酶的催化动力学性质和变构调节性质与天然酶完全相同。因此,ATCase 有独立的 调节亚基和催化亚基。天然酶分子中催化亚基与调节亚基之间相互作用产生了酶促特性和变 构调节特性。 ATCase 四级结构的重大变化导致 ATCase 有变构相互作用 亚基之间究竟是什么作用能够解释ATCase的特性?大量的思路来自ATCase的三维结构 测定。William Lipscomb 实验室首先用 x-晶体衍射测定 ATCase 结构。两个催化三体叠加在 一起,三体之间用调解多肽链联系起来(图 10.6)。催化亚基和调节亚基之间有大量接触: 调节亚基(二聚体)的每条 r 链与催化三体的一条 c 链相互作用。一个 Zn 2+与四个半胱氨酸 残基结合稳定 c 链与 r 链的一个结构域接触。汞化合物 p-羟基汞苯甲酸与半胱氨酸结合力强, 替代 Zn 2+导致 r-链结构域不稳定,结果催化亚基和调节亚基发生解离。 为了确定活性位点,在 N-膦酰乙酰基-L-天冬氨酸(PALA)存在的情况下进行 ATCase 结晶。PALA 是双底物类似物,类似于催化途径的中间物(图 10.7)。PALA 是 ATCase 的强 竞争性抑制剂,与活性位点结合阻止酶促反应。ATCase-PALA 复合物结构显示,PALA 结合 于催化亚基三聚体两个相邻的 c 链之间。进一步检测显示,PALA 与 ATCase 结合导致酶蛋 白四级结构发生显著变化。两个催化三聚体亚基之间疏远了 12A,旋转了 10 o。相应地,调 节亚基叶旋转了 15 o以适应这些变化(图 10.9)。因此 PALA 与 ATCase 结合导致美蛋白分子 膨大。基本上,ATCase 有两种四级结构模式。一种是没有与底物或底物类似物结合时处于 优势的结构。另一种是与底物或底物类似物结合时占优势的结构。前者是紧缩型结构(T), 后者是松弛型结构(R)

Zinc Regulatory (A) domain dimer Catalytic trimer r chain cchain (B) Catalytic trimer Regulatory dimer Regulator Side View dimer Regulatory dimer Catalytic trimer 的ee10 Sath Edrion 2007 W.H.Freeman and Compary 图10.6 ATCase结构。(A)从顶部观察天冬氨酸-氨基甲酰转移酶的四级结构。中间图仅仅 代表亚基之间的关系。只能看到一个催化三体(黄色)的℃链,另一个催化亚基(三体)被 遮住。一个r链经过Zn+离子与一个c链相互作用。(B)ATCase侧视图。 P032 P032- H2N NH2 Bound substrates Reaction intermediate PO3 N-(Phosphonacetyl)-L-aspartate (PALA) 2007 W.H.Freeman and Company 图10.7PALA,一种双底物类似物。(顶部)天冬氨酸的暗记亲和攻击氨基甲酰磷酸酯的羰 基碳原子,产生的化合物PALA类似ATCase酶促反应得中间物。这个物质是ATCase的强 竞争性抑制剂
图 10.6 ATCase 结构。(A)从顶部观察天冬氨酸-氨基甲酰转移酶的四级结构。中间图仅仅 代表亚基之间的关系。只能看到一个催化三体(黄色)的 c 链,另一个催化亚基(三体)被 遮住。一个 r 链经过 Zn 2+离子与一个 c 链相互作用。(B)ATCase 侧视图。 图 10.7 PALA,一种双底物类似物。(顶部)天冬氨酸的暗记亲和攻击氨基甲酰磷酸酯的羰 基碳原子,产生的化合物 PALA 类似 ATCase 酶促反应得中间物。这个物质是 ATCase 的强 竞争性抑制剂