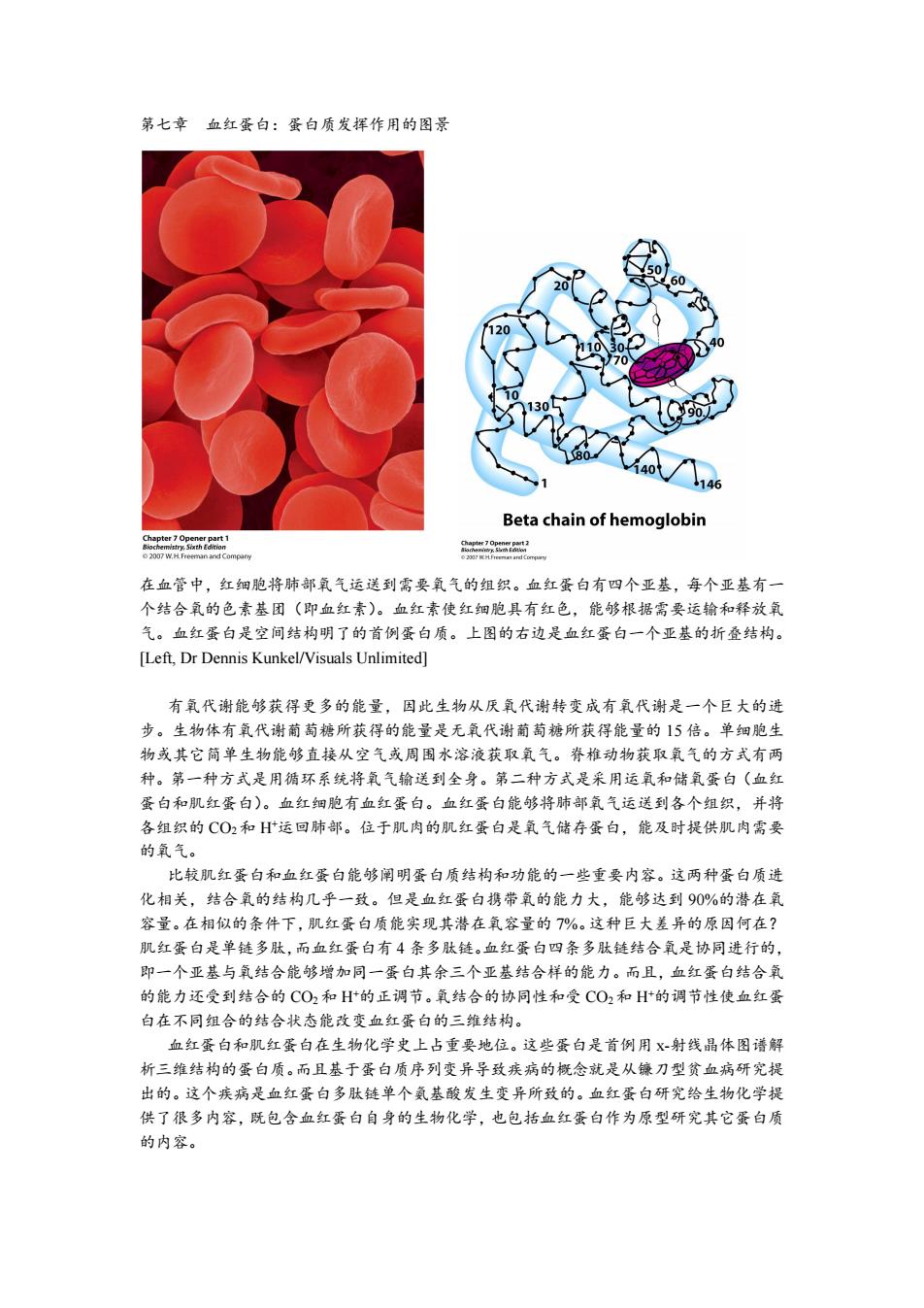
第七章血红蛋白:蛋白质发挥作用的图景 60 120 10 90 70 46 Beta chain of hemoglobin Chpt 2007 W.H Freeman and Company 在血管中,红细胞将肺部氧气运送到需要氧气的组织。血红蛋白有四个亚基,每个亚基有一 个结合氧的色素基团(即血红素)。血红素使红细胞具有红色,能够根据需要运输和释放氧 气。血红蛋白是空间结构明了的首例蛋白质。上图的右边是血红蛋白一个亚基的折叠结构。 [Left,Dr Dennis Kunkel/Visuals Unlimited] 有氧代谢能够获得更多的能量,因此生物从厌氧代谢转变成有氧代谢是一个巨大的进 步。生物体有氧代谢葡萄糖所获得的能量是无氧代谢葡萄糖所获得能量的15倍。单细胞生 物或其它简单生物能够直接从空气或周围水溶液获取氧气。脊椎动物获取氧气的方式有两 种。第一种方式是用循环系统将氧气输送到全身。第二种方式是采用运氧和储氧蛋白(血红 蛋白和肌红蛋白)。血红细胞有血红蛋白。血红蛋白能够将肺部氧气运送到各个组织,并将 各组织的CO2和H运回肺部。位于肌肉的肌红蛋白是氧气储存蛋白,能及时提供肌肉需要 的氧气。 比较肌红蛋白和血红蛋白能够阐明蛋白质结构和功能的一些重要内容。这两种蛋白质进 化相关,结合氧的结构几乎一致。但是血红蛋白携带氧的能力大,能够达到90%的潜在氧 容量。在相似的条件下,肌红蛋白质能实现其潜在氧容量的7%。这种巨大差异的原因何在? 肌红蛋白是单链多肽,而血红蛋白有4条多肽链。血红蛋白四条多肽链结合氧是协同进行的, 即一个亚基与氧结合能够增加同一蛋白其余三个亚基结合样的能力。而且,血红蛋白结合氧 的能力还受到结合的CO2和H的正调节。氧结合的协同性和受CO2和H的调节性使血红蛋 白在不同组合的结合状态能改变血红蛋白的三维结构。 血红蛋白和肌红蛋白在生物化学史上占重要地位。这些蛋白是首例用X射线晶体图谱解 析三维结构的蛋白质。而且基于蛋白质序列变异导致疾病的概念就是从镰刀型贫血病研究提 出的。这个疾病是血红蛋白多肽链单个氨基酸发生变异所致的。血红蛋白研究给生物化学提 供了很多内容,既包含血红蛋白自身的生物化学,也包括血红蛋白作为原型研究其它蛋白质 的内容
第七章 血红蛋白:蛋白质发挥作用的图景 在血管中,红细胞将肺部氧气运送到需要氧气的组织。血红蛋白有四个亚基,每个亚基有一 个结合氧的色素基团(即血红素)。血红素使红细胞具有红色,能够根据需要运输和释放氧 气。血红蛋白是空间结构明了的首例蛋白质。上图的右边是血红蛋白一个亚基的折叠结构。 [Left, Dr Dennis Kunkel/Visuals Unlimited] 有氧代谢能够获得更多的能量,因此生物从厌氧代谢转变成有氧代谢是一个巨大的进 步。生物体有氧代谢葡萄糖所获得的能量是无氧代谢葡萄糖所获得能量的 15 倍。单细胞生 物或其它简单生物能够直接从空气或周围水溶液获取氧气。脊椎动物获取氧气的方式有两 种。第一种方式是用循环系统将氧气输送到全身。第二种方式是采用运氧和储氧蛋白(血红 蛋白和肌红蛋白)。血红细胞有血红蛋白。血红蛋白能够将肺部氧气运送到各个组织,并将 各组织的 CO2和 H+运回肺部。位于肌肉的肌红蛋白是氧气储存蛋白,能及时提供肌肉需要 的氧气。 比较肌红蛋白和血红蛋白能够阐明蛋白质结构和功能的一些重要内容。这两种蛋白质进 化相关,结合氧的结构几乎一致。但是血红蛋白携带氧的能力大,能够达到 90%的潜在氧 容量。在相似的条件下,肌红蛋白质能实现其潜在氧容量的 7%。这种巨大差异的原因何在? 肌红蛋白是单链多肽,而血红蛋白有 4 条多肽链。血红蛋白四条多肽链结合氧是协同进行的, 即一个亚基与氧结合能够增加同一蛋白其余三个亚基结合样的能力。而且,血红蛋白结合氧 的能力还受到结合的 CO2和 H+的正调节。氧结合的协同性和受 CO2和 H+的调节性使血红蛋 白在不同组合的结合状态能改变血红蛋白的三维结构。 血红蛋白和肌红蛋白在生物化学史上占重要地位。这些蛋白是首例用 x-射线晶体图谱解 析三维结构的蛋白质。而且基于蛋白质序列变异导致疾病的概念就是从镰刀型贫血病研究提 出的。这个疾病是血红蛋白多肽链单个氨基酸发生变异所致的。血红蛋白研究给生物化学提 供了很多内容,既包含血红蛋白自身的生物化学,也包括血红蛋白作为原型研究其它蛋白质 的内容

7.1肌红蛋白和血红蛋白将氧结合于血红素的铁原子上 测定三维结构的第一个蛋白质是鲸鱼的肌红蛋白。l950年代,John Kendrew在X-射线 晶体学研究阐明了该蛋白质的结构(图71)。肌红蛋白的-螺旋多,螺旋间用拐弯连接形 成球状结构。 Myoglobin a 图71肌红蛋白结构。肌红蛋白是一条多肽链,形成的α-螺旋用拐弯连接,有一个氧结合 位点。 肌红蛋白有氧结合状态(称为氧合肌红蛋白,oxymyoglobin)或无氧状态(称为去氧肌红 蛋白,deoxymyoglobin)。与血红蛋白一样,肌红蛋白结合氧的能力依赖于血红素辅基。血 红素辅基使血液和肌肉显示特有的红色。血红素是有机分子,中央是铁原子。这个有机分子 叫原卜啉,四个卜啉环之间用次甲基连接起来形成四卜啉环。卜啉环上连有四个甲基、两个 乙烯基、和两个丙酸基团。 00 Propionate side chain HaC CH3 Pyrrole ring H Methyl group -CH3 H2C Vinyl group CH3 Heme (Fe-protoporphyrin IX) 铁原子处于原卜啉的中央。铁原子与四个卜琳环的氨原子结合。正常状态下,铁原子处 于氧化状态F+。在血红素平面的两侧,铁离子还能形成另外两个化学键。这两个结合位点 称为第五和第六配位位点。肌红蛋白中,第五配位位点被蛋白质组氨酸的咪唑环占居。这个 组氦酸称为近位组氨酸(proximal histidine)。脱氧肌红蛋白第六配位点空余,可以结合氧。 铁离子处于卜啉环平面外0.4A处(此时的铁离子比卜啉环中央孔大,无法嵌入中央孔)(图 72,左边)
7.1 肌红蛋白和血红蛋白将氧结合于血红素的铁原子上 测定三维结构的第一个蛋白质是鲸鱼的肌红蛋白。1950 年代,John Kendrew 在 x-射线 晶体学研究阐明了该蛋白质的结构(图 7.1)。肌红蛋白的螺旋多,螺旋间用拐弯连接形 成球状结构。 图 7.1 肌红蛋白结构。肌红蛋白是一条多肽链,形成的螺旋用拐弯连接,有一个氧结合 位点。 肌红蛋白有氧结合状态(称为氧合肌红蛋白,oxymyoglobin)或无氧状态(称为去氧肌红 蛋白,deoxymyoglobin)。与血红蛋白一样,肌红蛋白结合氧的能力依赖于血红素辅基。血 红素辅基使血液和肌肉显示特有的红色。血红素是有机分子,中央是铁原子。这个有机分子 叫原卜啉,四个卜啉环之间用次甲基连接起来形成四卜啉环。卜啉环上连有四个甲基、两个 乙烯基、和两个丙酸基团。 铁原子处于原卜啉的中央。铁原子与四个卜啉环的氮原子结合。正常状态下,铁原子处 于氧化状态 Fe 2+。在血红素平面的两侧,铁离子还能形成另外两个化学键。这两个结合位点 称为第五和第六配位位点。肌红蛋白中,第五配位位点被蛋白质组氨酸的咪唑环占居。这个 组氨酸称为近位组氨酸(proximal histidine)。脱氧肌红蛋白第六配位点空余,可以结合氧。 铁离子处于卜啉环平面外 0.4A 处(此时的铁离子比卜啉环中央孔大,无法嵌入中央孔)(图 7.2,左边)

0.4A Porphyrin 02 His In oxyhemoglobin In deoxyhemoglobin Figure 7-2 y.Sixth Edion 2007 W.H Freeman and Company 图72氧结合改变铁离子位置。在脱氧状态铁离子处于卜啉环平面的外部(左边)。当铁离 子与氧结合,铁离子就移入血红素平面的中夹(右边)。 氧分子与铁离子第六配位点的结合导致铁的电子云发生重排,铁离子比原来的直径小得 多,因此铁离子就被移入卜啉环平面中央孔内(图72,右边)。铁离子电子结构的改变伴随 着磁性的改变,成为功能性磁共振成像(fMRI)的基础。fMRI是脑功能检测的有效手段(32.1 节)。1936年Linus Pauling基于磁性测量就预测出氧结合导致结构改变,比肌红蛋白和血红 蛋白三维结构阐明时间早25年。 肌红蛋白结构阻止活性氧释放 肌红蛋白结构阻上活性氧释放 氧与血红素内铁离子的结合使铁离子的电子向氧偏移。三价铁离子(F3+)与超氧阴离子 (O2)形成的复合物(图7.3)能很好解释其结构。离去氧是氧气,而不是超氧离子。首 先释放超氧离子是能够破坏很多生命物质的活性氧。其次,释放超氧离子使铁离子处于三价 状态,即正铁肌红蛋白(metmyoglobin),不能重新结合氧。因此丧失了储氧功能。肌红蛋 白的这些特征使之不大可能释放超氧负离子。尤其是结合口袋还有一个远端组氨酸(distal histidine)供应氢键供体与氧形成氢键(图7.4)。结合氧的超氧特性强化了这种相互作用。 因此肌红蛋白的蛋白质部分控制血红素活性,使之更适于与氧可逆性结合。 Superoxide ion Fe2+ Fe3+ eSth uio 2007W.HFreerran and Compary 图7.3铁-氧结合。血红蛋白铁与氧的相互作用可以看作Fe2+与氧气结合和F+与超氧负离 子结合的共振结构
图 7.2 氧结合改变铁离子位置。在脱氧状态铁离子处于卜啉环平面的外部(左边)。当铁离 子与氧结合,铁离子就移入血红素平面的中央(右边)。 氧分子与铁离子第六配位点的结合导致铁的电子云发生重排,铁离子比原来的直径小得 多,因此铁离子就被移入卜啉环平面中央孔内(图 7.2,右边)。铁离子电子结构的改变伴随 着磁性的改变,成为功能性磁共振成像(fMRI)的基础。fMRI 是脑功能检测的有效手段(32.1 节)。1936 年 Linus Pauling 基于磁性测量就预测出氧结合导致结构改变,比肌红蛋白和血红 蛋白三维结构阐明时间早 25 年。 肌红蛋白结构阻止活性氧释放 肌红蛋白结构阻止活性氧释放 氧与血红素内铁离子的结合使铁离子的电子向氧偏移。三价铁离子(Fe 3+)与超氧阴离子 (O2-)形成的复合物(图 7.3)能很好解释其结构。离去氧是氧气,而不是超氧离子。首 先释放超氧离子是能够破坏很多生命物质的活性氧。其次,释放超氧离子使铁离子处于三价 状态,即正铁肌红蛋白(metmyoglobin),不能重新结合氧。因此丧失了储氧功能。肌红蛋 白的这些特征使之不大可能释放超氧负离子。尤其是结合口袋还有一个远端组氨酸(distal histidine)供应氢键供体与氧形成氢键(图 7.4)。结合氧的超氧特性强化了这种相互作用。 因此肌红蛋白的蛋白质部分控制血红素活性,使之更适于与氧可逆性结合。 图 7.3 铁-氧结合。血红蛋白铁与氧的相互作用可以看作 Fe 2+与氧气结合和 Fe 3+与超氧负离 子结合的共振结构
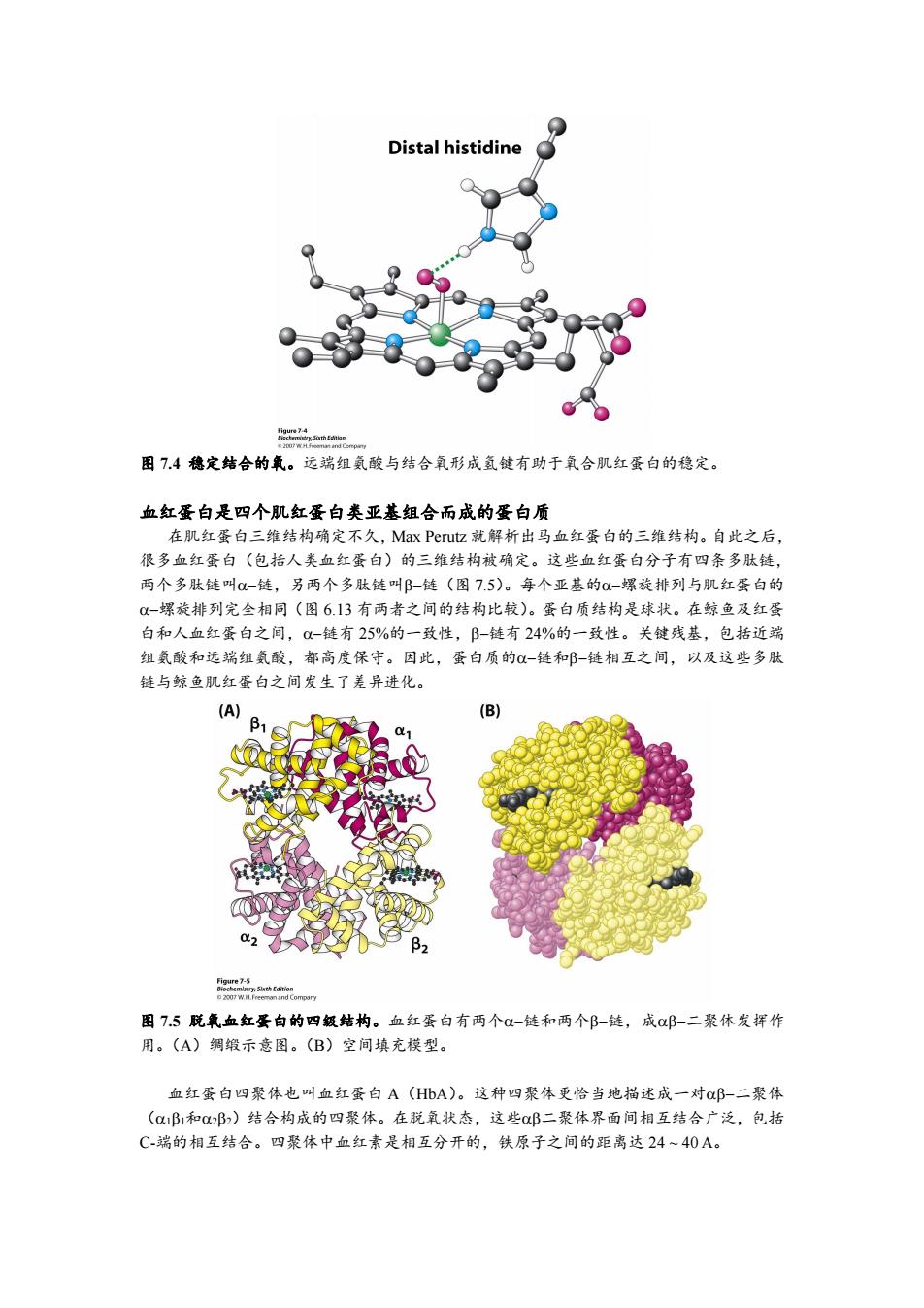
Distal histidine 图7.4稳定结合的氧。远端组氨酸与结合氧形成氢键有助于氧合肌红蛋白的稳定。 血红蛋白是四个肌红蛋白类亚基组合而成的蛋白质 在肌红蛋白三维结构确定不久,Max Perut忆就解析出马血红蛋白的三维结构。自此之后, 很多血红蛋白(包括人类血红蛋白)的三维结构被确定。这些血红蛋白分子有四条多肽链, 两个多肽链叫-链,另两个多肽链叫B-链(图7.5)。每个亚基的-螺旋排列与肌红蛋白的 0-螺旋排列完全相同(图6.13有两者之间的结构比较)。蛋白质结构是球状。在鲸鱼及红蛋 白和人血红蛋白之间,1-链有25%的一致性,B-链有24%的一致性。关键残基,包括近端 组氨酸和远端组氨酸,都高度保守。因此,蛋白质的-链和B-链相互之间,以及这些多肽 链与鲸鱼肌红蛋白之间发生了差异进化。 (A) (B) (2 β2 图7.5脱氧血红蛋白的四级结构。血红蛋白有两个-链和两个B-链,成0邱-二聚体发挥作 用。(A)绸缎示意图。(B)空间填充模型。 血红蛋白四聚体也叫血红蛋白A(HbA)。这种四聚体更恰当地描述成一对邱-二聚体 (a1B1和Q2邱2)结合构成的四聚体。在脱氧状态,这些a邱二聚体界面间相互结合广泛,包括 C-端的相互结合。四聚体中血红素是相互分开的,铁原子之间的距离达24~40A
图 7.4 稳定结合的氧。远端组氨酸与结合氧形成氢键有助于氧合肌红蛋白的稳定。 血红蛋白是四个肌红蛋白类亚基组合而成的蛋白质 在肌红蛋白三维结构确定不久,Max Perutz 就解析出马血红蛋白的三维结构。自此之后, 很多血红蛋白(包括人类血红蛋白)的三维结构被确定。这些血红蛋白分子有四条多肽链, 两个多肽链叫链,另两个多肽链叫链(图 7.5)。每个亚基的螺旋排列与肌红蛋白的 螺旋排列完全相同(图 6.13 有两者之间的结构比较)。蛋白质结构是球状。在鲸鱼及红蛋 白和人血红蛋白之间,链有 25%的一致性,链有 24%的一致性。关键残基,包括近端 组氨酸和远端组氨酸,都高度保守。因此,蛋白质的链和链相互之间,以及这些多肽 链与鲸鱼肌红蛋白之间发生了差异进化。 图 7.5 脱氧血红蛋白的四级结构。血红蛋白有两个链和两个链,成二聚体发挥作 用。(A)绸缎示意图。(B)空间填充模型。 血红蛋白四聚体也叫血红蛋白 A(HbA)。这种四聚体更恰当地描述成一对二聚体 (和)结合构成的四聚体。在脱氧状态,这些二聚体界面间相互结合广泛,包括 C-端的相互结合。四聚体中血红素是相互分开的,铁原子之间的距离达 24 ~ 40 A
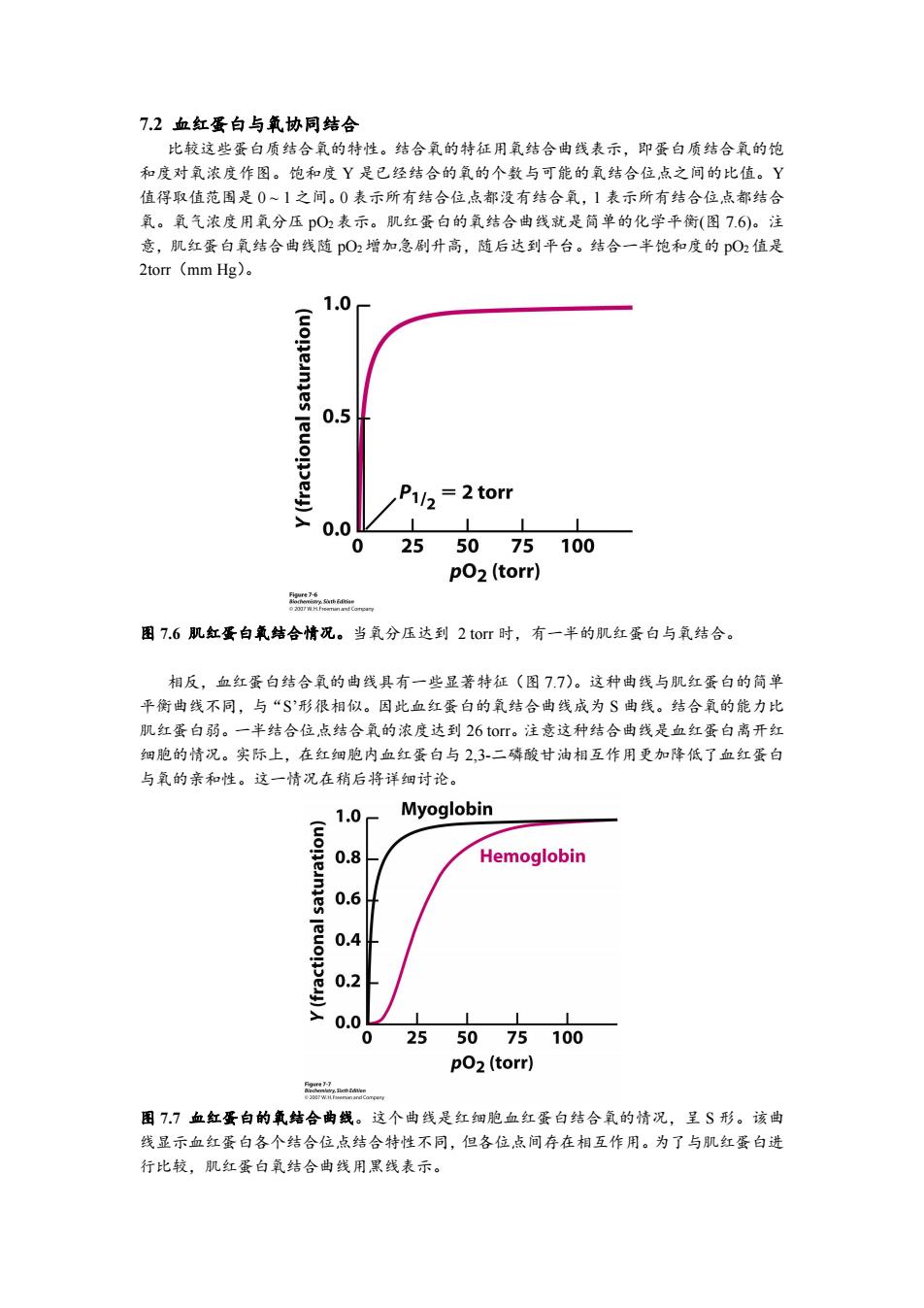
72血红蛋白与氧协同结合 比较这些蛋白质结合氧的特性。结合氧的特征用氧结合曲线表示,即蛋白质结合氧的饱 和度对氧浓度作图。饱和度Y是已经结合的氧的个数与可能的氧结合位点之间的比值。Y 值得取值范围是0~1之间。0表示所有结合位点都没有结合氧,1表示所有结合位点都结合 氧。氧气浓度用氧分压pO2表示。肌红蛋白的氧结合曲线就是简单的化学平衡(图7.6)。注 意,肌红蛋白氧结合曲线随pO2增加急剧升高,随后达到平台。结合一半饱和度的O2值是 2tor(mmHg)。 1.0 (uoneanies 0.5 P1/2=2torr 0.0 0 25 50 75 100 pO2(torr) 图7.6肌红蛋白氧结合情况。当氧分压达到2tor时,有一半的肌红蛋白与氧结合。 相反,血红蛋白结合氧的曲线具有一些显著特征(图77)。这种曲线与肌红蛋白的简单 平衡曲线不同,与“S'形很相似。因此血红蛋白的氧结合曲线成为S曲线。结合氧的能力比 肌红蛋白弱。一半结合位,点结合氧的浓度达到26tor。注意这种结合曲线是血红蛋白离开红 细胞的情况。实际上,在红细胞内血红蛋白与2,3-二磷酸甘油相互作用更加降低了血红蛋白 与氧的亲和性。这一情况在稍后将详细讨论。 1.0 Myoglobin 0.8 Hemoglobin 0.6 0.4 0.2 0.0 0255075100 pO2(torr) n 图77血红蛋白的氧结合曲线。这个曲线是红细胞血红蛋白结合氧的情况,呈S形。该曲 线显示血红蛋白各个结合位点结合特性不同,但各位,点间存在相互作用。为了与肌红蛋白进 行比较,肌红蛋白氧结合曲线用黑线表示
7.2 血红蛋白与氧协同结合 比较这些蛋白质结合氧的特性。结合氧的特征用氧结合曲线表示,即蛋白质结合氧的饱 和度对氧浓度作图。饱和度 Y 是已经结合的氧的个数与可能的氧结合位点之间的比值。Y 值得取值范围是 0 ~ 1 之间。0 表示所有结合位点都没有结合氧,1 表示所有结合位点都结合 氧。氧气浓度用氧分压 pO2 表示。肌红蛋白的氧结合曲线就是简单的化学平衡(图 7.6)。注 意,肌红蛋白氧结合曲线随 pO2增加急剧升高,随后达到平台。结合一半饱和度的 pO2值是 2torr(mm Hg)。 图 7.6 肌红蛋白氧结合情况。当氧分压达到 2 torr 时,有一半的肌红蛋白与氧结合。 相反,血红蛋白结合氧的曲线具有一些显著特征(图 7.7)。这种曲线与肌红蛋白的简单 平衡曲线不同,与“S’形很相似。因此血红蛋白的氧结合曲线成为 S 曲线。结合氧的能力比 肌红蛋白弱。一半结合位点结合氧的浓度达到 26 torr。注意这种结合曲线是血红蛋白离开红 细胞的情况。实际上,在红细胞内血红蛋白与 2,3-二磷酸甘油相互作用更加降低了血红蛋白 与氧的亲和性。这一情况在稍后将详细讨论。 图 7.7 血红蛋白的氧结合曲线。这个曲线是红细胞血红蛋白结合氧的情况,呈 S 形。该曲 线显示血红蛋白各个结合位点结合特性不同,但各位点间存在相互作用。为了与肌红蛋白进 行比较,肌红蛋白氧结合曲线用黑线表示