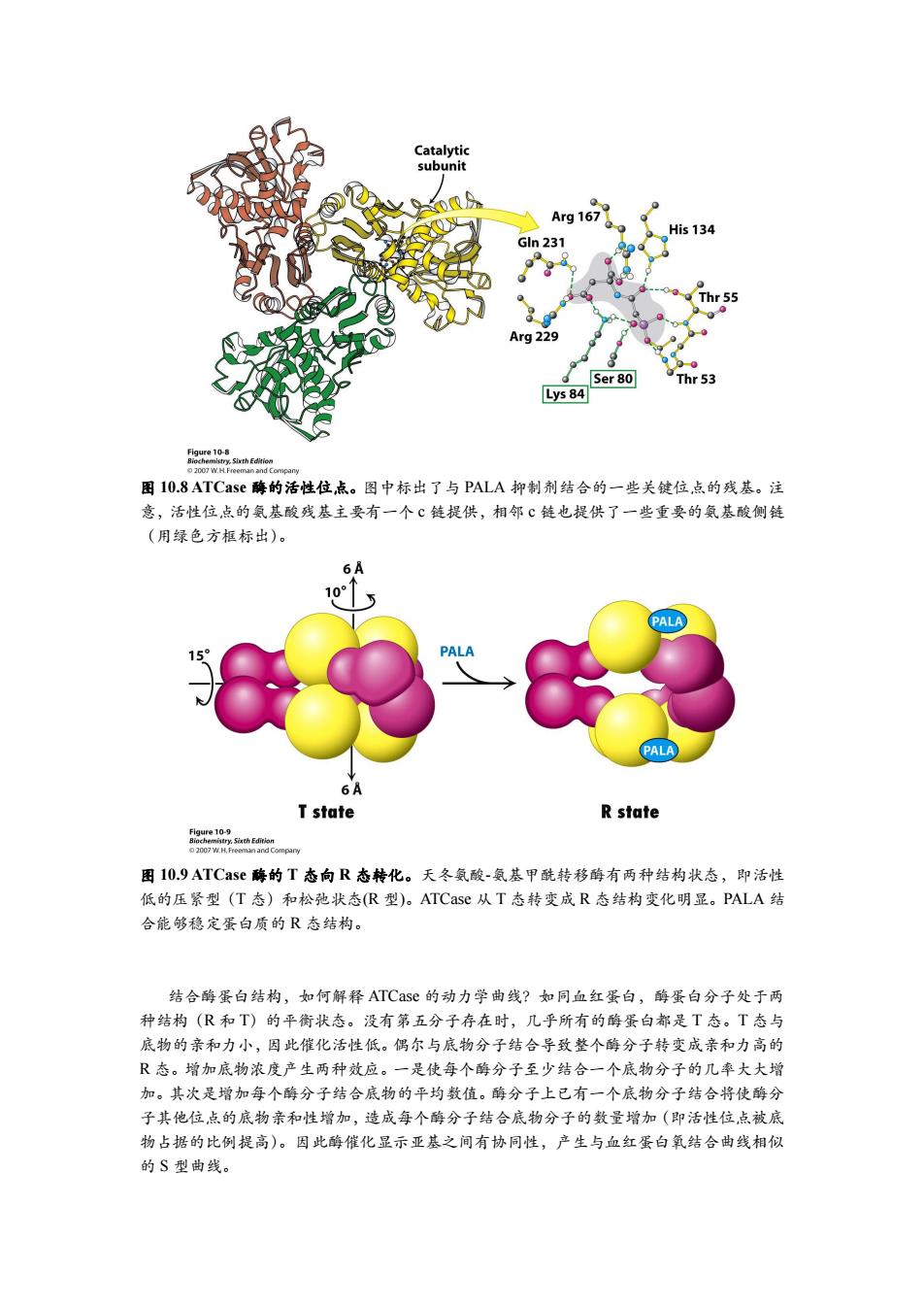
Catalytic subunit 2 Arg 167 His 134 Gln 231 Thr 55 Arg 229 Ser 80 Thr 53 Lys 84 Figure 10-8 图10.8 ATCase酶的活性位,点。图中标出了与PALA抑制剂结合的一些关键位,点的残基。注 意,活性位点的氨基酸残基主要有一个℃链提供,相邻℃链也提供了一些重要的氨基酸侧链 (用绿色方框标出)。 6A 10 PALA PALA PALA 6A T state R state fge102sahfhaon 2007 W.H.Freeman and Company 图10.9 ATCase酶的T态向R态转化。天冬氨酸-氨基甲酰转移酶有两种结构状态,即活性 低的压紧型(T态)和松弛状态(R型)。ATCase从T态转变成R态结构变化明显。PALA结 合能够稳定蛋白质的R态结构。 结合酶蛋白结构,如何解释ATCase的动力学曲线?如同血红蛋白,酶蛋白分子处于两 种结构(R和T)的平衡状态。没有第五分子存在时,几乎所有的酶蛋白都是T态。T态与 底物的亲和力小,因此催化活性低。偶尔与底物分子结合导致整个酶分子转变成亲和力高的 R态。增加底物浓度产生两种效应。一是使每个酶分子至少结合一个底物分子的几率大大增 加。其次是增加每个酶分子结合底物的平均数值。酶分子上已有一个底物分子结合将使酶分 子其他位点的底物亲和性增加,造成每个酶分子结合底物分子的数量增加(即活性位点被底 物占据的比例提高)。因此酶催化显示亚基之间有协同性,产生与血红蛋白氧结合曲线相似 的S型曲线
图 10.8 ATCase 酶的活性位点。图中标出了与 PALA 抑制剂结合的一些关键位点的残基。注 意,活性位点的氨基酸残基主要有一个 c 链提供,相邻 c 链也提供了一些重要的氨基酸侧链 (用绿色方框标出)。 图 10.9 ATCase 酶的 T 态向 R 态转化。天冬氨酸-氨基甲酰转移酶有两种结构状态,即活性 低的压紧型(T 态)和松弛状态(R 型)。ATCase 从 T 态转变成 R 态结构变化明显。PALA 结 合能够稳定蛋白质的 R 态结构。 结合酶蛋白结构,如何解释 ATCase 的动力学曲线?如同血红蛋白,酶蛋白分子处于两 种结构(R 和 T)的平衡状态。没有第五分子存在时,几乎所有的酶蛋白都是 T 态。T 态与 底物的亲和力小,因此催化活性低。偶尔与底物分子结合导致整个酶分子转变成亲和力高的 R 态。增加底物浓度产生两种效应。一是使每个酶分子至少结合一个底物分子的几率大大增 加。其次是增加每个酶分子结合底物的平均数值。酶分子上已有一个底物分子结合将使酶分 子其他位点的底物亲和性增加,造成每个酶分子结合底物分子的数量增加(即活性位点被底 物占据的比例提高)。因此酶催化显示亚基之间有协同性,产生与血红蛋白氧结合曲线相似 的 S 型曲线

变构酶的这种调节机制称为协同机制,因为酶蛋白分子显示“全部”或“全无”两种状 态。酶蛋白从T转化成R影响所有的活性位点。对酶分子所有催化位点的影响是等同的。 相反,序变模型假定底物分子与酶蛋白结合仅增加相邻位,点活性,而不会导致所有位,点都发 生T向R的转化。尽管协同机制能很好地解释ATCase酶促动力学,但是其他变构酶的动力 学需要将两种机制结合起来解释。 ATCase的S型曲线可以看作是两种米氏酶(一种是T态酶,另一种是R态酶)酶促反应 的叠加。底物浓度的增加有助于酶促反应从T态曲线转化成R态曲线(图I010)。注意这 种S型动力学曲线有另一个结果,当底物浓度达到T向R转化时,增加底物浓度使酶促反 应速度急剧上升。酶分子从活性低转变成活性高的底物浓度区间很窄。如果细微的浓度变化 就需要应答的话,这种酶促行为就非常有用。底物对变构酶的这种效应叫同促效应 (homotropic effects). R-state curve 6 T-state curve [Aspartate]→ 图10.10S型曲线的基础。将变构酶想象成两种米氏酶的混合物,一种酶Km低(相当于 R态结构),一种酶Km高(相当于T态结构)。随着底物浓度的增加,平衡从T向R移动, 导致反应速度虽底物浓度增加急剧增高。 在研究分离的催化三聚体过程中,酶促反应行为是米氏曲线,与推测的ATCase R态的 米氏曲线几乎没有区别(图l0.l0)。因此,tense这个此是合适的。在T态,调节亚基将两 个催化亚基(即两个催化三聚体)紧紧抓在一块导致催化亚基表面的环发生碰撞,千扰蛋白 质调整构型使之适宜于与底物高亲和性结合和催化。 别构调节剂调节TR之间的平衡 现在来看看CTP的抑制机制。前面说过,CTP能够抑制ATCase活性。在CTP存在时 进行ATCase结晶,结构显示,(I)与CTP结合的酶蛋白是T态;(2)调节链与CTP结合 的位点并没有与催化链作用(图10.11)。每个活性位点距离最近的CTP结合位点又50A。 这就出现这样的问题,它不与催化亚基相互作用,如何抑制酶的催化活性?
变构酶的这种调节机制称为协同机制,因为酶蛋白分子显示“全部”或“全无”两种状 态。酶蛋白从 T 转化成 R 影响所有的活性位点。对酶分子所有催化位点的影响是等同的。 相反,序变模型假定底物分子与酶蛋白结合仅增加相邻位点活性,而不会导致所有位点都发 生 T 向 R 的转化。尽管协同机制能很好地解释 ATCase 酶促动力学,但是其他变构酶的动力 学需要将两种机制结合起来解释。 ATCase 的 S 型曲线可以看作是两种米氏酶(一种是 T 态酶,另一种是 R 态酶)酶促反应 的叠加。底物浓度的增加有助于酶促反应从 T 态曲线转化成 R 态曲线(图 10.10)。注意这 种 S 型动力学曲线有另一个结果,当底物浓度达到 T 向 R 转化时,增加底物浓度使酶促反 应速度急剧上升。酶分子从活性低转变成活性高的底物浓度区间很窄。如果细微的浓度变化 就需要应答的话,这种酶促行为就非常有用。底物对变构酶的这种效应叫同促效应 (homotropic effects)。 图 10.10 S 型曲线的基础。将变构酶想象成两种米氏酶的混合物,一种酶 Km 低(相当于 R 态结构),一种酶 Km 高(相当于 T 态结构)。随着底物浓度的增加,平衡从 T 向 R 移动, 导致反应速度虽底物浓度增加急剧增高。 在研究分离的催化三聚体过程中,酶促反应行为是米氏曲线,与推测的 ATCase R 态的 米氏曲线几乎没有区别(图 10.10)。因此,tense 这个此是合适的。在 T 态,调节亚基将两 个催化亚基(即两个催化三聚体)紧紧抓在一块导致催化亚基表面的环发生碰撞,干扰蛋白 质调整构型使之适宜于与底物高亲和性结合和催化。 别构调节剂调节 T-R 之间的平衡 现在来看看 CTP 的抑制机制。前面说过,CTP 能够抑制 ATCase 活性。在 CTP 存在时 进行 ATCase 结晶,结构显示,(1)与 CTP 结合的酶蛋白是 T 态;(2)调节链与 CTP 结合 的位点并没有与催化链作用(图 10.11)。每个活性位点距离最近的 CTP 结合位点又 50A。 这就出现这样的问题,它不与催化亚基相互作用,如何抑制酶的催化活性?
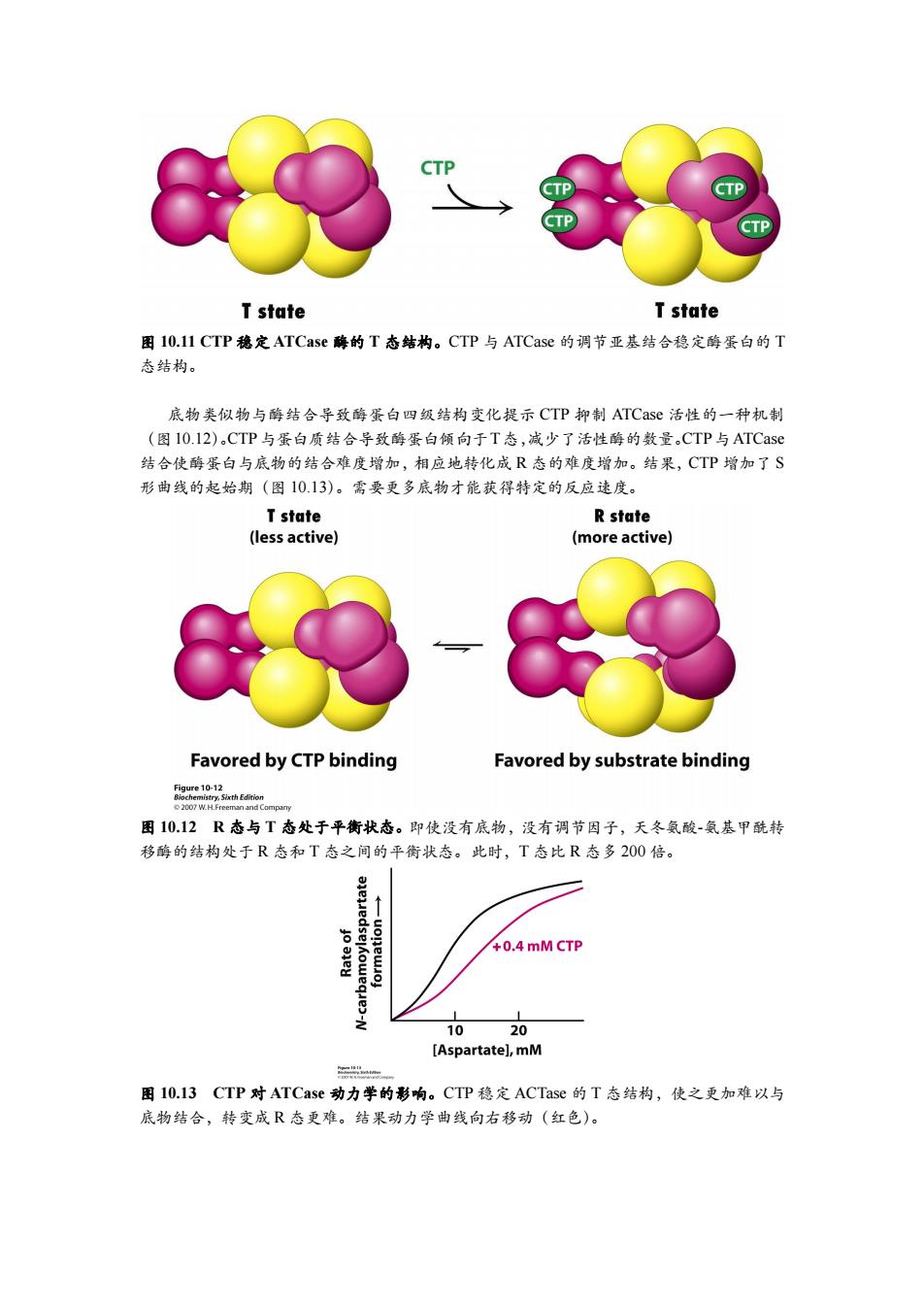
CTP CTP T state T state 图I0.11CTP稳定ATCase酶的T态结构。CTP与ATCase的调节亚基结合稳定酶蛋白的T 态结构。 底物类似物与酶结合导致酶蛋白四级结构变化提示CTP抑制ATCase活性的一种机制 (图10.12).CTP与蛋白质结合导致酶蛋白倾向于T态,减少了活性酶的数量CTP与ATCase 结合使酶蛋白与底物的结合难度增加,相应地转化成R态的难度增加。结果,CTP增加了S 形曲线的起始期(图10.13)。需要更多底物才能获得特定的反应速度。 T state R state (less active) (more active) Favored by CTP binding Favored by substrate binding fge10nhn 2007 W.H.Freeman and Company 图1012R态与T态处于平衡状态。即使没有底物,没有调节因子,天冬氨酸-氨基甲酰转 移酶的结构处于R态和T态之间的平衡状态。此时,T态比R态多200倍。 6 +0.4 mM CTP 1020 [Aspartate],mM 图10.l3CTP对ATCase动力学的彩响。CTP稳定ACTase的T态结构,使之更加难以与 底物结合,转变成R态更难。结果动力学曲线向右移动(红色)
图 10.11 CTP 稳定 ATCase 酶的 T 态结构。CTP 与 ATCase 的调节亚基结合稳定酶蛋白的 T 态结构。 底物类似物与酶结合导致酶蛋白四级结构变化提示 CTP 抑制 ATCase 活性的一种机制 (图10.12)。CTP与蛋白质结合导致酶蛋白倾向于T态,减少了活性酶的数量。CTP与ATCase 结合使酶蛋白与底物的结合难度增加,相应地转化成 R 态的难度增加。结果,CTP 增加了 S 形曲线的起始期(图 10.13)。需要更多底物才能获得特定的反应速度。 图 10.12 R 态与 T 态处于平衡状态。即使没有底物,没有调节因子,天冬氨酸-氨基甲酰转 移酶的结构处于 R 态和 T 态之间的平衡状态。此时,T 态比 R 态多 200 倍。 图 10.13 CTP 对 ATCase 动力学的影响。CTP 稳定 ACTase 的 T 态结构,使之更加难以与 底物结合,转变成 R 态更难。结果动力学曲线向右移动(红色)
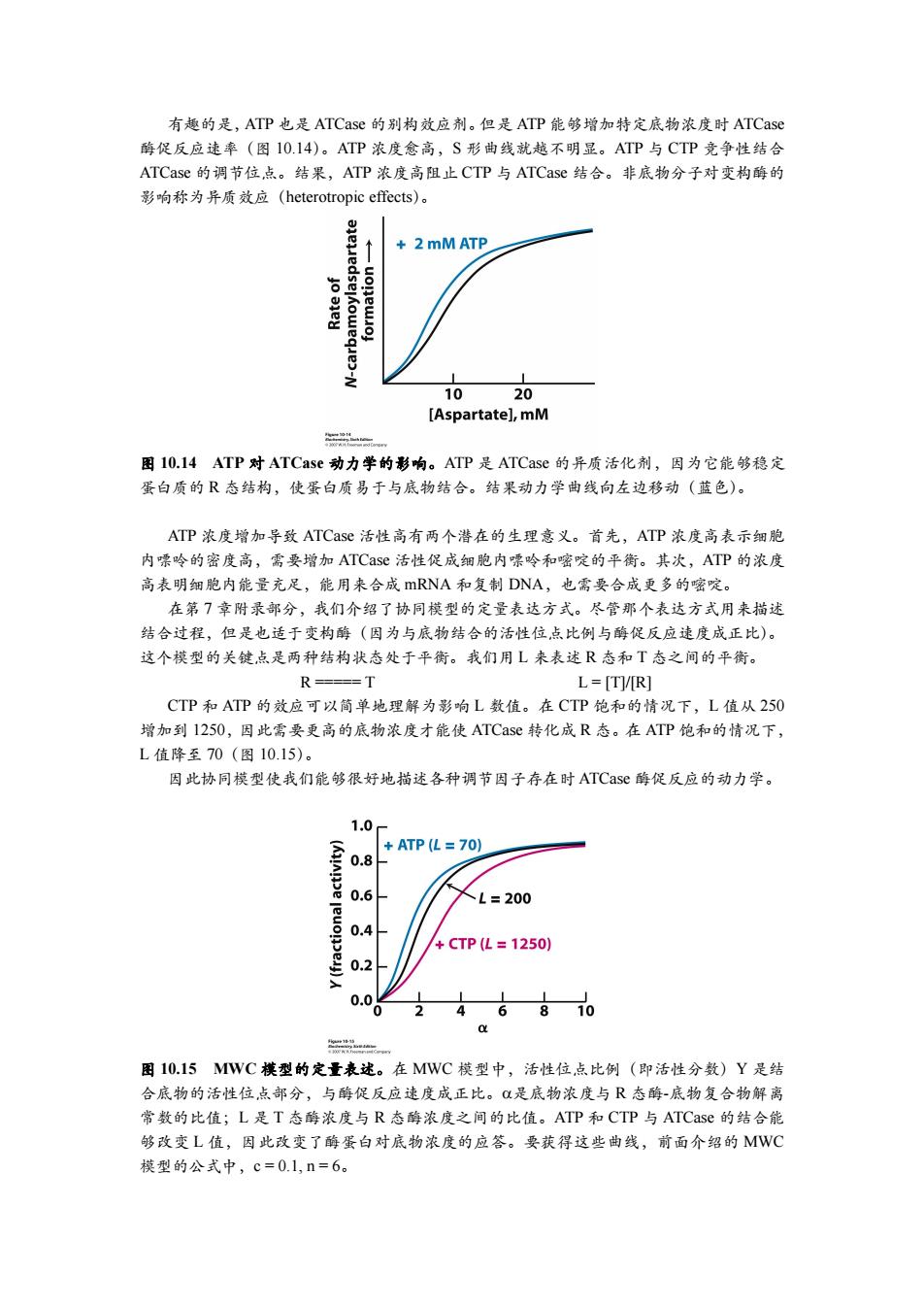
有趣的是,ATP也是ATCase的别构效应剂。但是ATP能够增加特定底物浓度时ATCase 酶促反应速率(图10.14)。ATP浓度愈高,S形曲线就越不明显。ATP与CTP竞争性结合 ATCase的调节位,点。结果,ATP浓度高阻止CTP与ATCase结合。非底物分子对变构酶的 影响称为异质效应(heterotropic effects)。 2mM ATP 6 1020 [Aspartate],mM n 图10.14ATP对ATCase动力学的影响。ATP是ATCase的异质活化剂,因为它能够稳定 蛋白质的R态结构,使蛋白质易于与底物结合。结果动力学曲线向左边移动(蓝色)。 ATP浓度增加导致ATCase活性高有两个潜在的生理意义。首先,ATP浓度高表示细胞 内嘌呤的密度高,需要增加ATCase活性促成细胞内嘌吟和嘧啶的平衡。其次,ATP的浓度 高表明细胞内能量充足,能用来合成mRNA和复制DNA,也需要合成更多的嘧啶。 在第7章附录部分,我们介绍了协同模型的定量表达方式。尽管那个表达方式用来描述 结合过程,但是也适于变构酶(因为与底物结合的活性位点比例与酶促反应速度成正比)。 这个模型的关键点是两种结构状态处于平衡。我们用L来表述R态和T态之间的平衡。 R===T L=[TVR] CTP和ATP的效应可以简单地理解为影响L数值。在CTP饱和的情况下,L值从250 增加到1250,因此需要更高的底物浓度才能使ATCase转化成R态。在ATP饱和的情况下, L值降至70(图10.15)。 因此协同模型使我们能够很好地描述各种调节因子存在时ATCase酶促反应的动力学。 1.0 +ATP(L=70) (AAe 0.8 0.6 L=200 0.4 +CTP(L=1250) 0.2 0.0 46810 n 图10.15MWC模型的定量表述。在MWC模型中,活性位,点比例(即活性分数)Y是结 合底物的活性位点部分,与酶促反应速度成正比。是底物浓度与R态酶-底物复合物解离 常数的比值;L是T态酶浓度与R态酶浓度之间的比值。ATP和CTP与ATCase的结合能 够改变L值,因此改变了酶蛋白对底物浓度的应答。要获得这些曲线,前面介绍的MWC 模型的公式中,c=0.1,n=6
有趣的是,ATP 也是 ATCase 的别构效应剂。但是 ATP 能够增加特定底物浓度时 ATCase 酶促反应速率(图 10.14)。ATP 浓度愈高,S 形曲线就越不明显。ATP 与 CTP 竞争性结合 ATCase 的调节位点。结果,ATP 浓度高阻止 CTP 与 ATCase 结合。非底物分子对变构酶的 影响称为异质效应(heterotropic effects)。 图 10.14 ATP 对 ATCase 动力学的影响。ATP 是 ATCase 的异质活化剂,因为它能够稳定 蛋白质的 R 态结构,使蛋白质易于与底物结合。结果动力学曲线向左边移动(蓝色)。 ATP 浓度增加导致 ATCase 活性高有两个潜在的生理意义。首先,ATP 浓度高表示细胞 内嘌呤的密度高,需要增加 ATCase 活性促成细胞内嘌呤和嘧啶的平衡。其次,ATP 的浓度 高表明细胞内能量充足,能用来合成 mRNA 和复制 DNA,也需要合成更多的嘧啶。 在第 7 章附录部分,我们介绍了协同模型的定量表达方式。尽管那个表达方式用来描述 结合过程,但是也适于变构酶(因为与底物结合的活性位点比例与酶促反应速度成正比)。 这个模型的关键点是两种结构状态处于平衡。我们用 L 来表述 R 态和 T 态之间的平衡。 R ===== T L = [T]/[R] CTP 和 ATP 的效应可以简单地理解为影响 L 数值。在 CTP 饱和的情况下,L 值从 250 增加到 1250,因此需要更高的底物浓度才能使 ATCase 转化成 R 态。在 ATP 饱和的情况下, L 值降至 70(图 10.15)。 因此协同模型使我们能够很好地描述各种调节因子存在时 ATCase 酶促反应的动力学。 图 10.15 MWC 模型的定量表述。在 MWC 模型中,活性位点比例(即活性分数)Y 是结 合底物的活性位点部分,与酶促反应速度成正比。是底物浓度与 R 态酶-底物复合物解离 常数的比值;L 是 T 态酶浓度与 R 态酶浓度之间的比值。ATP 和 CTP 与 ATCase 的结合能 够改变 L 值,因此改变了酶蛋白对底物浓度的应答。要获得这些曲线,前面介绍的 MWC 模型的公式中,c = 0.1, n = 6