
第3章:蛋白质和蛋白质组学研究技术 Casein2+ Caseir Lactoglobulin 0000 16,000 30,000 Mass/charge 奶汁是所有哺乳动物的营养源。奶汁含有不同蛋白质。用MALDI-TOF质谱技术研究奶 汁的蛋白质组成,依靠它们的质量/电荷比将奶汁蛋白质各组分分开。 几乎在所有的生物过程中,蛋白质都起关键作用。蛋白质参与生物反应的催化、细胞信 号传递、和生物结构支持等。它执行各种各样生物功能的基础是生物体内有成千上万种蛋白 质,每种蛋白质度能折叠成独特的三维结构,从而与一种或几种分子相互作用。生物化学的 主要目标之一是确定氨基酸序列如何决定蛋白质构型,从而决定蛋白质功能。生物化学的其 它目标是了解各种蛋白质与底物或其他分子结合进而介导催化、能量和信息转导的机制。 这些研究的第一个工作常常是对目标蛋白进行纯化。根据蛋白质溶解度、大小、电荷、 和结合能力上的差异进行蛋白质分离。纯化蛋白可以用来测定氨基酸序列。自动多肽测序和 重组DNA技术提供了大量的氨基酸序列数据(你可以在公共数据库上查询、下载相关蛋白 质的氨基酸序列)。有很多蛋白质序列是从基因组序列推测的。如果纯化蛋白质序列已经列 在数据库中,研究工作就比较容易做。你只要测定一小段肽序,与数据库进行比较即可。另 外也可以进行分子质量比对,看看与数据库推测的质量是否吻合。质谱是确定蛋白质质量的 有效技术。 为了了解一个蛋白质的生理学背景,有必要制备出该蛋白质的抗体。利用抗体确定蛋白 质在活体内的位置、测定其含量。可以大量制备能够确定特异蛋白质的单克隆抗体。这些抗 体能够用于检测分离状态的蛋白质和存在于细胞状态下的蛋白质,并进行蛋白质定量。可以 用化学方法合成多肽和蛋白质,这样制造的蛋白质可用于研究,也可满足高纯度药用蛋白的 需求。最后,X射线晶体衍射技术和NMR谱是现在阐明蛋白质三维结构的主要技术。而蛋 白质三维结构是决定蛋白质功能的关键因素。 用一系列生理和化学技术对蛋白质进行的研究极大地促进了我们对生命分子基础的了 解。这些技术的应用使我们有可能在分子水平上攻克挑战性最大的生物学问题。 蛋白质组是基因组的功能表达形式 有很多生物的全基因组序列已经阐明。例如,蛔虫(Caenorhabiditis elegans)的基因组 有9700万碱基对,编码19000种蛋白质;果蝇基因组有1亿8千万碱基对,编码14000种 蛋白质。人的全基因组序列有30亿碱基对,编码25000种蛋白质。但是这些基因组序列就 像一个汽车的零配件清单一不能提供各个零配件所在位置以及各零配件所起的作用。于是 就产生了一个新领域,即蛋白质组,能够提供相应的功能信息。蛋白质组包括功能蛋白质种
第 3 章:蛋白质和蛋白质组学研究技术 奶汁是所有哺乳动物的营养源。奶汁含有不同蛋白质。用 MALDI-TOF 质谱技术研究奶 汁的蛋白质组成,依靠它们的质量/电荷比将奶汁蛋白质各组分分开。 几乎在所有的生物过程中,蛋白质都起关键作用。蛋白质参与生物反应的催化、细胞信 号传递、和生物结构支持等。它执行各种各样生物功能的基础是生物体内有成千上万种蛋白 质,每种蛋白质度能折叠成独特的三维结构,从而与一种或几种分子相互作用。生物化学的 主要目标之一是确定氨基酸序列如何决定蛋白质构型,从而决定蛋白质功能。生物化学的其 它目标是了解各种蛋白质与底物或其他分子结合进而介导催化、能量和信息转导的机制。 这些研究的第一个工作常常是对目标蛋白进行纯化。根据蛋白质溶解度、大小、电荷、 和结合能力上的差异进行蛋白质分离。纯化蛋白可以用来测定氨基酸序列。自动多肽测序和 重组 DNA 技术提供了大量的氨基酸序列数据(你可以在公共数据库上查询、下载相关蛋白 质的氨基酸序列)。有很多蛋白质序列是从基因组序列推测的。如果纯化蛋白质序列已经列 在数据库中,研究工作就比较容易做。你只要测定一小段肽序,与数据库进行比较即可。另 外也可以进行分子质量比对,看看与数据库推测的质量是否吻合。质谱是确定蛋白质质量的 有效技术。 为了了解一个蛋白质的生理学背景,有必要制备出该蛋白质的抗体。利用抗体确定蛋白 质在活体内的位置、测定其含量。可以大量制备能够确定特异蛋白质的单克隆抗体。这些抗 体能够用于检测分离状态的蛋白质和存在于细胞状态下的蛋白质,并进行蛋白质定量。可以 用化学方法合成多肽和蛋白质,这样制造的蛋白质可用于研究,也可满足高纯度药用蛋白的 需求。最后,x-射线晶体衍射技术和 NMR 谱是现在阐明蛋白质三维结构的主要技术。而蛋 白质三维结构是决定蛋白质功能的关键因素。 用一系列生理和化学技术对蛋白质进行的研究极大地促进了我们对生命分子基础的了 解。这些技术的应用使我们有可能在分子水平上攻克挑战性最大的生物学问题。 蛋白质组是基因组的功能表达形式 有很多生物的全基因组序列已经阐明。例如,蛔虫(Caenorhabiditis elegans)的基因组 有 9700 万碱基对,编码 19000 种蛋白质;果蝇基因组有 1 亿 8 千万碱基对,编码 14000 种 蛋白质。人的全基因组序列有 30 亿碱基对,编码 25000 种蛋白质。但是这些基因组序列就 像一个汽车的零配件清单——不能提供各个零配件所在位置以及各零配件所起的作用。于是 就产生了一个新领域,即蛋白质组,能够提供相应的功能信息。蛋白质组包括功能蛋白质种

类、功能、以及蛋白质之间的相互作用。 蛋白质组就是基因组表达的蛋白质群。在特定的生物背景下,生物体内实际的蛋白质清 单比基因组提供的清单内容小得多,即只有一部分基因表达。蛋白质组能告诉我们哪蛋白质 在发挥作用一如那些蛋白质相互作用、形成信号传导途径或膜上离子通道。蛋白质组不是 细胞固定的特征。由于蛋白质组是信息的功能表达形式,因此不同类型的细胞、同一类型不 同发育状态的细胞、记忆处于不同环境的同一类型细胞将有不同的蛋白质组。由于生物能用 不同方式进行修饰几乎所有的基因产物蛋白质,因此蛋白质组比基因组大得多。而且蛋白质 组的蛋白质都不是以隔离状态存在的,而是与其它蛋白质相互作用来执行特定的生物功能。 与基因组不同,蛋白质组不是静态的。 对蛋白质进行研究、鉴定、归类,从而了解蛋白质组。在有些情况下(但不是在所有情 况下),这类研究最开始是要从细胞中分离出特定蛋白质。 4.1研究蛋白质功能的第一步是蛋白质纯化 生物化学有个谚语:“别在不纯的蛋白质上浪费完美的思路。”用纯化的蛋白质我们能够 确定蛋白质的氨基酸序列,研究蛋白质的生物化学功能。根据氨基酸序列,我们能够绘制不 同物种同一蛋白质的进化关系图(第六章)。纯化蛋白质能够生长出蛋白质晶体。我们用蛋 白质晶体能够进行X射线衍射、从而确定蛋白质的空间结构,这种空间结构又与蛋白质功 能密切相关。 如何判断哪个蛋白质就是我们所需要的蛋白质?-检测 纯化的目的是获得只有一种蛋白质(我们感兴趣的)的样品。该蛋白也许只有起始原料 的1%,而起始原料是培养细胞或植物特定器官所有蛋白质的混合物。生化工作者如何从复 杂的蛋白质混合物种分离出特定的蛋白质呢? 生化工作者做检测,即检查样品是否具有目标蛋白独特的性质。检测阳性表示样品有目 标蛋白。确定检测的有效性常常很困难,但是检测的性质愈特异,纯化方案逾有效。例如酶 的检测就是测定酶的催化活性一即酶促进特定生化反应的能力。酶活性检测常常是间接测 定。乳酸脱氢酶催化下列反应: 0y0 Lactate 0 dehydrogenase HO- -C—H+NAD* NADH H+ CH3 -CH3 Lactate Pyruvate Unnumbered figure pg 67 Biochemistry,Sixth Editio 2007 W.H.Freeman and Company 还原的烟碱腺苷二磷酸(NADH)在340nm有吸收峰,但氧化型NAD在340nm没有吸 收峰。因此我们能根据一定时间内(如1分钟)反应在所产生的光吸收量判断样品的酶量。 如果乳酸脱氢酶纯化过程中,样品催化乳酸脱氢反应(1分钟内)产生的340m光吸收值逐 步增加,说明酶的纯度逐步提高。 为了判断我们的纯化方案是否可行,我们还需要知道样品中蛋白质含量。有不同的方素 快速准确测定蛋白质浓度。用两个实验测得的参数—酶活性和蛋白质浓度一我们能够计
类、功能、以及蛋白质之间的相互作用。 蛋白质组就是基因组表达的蛋白质群。在特定的生物背景下,生物体内实际的蛋白质清 单比基因组提供的清单内容小得多,即只有一部分基因表达。蛋白质组能告诉我们哪蛋白质 在发挥作用——如哪些蛋白质相互作用、形成信号传导途径或膜上离子通道。蛋白质组不是 细胞固定的特征。由于蛋白质组是信息的功能表达形式,因此不同类型的细胞、同一类型不 同发育状态的细胞、记忆处于不同环境的同一类型细胞将有不同的蛋白质组。由于生物能用 不同方式进行修饰几乎所有的基因产物蛋白质,因此蛋白质组比基因组大得多。而且蛋白质 组的蛋白质都不是以隔离状态存在的,而是与其它蛋白质相互作用来执行特定的生物功能。 与基因组不同,蛋白质组不是静态的。 对蛋白质进行研究、鉴定、归类,从而了解蛋白质组。在有些情况下(但不是在所有情 况下),这类研究最开始是要从细胞中分离出特定蛋白质。 4.1 研究蛋白质功能的第一步是蛋白质纯化 生物化学有个谚语:“别在不纯的蛋白质上浪费完美的思路。”用纯化的蛋白质我们能够 确定蛋白质的氨基酸序列,研究蛋白质的生物化学功能。根据氨基酸序列,我们能够绘制不 同物种同一蛋白质的进化关系图(第六章)。纯化蛋白质能够生长出蛋白质晶体。我们用蛋 白质晶体能够进行 x-射线衍射、从而确定蛋白质的空间结构,这种空间结构又与蛋白质功 能密切相关。 如何判断哪个蛋白质就是我们所需要的蛋白质?-检测 纯化的目的是获得只有一种蛋白质(我们感兴趣的)的样品。该蛋白也许只有起始原料 的 1%,而起始原料是培养细胞或植物特定器官所有蛋白质的混合物。生化工作者如何从复 杂的蛋白质混合物种分离出特定的蛋白质呢? 生化工作者做检测,即检查样品是否具有目标蛋白独特的性质。检测阳性表示样品有目 标蛋白。确定检测的有效性常常很困难,但是检测的性质愈特异,纯化方案逾有效。例如酶 的检测就是测定酶的催化活性——即酶促进特定生化反应的能力。酶活性检测常常是间接测 定。乳酸脱氢酶催化下列反应: 还原的烟碱腺苷二磷酸(NADH)在 340nm 有吸收峰,但氧化型 NAD+在 340nm 没有吸 收峰。因此我们能根据一定时间内(如 1 分钟)反应在所产生的光吸收量判断样品的酶量。 如果乳酸脱氢酶纯化过程中,样品催化乳酸脱氢反应(1 分钟内)产生的 340nm 光吸收值逐 步增加,说明酶的纯度逐步提高。 为了判断我们的纯化方案是否可行,我们还需要知道样品中蛋白质含量。有不同的方案 快速准确测定蛋白质浓度。用两个实验测得的参数——酶活性和蛋白质浓度——我们能够计

算样品的比活性(specific activity)。比活性是样品的酶活性与蛋白质总量之间的比值。理想 状态下,纯化过程中样品的比活性愈来愈高,所获得的乳酸脱氢酶含量愈来念大。纯化的总 目标是让比活性最大化。纯净酶的比活性是一个常数值。 胞内蛋白质的纯化必须从细胞内释放出来 建立检测方案并确定蛋白质来源后,我们将细胞内容物分离成不同组分并确定哪个组分 含含有最多的目标蛋白。具体分离方案取决于所要纯化的蛋白质性质或者根据先前经验进行 一系列的尝试。在第一步,我们要破坏细胞膜,并用离心的方法将细胞匀浆液分离成底部沉 淀(密度高的重材料)和上清液(图3I)。上清液进一步用更大的离心力离心产生另一种沉 淀和上清液。这种离心方案叫差异离心(differential centrifugation),如此生成密度更小的组分。 每个组分含有几百种不同的蛋白质。测定离心产生的各个组分的目标蛋白活性。其中活性最 高的组分用作起始原料,用分离效果更好的纯化技术进一步纯化。 Centrifuge at500×g for 10 minutes Supernatant Homogenate 热 forms 10,000×g Pellet:Nuclear 20 minutes fraction 100,000×g Pellet:Mitochondrial 1 hour fraction Cytoplasm (soluble proteins) Pellet:Microsomal fraction Figure 3-1 Biochemistry,Sixth Edition 2007 W.H.Freeman and Company 图3.1差异离心。用匀浆器匀浆破坏细胞,所形成的混合物叫匀浆液。分步增加离心机的离 心力。能够将密度不同的颗粒沉淀到离心管底部(先是高密度、后是此高密度,如此递减)。 用这种方法分离的不同组分用于后续进一步纯化。[Photographs courtesy of Dr S.Fleischer and Dr B.Fleischer.]
算样品的比活性(specific activity)。比活性是样品的酶活性与蛋白质总量之间的比值。理想 状态下,纯化过程中样品的比活性愈来愈高,所获得的乳酸脱氢酶含量愈来愈大。纯化的总 目标是让比活性最大化。纯净酶的比活性是一个常数值。 胞内蛋白质的纯化必须从细胞内释放出来 建立检测方案并确定蛋白质来源后,我们将细胞内容物分离成不同组分并确定哪个组分 含含有最多的目标蛋白。具体分离方案取决于所要纯化的蛋白质性质或者根据先前经验进行 一系列的尝试。在第一步,我们要破坏细胞膜,并用离心的方法将细胞匀浆液分离成底部沉 淀(密度高的重材料)和上清液(图 3.1)。上清液进一步用更大的离心力离心产生另一种沉 淀和上清液。这种离心方案叫差异离心(differential centrifugation),如此生成密度更小的组分。 每个组分含有几百种不同的蛋白质。测定离心产生的各个组分的目标蛋白活性。其中活性最 高的组分用作起始原料,用分离效果更好的纯化技术进一步纯化。 图 3.1 差异离心。用匀浆器匀浆破坏细胞,所形成的混合物叫匀浆液。分步增加离心机的离 心力。能够将密度不同的颗粒沉淀到离心管底部(先是高密度、后是此高密度,如此递减)。 用这种方法分离的不同组分用于后续进一步纯化。[Photographs courtesy of Dr S.Fleischer and Dr B. Fleischer.]
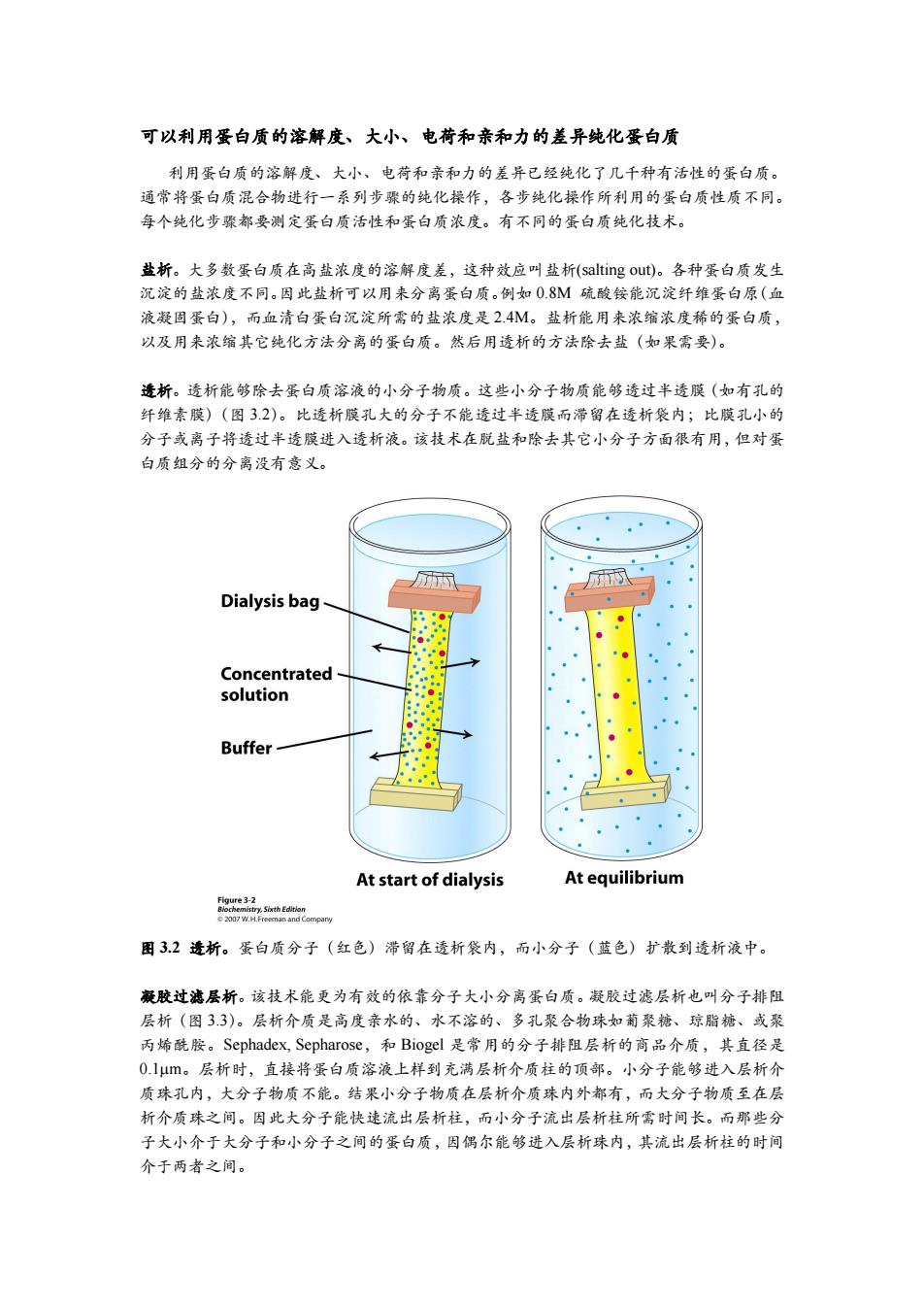
可以利用蛋白质的溶解度、大小、电荷和亲和力的差异纯化蛋白质 利用蛋白质的溶解度、大小、电荷和亲和力的差异已经纯化了几千种有活性的蛋白质。 通常将蛋白质混合物进行一系列步骤的纯化探作,各步纯化操作所利用的蛋白质性质不同。 每个纯化步骤都要测定蛋白质活性和蛋白质浓度。有不同的蛋白质纯化技术。 盐析。大多数蛋白质在高盐浓度的溶解度差,这种效应叫盐析(salting out)。各种蛋白质发生 沉淀的盐浓度不同。因此盐析可以用来分离蛋白质。例如0.8M硫酸铵能沉淀纤维蛋白原(血 液凝固蛋白),而血清白蛋白沉淀所需的盐浓度是2.4M。盐析能用来浓缩浓度稀的蛋白质, 以及用来浓缩其它纯化方法分离的蛋白质。然后用透析的方法除去盐(如果需要)。 透析。透析能够除去蛋白质溶液的小分子物质。这些小分子物质能够透过半透膜(如有孔的 纤维素膜)(图3.2)。比透析膜孔大的分子不能透过半透膜而滞留在透析袋内;比膜孔小的 分子或离子将透过半透膜进入透析液。该技术在脱盐和除去其它小分子方面很有用,但对蛋 白质组分的分离没有意义。 Dialysis bag Concentrated solution Buffer At start of dialysis At equilibrium 困32透析。蛋白质分子(红色)滞留在透析袋内,而小分子(蓝色)扩散到透析液中。 凝胶过滤层析。该技术能更为有效的依靠分子大小分离蛋白质。凝胶过滤层析也叫分子排阻 层析(图33)。层析介质是高度亲水的、水不溶的、多孔聚合物珠如葡聚糖、琼脂糖、或聚 丙烯酰胺。Sephadex,.Sepharose,和Biogel是常用的分子排阻层析的商品介质,其直径是 01μm。层析时,直接将蛋白质溶液上样到充满层析介质柱的顶部。小分子能够进入层析介 质珠孔内,大分子物质不能。结果小分子物质在层析介质珠内外都有,而大分子物质至在层 析介质珠之间。因此大分子能快速流出层析柱,而小分子流出层析柱所需时间长。而那些分 子大小介于大分子和小分子之间的蛋白质,因偶尔能够进入层析珠内,其流出层析柱的时间 介于两者之间
可以利用蛋白质的溶解度、大小、电荷和亲和力的差异纯化蛋白质 利用蛋白质的溶解度、大小、电荷和亲和力的差异已经纯化了几千种有活性的蛋白质。 通常将蛋白质混合物进行一系列步骤的纯化操作,各步纯化操作所利用的蛋白质性质不同。 每个纯化步骤都要测定蛋白质活性和蛋白质浓度。有不同的蛋白质纯化技术。 盐析。大多数蛋白质在高盐浓度的溶解度差,这种效应叫盐析(salting out)。各种蛋白质发生 沉淀的盐浓度不同。因此盐析可以用来分离蛋白质。例如 0.8M 硫酸铵能沉淀纤维蛋白原(血 液凝固蛋白),而血清白蛋白沉淀所需的盐浓度是 2.4M。盐析能用来浓缩浓度稀的蛋白质, 以及用来浓缩其它纯化方法分离的蛋白质。然后用透析的方法除去盐(如果需要)。 透析。透析能够除去蛋白质溶液的小分子物质。这些小分子物质能够透过半透膜(如有孔的 纤维素膜)(图 3.2)。比透析膜孔大的分子不能透过半透膜而滞留在透析袋内;比膜孔小的 分子或离子将透过半透膜进入透析液。该技术在脱盐和除去其它小分子方面很有用,但对蛋 白质组分的分离没有意义。 图 3.2 透析。蛋白质分子(红色)滞留在透析袋内,而小分子(蓝色)扩散到透析液中。 凝胶过滤层析。该技术能更为有效的依靠分子大小分离蛋白质。凝胶过滤层析也叫分子排阻 层析(图 3.3)。层析介质是高度亲水的、水不溶的、多孔聚合物珠如葡聚糖、琼脂糖、或聚 丙烯酰胺。Sephadex, Sepharose,和 Biogel 是常用的分子排阻层析的商品介质,其直径是 0.1m。层析时,直接将蛋白质溶液上样到充满层析介质柱的顶部。小分子能够进入层析介 质珠孔内,大分子物质不能。结果小分子物质在层析介质珠内外都有,而大分子物质至在层 析介质珠之间。因此大分子能快速流出层析柱,而小分子流出层析柱所需时间长。而那些分 子大小介于大分子和小分子之间的蛋白质,因偶尔能够进入层析珠内,其流出层析柱的时间 介于两者之间
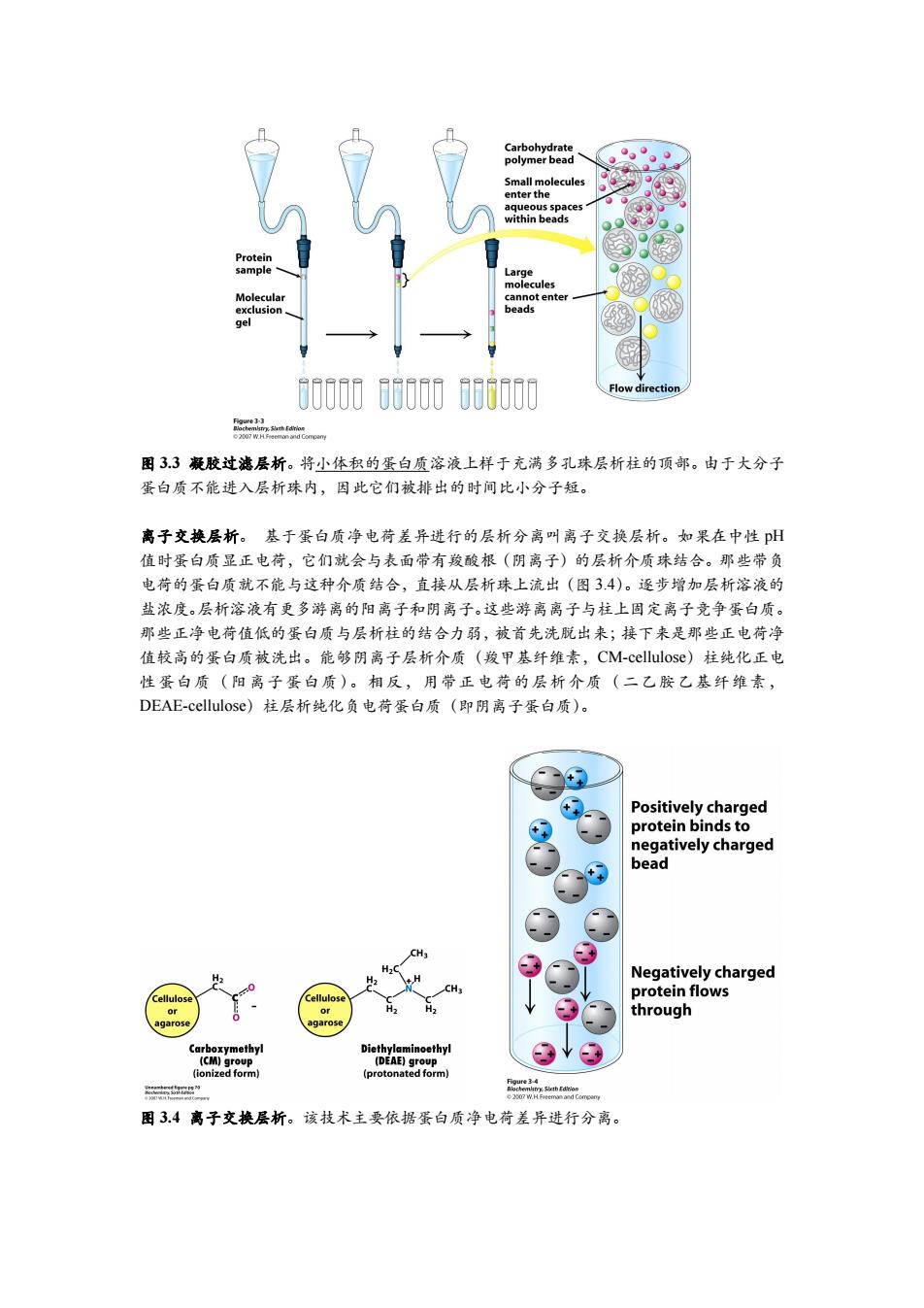
Carbohydrate polymer bead Small molecules enter the aqueous spaces within beads Protein ample Large molecules Molecular cannot enter exclusion beads gel 800008000 06000 Flow direction 品 图33凝胶过滤层析。将小体积的蛋白质溶液上样于充满多孔珠层析柱的顶部。由于大分子 蛋白质不能进入层析珠内,因此它们被排出的时间比小分子短。 离子交换层析。基于蛋白质净电荷差异进行的层析分离叫离子交换层析。如果在中性pH 值时蛋白质显正电荷,它们就会与表面带有羧酸根(阴离子)的层析介质珠结合。那些带负 电荷的蛋白质就不能与这种介质结合,直接从层析珠上流出(图3.4)。逐步增加层析溶液的 盐浓度。层析溶液有更多游离的阳离子和阴离子。这些游离离子与柱上固定离子竞争蛋白质。 那些正净电荷值低的蛋白质与层析柱的结合力弱,被首先洗脱出来;接下来是那些正电荷净 值较高的蛋白质被洗出。能够阴离子层析介质(羧甲基纤维素,CM-cellulose)柱纯化正电 性蛋白质(阳离子蛋白质)。相反,用带正电荷的层析介质(二乙胺乙基纤维素, DEAE-cellulose)柱层析纯化负电荷蛋白质(即阴离子蛋白质)。 Positively charged protein binds to negatively charged bead .H Negatively charged H2 H Cellulose Cellulose protein flows or through agarose agarose Carboxymethyl Diethylaminoethyl (CM)group (DEAE)group (ionized form) (protonated form) ” 图3.4离子交换层析。该技术主要依据蛋白质净电荷差异进行分离
图 3.3 凝胶过滤层析。将小体积的蛋白质溶液上样于充满多孔珠层析柱的顶部。由于大分子 蛋白质不能进入层析珠内,因此它们被排出的时间比小分子短。 离子交换层析。 基于蛋白质净电荷差异进行的层析分离叫离子交换层析。如果在中性 pH 值时蛋白质显正电荷,它们就会与表面带有羧酸根(阴离子)的层析介质珠结合。那些带负 电荷的蛋白质就不能与这种介质结合,直接从层析珠上流出(图 3.4)。逐步增加层析溶液的 盐浓度。层析溶液有更多游离的阳离子和阴离子。这些游离离子与柱上固定离子竞争蛋白质。 那些正净电荷值低的蛋白质与层析柱的结合力弱,被首先洗脱出来;接下来是那些正电荷净 值较高的蛋白质被洗出。能够阴离子层析介质(羧甲基纤维素,CM-cellulose)柱纯化正电 性蛋白质(阳离子蛋白质)。相反,用带正电荷的层析介质(二乙胺乙基纤维素, DEAE-cellulose)柱层析纯化负电荷蛋白质(即阴离子蛋白质)。 图 3.4 离子交换层析。该技术主要依据蛋白质净电荷差异进行分离