
碱 金 属 复 习 教 案 师范学院 化学2011级1班 高睿 2010507039
- 1 - 碱 金 属 复 习 教 案 师范学院 化学 2011 级 1 班 高睿 2010507039

碱金属复习教案 一、教学目标 (1)知识与技能: 1、使学生能运用原子结构的初步知识来了解碱金属在性质上的差异以及递变规律,为 以后学习元素周期律的知识做好准备。 2、使学生掌握钠及其重要化合物的性质及用途 (2)过程与方法: 1、通过对碱金属性质的复习,对碱金属知识的归纳、综合,使碱金属整一章知识网络 化、系统化。 2、培养学生分析问题、解决问题的能力及创造性思维。 (3)情感态度与价值观: 通过本章的复习,对学生进行科学方法的训练以及辨证唯物主义观点的教有,培养学生 热爱科学、勇于探索的精神。 二、教学重点:钠及其重要化合物的化学性质 三、教学难点:过氧化钠的性质 四、教学方法:启发、引导、归纳、练习等 五、教学过程 [引言]今天我们对第二章碱金属作一个系统的小结 [板书碱金属复习 [讲述]钠及其重要化合物之间的转换关系如下: 钠及其重要化合物之间的相互转化关系 NaO +02 +C02 +H20 +H0 Na NaOH+CO(少量入 +Ca(OH)2 Na:C0,+C0过量 +H20 +02(点燃) +C02 [过渡]从网络图中我们可以看出钠很活泼,能和很多非金属和水反应,这是为什么呢? [学生回答]这是因为钠最外层只有一个电子,在化学反应中该电子容易失去,因此钠的 化学性质很活泼, [讲述]下面我们就从碱金属元素的原子结构去分析其化学性质。 [板书一、碱金属元素的原子结构及性质 [提问]请写出Li、Na、K的原子结构示意图 [学生活动书写Li、Na、K的原子结构示意图 [展示] 4328188
- 2 - 碱金属复习教案 一、教学目标 (1)知识与技能: 1、使学生能运用原子结构的初步知识来了解碱金属在性质上的差异以及递变规律,为 以后学习元素周期律的知识做好准备。 2、使学生掌握钠及其重要化合物的性质及用途 (2)过程与方法: 1、通过对碱金属性质的复习,对碱金属知识的归纳、综合,使碱金属整一章知识网络 化、系统化。 2、培养学生分析问题、解决问题的能力及创造性思维。 (3)情感态度与价值观: 通过本章的复习,对学生进行科学方法的训练以及辨证唯物主义观点的教育,培养学生 热爱科学、勇于探索的精神。 二、教学重点:钠及其重要化合物的化学性质 三、教学难点:过氧化钠的性质 四、教学方法:启发、引导、归纳、练习等 五、教学过程 [引言] 今天我们对第二章碱金属作一个系统的小结 [板书] 碱金属复习 [讲述] 钠及其重要化合物之间的转换关系如下: 钠及其重要化合物之间的相互转化关系 Na2O Na NaOH Na2CO3 NaHCO3 Na2O2 [过渡] 从网络图中我们可以看出钠很活泼,能和很多非金属和水反应,这是为什么呢? [学生回答] 这是因为钠最外层只有一个电子,在化学反应中该电子容易失去,因此钠的 化学性质很活泼。 [讲述] 下面我们就从碱金属元素的原子结构去分析其化学性质。 [板书] 一、碱金属元素的原子结构及性质 [提问] 请写出 Li、Na、K 的原子结构示意图 [学生活动] 书写 Li、Na、K 的原子结构示意图 [展示] +H2O +H2O +H2O +CO2(少量) +CO2(过量) +Ca(OH)2 +NaOH(或加热) +CO2 +CO2 +O2 +O2(点燃)

Rb ⑤2】 [讨论小节]让学生归纳碱金属的原子结构的相同点和不同点 [讲述]物质结构决定物质的性质。碱金属的结构的相同点决定性质的相似,结构的不同 点(递变性)决定了性质的不同点(递变性)。 [讨论]根据钠、钾的性质比较讨论得出性质的相似性及递变性。 [板)由学生讨论结果制成一一表格 [展示]碱金属元素的原子结构及性质比较 相似性 递变性 元素 元素 核由 名称符号 核数 最外层 颜色 化学 核外电 电子数 状态 性质 子层数 熔、沸点 化学性 质 锂 Li 都为强 还原剂, 都为银 Na 表现为 白色金 逐 逐 属 (1)与 渐 9 属, 柔 非金 降 (除 b 37 反应 多 低 渐 铯外) (2)与 铯 Cs 55 水反应 强 「板书二、钠及其重要化合物的化学性质 [讲述]请同学们先写出钠和水反应的化学方程式 [学生活动]2Na+2H0-=2NaOH+H2↑ [设问]那钠与水反应有何现象?这些现象说明了什么? [学生活动]讨论、总结 「总结]钠与水反应现象我们可用五个字来描述“浮、熔、游、响、红”。 浮:钠的密度比水小:熔:①反应放热②钠的熔点低:游:有气体生成,此气体为氢 气:红:反应有碱生成,此碱为氢氧化钠。 [设问]若把钠投入到硫酸铜溶液中,会有什么现象?并写出有关方程式。 [学生回答]现象:有气体生成和蓝色沉淀, 反应方程式:2Na+2HO=2NaOH+H2↑ 2NaOH CuSO,==Cu(OH)2 +2Na2SO4 [讲述]在这个反应中通常能看到黑斑,原因是氢氧化铜受热分解生成了氧化铜 .3
- 3 - [讨论小节]让学生归纳碱金属的原子结构的相同点和不同点 [讲述] 物质结构决定物质的性质。碱金属的结构的相同点决定性质的相似,结构的不同 点(递变性)决定了性质的不同点(递变性)。 [讨论] 根据钠、钾的性质比较讨论得出性质的相似性及递变性。 [板书] 由学生讨论结果制成——表格 [展示] 碱金属元素的原子结构及性质比较 元素 名称 元素 符号 核电 核数 相似性 递变性 最外层 电子数 颜色 状态 化学 性质 核外电 子层数 熔、沸点 化学性 质 锂 Li 3 都 是 1 都为银 白色金 属,柔 软。(除 铯外) 都为强 还原剂, 表现为 (1)与 非金属 反应 (2)与 水反应 逐 渐 增 多 逐 渐 降 低 金 属 性 逐 渐 增 强 钠 Na 11 钾 K 19 铷 Rb 37 铯 Cs 55 [板书]二、钠及其重要化合物的化学性质 [讲述] 请同学们先写出钠和水反应的化学方程式 [学生活动] 2Na + 2H2O == 2NaOH + H2↑ [设问] 那钠与水反应有何现象?这些现象说明了什么? [学生活动] 讨论、总结 [总结] 钠与水反应现象我们可用五个字来描述“浮、熔、游、响、红”。 浮:钠的密度比水小;熔:①反应放热 ②钠的熔点低;游:有气体生成,此气体为氢 气;红:反应有碱生成,此碱为氢氧化钠。 [设问] 若把钠投入到硫酸铜溶液中,会有什么现象?并写出有关方程式。 [学生回答] 现象:有气体生成和蓝色沉淀, 反应方程式: 2Na + 2H2O == 2NaOH + H2↑ 2NaOH + CuSO4 == Cu(OH)2↓ + 2Na2SO4 [讲述] 在这个反应中通常能看到黑斑,原因是氢氧化铜受热分解生成了氧化铜 Li Na K Rb
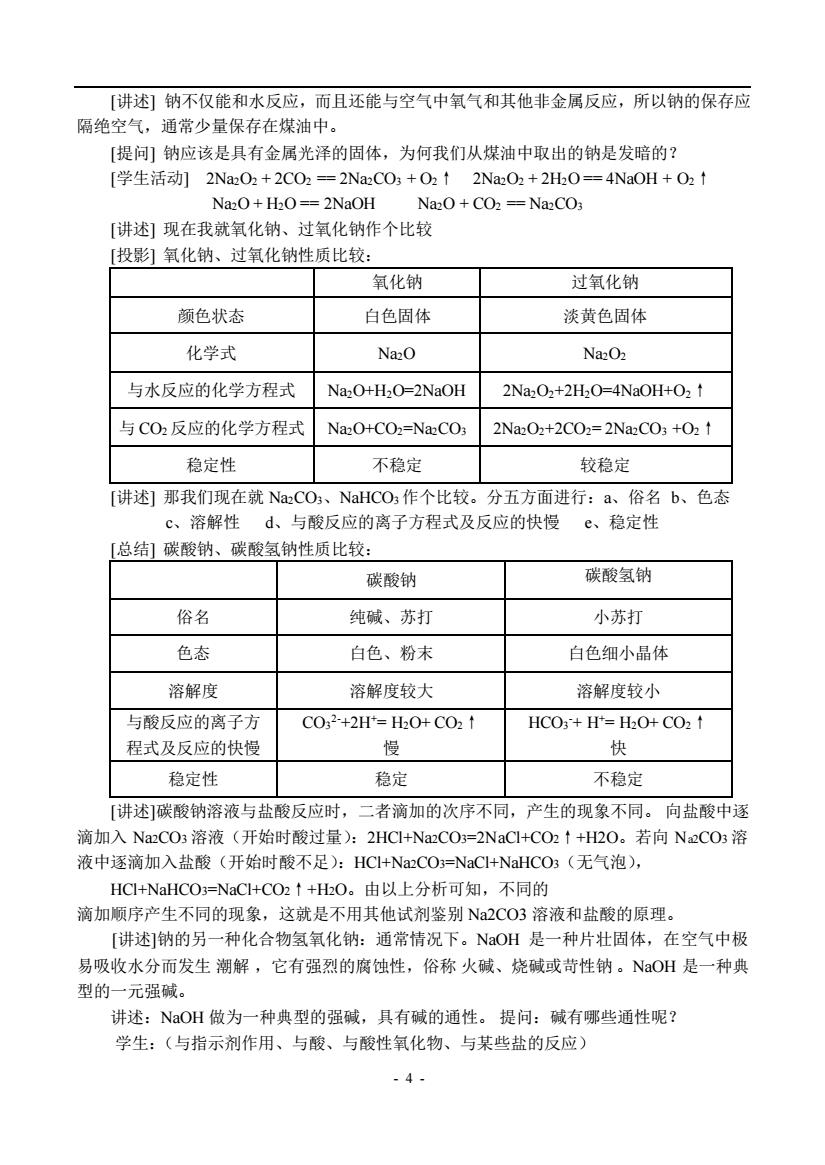
[讲述]钠不仅能和水反应,而且还能与空气中氧气和其他非金属反应,所以钠的保存应 隔绝空气,通常少量保存在煤油中。 [提问钠应该是具有金属光泽的固体,为何我们从煤油中取出的钠是发暗的? [学生活动]2Na202+2CO2=2NaC03+O2↑2NaO2+2H0=4NaOH+O2↑ Na2O+H2O==2NaOH Na2O+CO2==Na2CO [讲述]现在我就氧化钠、过氧化钠作个比较 [投影]氧化钠、过氧化钠性质比较: 氧化钠 过氧化钠 颜色状态 白色固体 淡黄色固体 化学式 NazO Na2O2 与水反应的化学方程式 NazO+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2 t 与C02反应的化学方程式 NazO+CO2=NazCO3 2NaO2+2C02=2NaC03+021 稳定性 不稳定 较稳定 [讲述)那我们现在就NaCO、NaHCO,作个比较。分五方面进行:a、俗名b、色态 c、溶解性d、与酸反应的离子方程式及反应的快慢©、稳定性 [总结]碳酸钠、碳酸氢钠性质比较: 碳酸钠 碳酸氢钠 俗名 纯碱、苏打 小苏打 色态 白色、粉末 白色细小晶体 溶解度 溶解度较大 溶解度较小 与酸反应的离子方 C02+2H=H0+C021 HCO3+H=HO+CO2↑ 程式及反应的快慢 快 稳定性 稳定 不稳定 「讲述]碳酸钠溶液与盐酸反应时,二者滴加的次序不同,产生的现象不同。向盐酸中逐 滴加入NaCO3溶液(开始时酸过量):2HCI+NaCO3=2NaC1+CO2↑+H20。若向N2CO3溶 液中逐滴加入盐酸(开始时酸不足):HCI+NaCO=NaCI+NaHCO;(无气泡), HCI+NaHCO3=NaCI+CO2↑+HO。由以上分析可知,不同的 滴加顺序产生不同的现象,这就是不用其他试剂鉴别Na2CO3溶液和盐酸的原理 [讲述]钠的另一种化合物氢氧化钠:通常情况下。NaOH是一种片壮固体,在空气中极 易吸收水分而发生潮解,它有强烈的腐蚀性,俗称火碱、烧碱或苛性钠。NaOH是一种典 型的一元强碱。 讲述:NaOH做为一种典型的强碱,具有碱的通性。提问:碱有哪些通性呢? 学生:(与指示剂作用、与酸、与酸性氧化物、与某些盐的反应) -4-
- 4 - [讲述] 钠不仅能和水反应,而且还能与空气中氧气和其他非金属反应,所以钠的保存应 隔绝空气,通常少量保存在煤油中。 [提问] 钠应该是具有金属光泽的固体,为何我们从煤油中取出的钠是发暗的? [学生活动] 2Na2O2 + 2CO2 == 2Na2CO3 + O2↑ 2Na2O2 + 2H2O == 4NaOH + O2↑ Na2O + H2O == 2NaOH Na2O + CO2 == Na2CO3 [讲述] 现在我就氧化钠、过氧化钠作个比较 [投影] 氧化钠、过氧化钠性质比较: 氧化钠 过氧化钠 颜色状态 白色固体 淡黄色固体 化学式 Na2O Na2O2 与水反应的化学方程式 Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑ 与 CO2 反应的化学方程式 Na2O+CO2=Na2CO3 2Na2O2+2CO2= 2Na2CO3 +O2↑ 稳定性 不稳定 较稳定 [讲述] 那我们现在就 Na2CO3、NaHCO3 作个比较。分五方面进行:a、俗名 b、色态 c、溶解性 d、与酸反应的离子方程式及反应的快慢 e、稳定性 [总结] 碳酸钠、碳酸氢钠性质比较: 碳酸钠 碳酸氢钠 俗名 纯碱、苏打 小苏打 色态 白色、粉末 白色细小晶体 溶解度 溶解度较大 溶解度较小 与酸反应的离子方 程式及反应的快慢 CO3 2-+2H+= H2O+ CO2↑ 慢 HCO3 -+ H+= H2O+ CO2↑ 快 稳定性 稳定 不稳定 [讲述]碳酸钠溶液与盐酸反应时,二者滴加的次序不同,产生的现象不同。 向盐酸中逐 滴加入 Na2CO3 溶液(开始时酸过量):2HCl+Na2CO3=2NaCl+CO2↑+H2O。若向 Na2CO3 溶 液中逐滴加入盐酸(开始时酸不足):HCl+Na2CO3=NaCl+NaHCO3(无气泡), HCl+NaHCO3=NaCl+CO2↑+H2O。由以上分析可知,不同的 滴加顺序产生不同的现象,这就是不用其他试剂鉴别 Na2CO3 溶液和盐酸的原理。 [讲述]钠的另一种化合物氢氧化钠:通常情况下。NaOH 是一种片壮固体,在空气中极 易吸收水分而发生 潮解 ,它有强烈的腐蚀性,俗称 火碱、烧碱或苛性钠 。NaOH 是一种典 型的一元强碱。 讲述:NaOH 做为一种典型的强碱,具有碱的通性。 提问:碱有哪些通性呢? 学生:(与指示剂作用、与酸、与酸性氧化物、与某些盐的反应)

继续提问:除了以上反应外,NaOH还可和哪些物质反应? 学生:(与非金属单质如C2、与某些金属单质如A、与两性氧化物、与两性氢氧化物反 应。有机化学中还学了卤代烃的水解反应、消去反应、和酯的碱性水解反应等。) 投影显示:制法:①电解食盐水法②石灰纯碱法 用途:用于肥皂、石油、造纸、纺织、印染等工业 保存:(1)盛装烧碱的试剂瓶不能用玻璃塞,应该用橡胶塞。因为玻璃的主要成分是二 氧化硅(SiO2),二氧化硅是酸性氧化物,能与烧碱反应:2NaOH+SiO2 Na2SiO+HO,生成有钻性的N2SiO3,故不可用磨口破璃塞,否则瓶塞与瓶口钻 结在一起。(2)盛装烧碱的试剂瓶不能散口存放。因为烧碱易潮解,易与空气中 的二氧化碳反应而变质。 过渡:NaOH与少量的co2反应生成NaCO3,过量的CO2则生成NaHCO3。Na2CO3和 NaHCO是两种重要的钠盐。 「板书1三、焰色反应 [讲述]焰色反应的定义及应用(主要用于检验或鉴别钠、钾等单质及其化合物的存在)。 正确理輕“铭鱼反应” ①它是元素的一种物质性质。无论是金属离子或金属原子均能发生焰色反应。它属物 理变化过程。 ②不是所有元素都有特征的焰色。只有碱金属元素以及钙、锶、钡、铜等少数金属元 素才能呈现焰色反应。 ③焰色反应的显色过程与气体物质燃烧时产生各色火焰的过程有着本质的区别。焰色 反应并非金属及其化合物自身发生燃烧反应而产生各种颜色火焰的过程,而是它们的 原子或离子的外围电子被激发而产生的各种颜色的光的过程 烙色反应操作的注意事项有哪些? (1)所用火焰本身的颜色要浅,以免干扰观察. (2)蘸取待测物的金属丝本身在火焰上灼烧时应无颜色,同时熔点要高,不易被氧化.用铂丝 效果最好,也可用铁丝、镍丝、钨丝等来代替铂丝。但不能用铜丝,因为它在灼烧时有绿色 火焰产生 (3)金属丝在使用前要用稀盐酸将其表面的氧化物洗净,然后在火焰上灼烧至无色,以除去能 起焰色反应的少量杂质 (4)观察钾的焰色时,要过蓝色的钴玻璃片,因为钾中常混有钠的化合物杂质,蓝色钴玻璃可以滤 去黄色火焰,以看清钾的紫色火焰」 考点1 钠与水反应及应用 [例】下列关于钠与水反应的说法不正确的是 () ①将小块钠投入滴有石蕊试液的水中,反应后溶液变红:②将钠投入稀盐酸中,钠先与水反 应,后与盐酸反应:③钠在水蒸气中反应时因温度高会发生燃烧:④将两小块质量相等的金 .5
- 5 - 继续提问:除了以上反应外,NaOH 还可和哪些物质反应? 学生:(与非金属单质如 Cl2、与某些金属单质如 Al、与两性氧化物、与两性氢氧化物反 应。有机化学中还学了卤代烃的水解反应、消去反应、和酯的碱性水解反应等。) 投影显示:制法:①电解食盐水法 ②石灰纯碱法 用途:用于肥皂、石油、造纸、纺织、印染等工业 保存:(1)盛装烧碱的试剂瓶不能用玻璃塞,应该用橡胶塞。因为玻璃的主要成分是二 氧化硅(SiO2),二氧化硅是酸性氧化物,能与烧碱反应:2NaOH+SiO2= Na2SiO3+H2O,生成有粘性的 Na2SiO3,故不可用磨口玻璃塞,否则瓶塞与瓶口粘 结在一起。(2)盛装烧碱的试剂瓶不能敞口存放。因为烧碱易潮解,易与空气中 的二氧化碳反应而变质。 过渡:NaOH 与少量的 CO2 反应生成 Na2CO3,过量的 CO2 则生成 NaHCO3。Na2CO3 和 NaHCO3 是两种重要的钠盐。 [板书]三、焰色反应 [讲述]焰色反应的定义及应用(主要用于检验或鉴别钠、钾等单质及其化合物的存在)。 正确理解“焰色反应”: ①它是元素的一种物质性质。无论是金属离子或金属原子均能发生焰色反应。它属物 理变化过程。 ②不是所有元素都有特征的焰色。只有碱金属元素以及钙、锶、钡、铜等少数金属元 素才能呈现焰色反应。 ③焰色反应的显色过程与气体物质燃烧时产生各色火焰的过程有着本质的区别。焰色 反应并非金属及其化合物自身发生燃烧反应而产生各种颜色火焰的过程,而是它们的 原子或离子的外围电子被激发而产生的各种颜色的光的过程 焰色反应操作的注意事项有哪些? (1)所用火焰本身的颜色要浅,以免干扰观察. (2)蘸取待测物的金属丝本身在火焰上灼烧时应无颜色,同时熔点要高,不易被氧化.用铂丝 效果最好,也可用铁丝、镍丝、钨丝等来代替铂丝.但不能用铜丝,因为它在灼烧时有绿色 火焰产生. (3)金属丝在使用前要用稀盐酸将其表面的氧化物洗净,然后在火焰上灼烧至无色,以除去能 起焰色反应的少量杂质. (4)观察钾的焰色时,要透过蓝色的钴玻璃片,因为钾中常混有钠的化合物杂质,蓝色钴玻璃可以滤 去黄色火焰,以看清钾的紫色火焰. 考点1 钠 与 水 反 应 及 应 用 [例 1] 下列关于钠与水反应的说法不正确的是 ( ) ①将小块钠投入滴有石蕊试液的水中,反应后溶液变红;②将钠投入稀盐酸中,钠先与水反 应,后与盐酸反应;③钠在水蒸气中反应时因温度高会发生燃烧;④将两小块质量相等的金