
碱金属的复习课 教学目 一)知识目标 1、使学生能运用原子结构的初步知识来了解碱金属在性质上的差异以及递变规律,为 以后学习元素周期律的知识做好准备。 2、使学生掌握钠及其重要化合物的性质及用途 二)能力目标 1、通过对碱金属性质的复习,对碱金属知识的归纳、综合,使碱金属整一章知识网络 化、系统化。 2、培养学生分析问题、解决问题的能力及创造性思维。 (三)情感目标 通过本章的复习,对学生进行科学方法的训练以及辨证唯物主义观点的教有,培养学生 热爱科学、勇 探索的精神 教学重点:钠及其重要化合物的化学性质 教学难点:过氧化钠的性质 教学方法:启发、引导、归纳、练习等 教学过程 [引言]今天我们对第二章碱金属作一个系统的小结 [板书) 碱金属复习 [讲述]钠及其重要化合物之间的转换关系如下: [投影]钠及其重要化合物之间的相互转化关系 Na-0 +02 +C0 +0 NaOH±CO:(少量 +C02(过量) Na- +H0 Na:CO +Ca(O) +H20 +0(点燃) +C0 [过渡]从网络图中我们可以看出钠很活泼,能和很多非金属和水反应,这是为什么呢? [学生回答]这是因为钠最外层只有一个电子,在化学反应中该电子容易失去,因此钠 的化学性质很活泼。 [讲述】下面我们就从碱金属元素的原子结构去分析其化学性质。 [板书】一、碱金属元素的原子结构及性质 [提问]请写出Li、Na、K的原子结构示意图 [学生活动]书写Li、Na、K的原子结构示意图 [展示] uE③2Na 28 ←T288 437)28
碱金属的复习课 教学目标 (一)知识目标: 1、使学生能运用原子结构的初步知识来了解碱金属在性质上的差异以及递变规律,为 以后学习元素周期律的知识做好准备。 2、使学生掌握钠及其重要化合物的性质及用途 (二)能力目标: 1、通过对碱金属性质的复习,对碱金属知识的归纳、综合,使碱金属整一章知识网络 化、系统化。 2、培养学生分析问题、解决问题的能力及创造性思维。 (三)情感目标 通过本章的复习,对学生进行科学方法的训练以及辨证唯物主义观点的教育,培养学生 热爱科学、勇于探索的精神。 教学重点:钠及其重要化合物的化学性质 教学难点:过氧化钠的性质 教学方法:启发、引导、归纳、练习等 教学过程 [引言] 今天我们对第二章碱金属作一个系统的小结 [板书] 碱金属复习 [讲述] 钠及其重要化合物之间的转换关系如下: [投影] 钠及其重要化合物之间的相互转化关系 Na2O Na NaOH Na2CO3 NaHCO3 Na2O2 [过渡] 从网络图中我们可以看出钠很活泼,能和很多非金属和水反应,这是为什么呢? [学生回答] 这是因为钠最外层只有一个电子,在化学反应中该电子容易失去,因此钠 的化学性质很活泼。 [讲述] 下面我们就从碱金属元素的原子结构去分析其化学性质。 [板书] 一、碱金属元素的原子结构及性质 [提问] 请写出 Li、Na、K 的原子结构示意图 [学生活动] 书写 Li、Na、K 的原子结构示意图 [展示] +H2O +H2O +H2O +CO2(少量) +CO2(过量) +Ca(OH)2 +NaOH(或加热) +CO2 +CO2 +O2 +O2(点燃) Li Na K Rb

[讨论小节]让学生归钠碱金属的原子结构的相同点和不同点 [讲述】物质结构决定物质的性质。碱金属的结构的相同点决定性质的相似,结构的不 同点(递变性)决定了性质的不同点(递变性) [讨论]根据钠、钾的性质比较讨论得出性质的相似性及递变性。 [板书]由学生讨论结果制成—一表格 [展示]碱金属元素的原子结构及性质比较 相似性 递变性 元素元素核电 名称 符号核数 最外层颜色 化学 核外电 熔、沸点 化学性 电子数 状态 性质 了层数 质 3 都为强 还原剂 金居性 Na 11 都为银 表现为 逐 是 白色金 (1与 渐埔多 钾 K 19 非金属 反应 37 绝外 绝Cs55 水反应 [练习]下列元素中,原子半径最小的是(),最易失电子的是(),等质量下列物 质与足量水反应生成品最多的是( A、Na C、K D、Cs [板书 纳及其重要化合物的化学性质 [讲述]请同学们先写出钠和水反应的化学方程式 [学生活动]2Na+2H0==2Na0H+H2↑ [设问]那钠与水反应有何现象?这些现象说明了什么? 「学生活动1讨论、总结 钠与水反应现象我们可用五个字来描述“浮、熔、 度比水小:熔说明①反应放热 反应有碱生成,此碱为氢氧化钠。 [设问]若把钠投入到硫酸铜溶液中,会有什么现象?并写出有关方程式。 [学生回答]现象:有气体生成和蓝色沉淀, 反应方程式: 2Na+2H.0=2Na0+H.1 2NaOH+CuSO,==Cu(OH)+2Na,SO [讲述]在这个反应中通常能看到黑斑,原因是氢氧化铜受热分解生成了氧化铜 [设问]若把钠投入到氯化铝溶液中会有什么现象呢?(同学课后思考) [讲述]钠不仅能和水反应,而且还能与空气中氧气和其他非金属反应,所以钠的保存 应隔绝空气,通常少量保存在煤油中。 [练习]一小块纳切开后,露置于空气足够长时间,请描述其变化情况,写出化学反应方程 式。 [过波]钠能和氧气反应分别生成氧化钠和过氧化钠(加热或点燃),那请同学们分别写 出氧化钠、过氧化钠与二氧化碳、水的反应方程式 [学生活动]2Na0,+2C0.=2Na,0,+0,↑2Na0,+2H0=4Na0H+0,1
[讨论小节]让学生归纳碱金属的原子结构的相同点和不同点 [讲述] 物质结构决定物质的性质。碱金属的结构的相同点决定性质的相似,结构的不 同点(递变性)决定了性质的不同点(递变性)。 [讨论] 根据钠、钾的性质比较讨论得出性质的相似性及递变性。 [板书] 由学生讨论结果制成——表格 [展示] 碱金属元素的原子结构及性质比较 元 素 名称 元 素 符号 核 电 核数 相似性 递变性 最外层 电子数 颜色 状态 化学 性质 核外电 子层数 熔、沸点 化学性 质 锂 Li 3 都 是 1 都为银 白色金 属,柔 软。(除 铯外) 都为强 还原剂, 表现为 (1)与 非金属 反应 (2)与 水反应 逐 渐增多 逐 渐 降 低 金属性 逐渐增 强 钠 Na 11 钾 K 19 铷 Rb 37 铯 Cs 55 [练习] 下列元素中,原子半径最小的是( ),最易失电子的是( ),等质量下列物 质与足量水反应生成 H2 最多的是( ) A、Na B、Li C、K D、Cs [板书]二、钠及其重要化合物的化学性质 [讲述] 请同学们先写出钠和水反应的化学方程式 [学生活动] 2Na + 2H2O == 2NaOH + H2↑ [设问] 那钠与水反应有何现象?这些现象说明了什么? [学生活动] 讨论、总结 [总结] 钠与水反应现象我们可用五个字来描述“浮、熔、游、响、红”。浮说明钠的密 度比水小;熔说明①反应放热 ②钠的熔点低;游说明有气体生成,此气体为氢气;红说明 反应有碱生成,此碱为氢氧化钠。 [设问] 若把钠投入到硫酸铜溶液中,会有什么现象?并写出有关方程式。 [学生回答] 现象:有气体生成和蓝色沉淀, 反应方程式: 2Na + 2H2O == 2NaOH + H2↑ 2NaOH + CuSO4 == Cu(OH)2↓ + 2Na2SO4 [讲述] 在这个反应中通常能看到黑斑,原因是氢氧化铜受热分解生成了氧化铜 [设问] 若把钠投入到氯化铝溶液中会有什么现象呢?(同学课后思考) [讲述] 钠不仅能和水反应,而且还能与空气中氧气和其他非金属反应,所以钠的保存 应隔绝空气,通常少量保存在煤油中。 [练习] 一小块钠切开后,露置于空气足够长时间,请描述其变化情况,写出化学反应方程 式。 [过渡] 钠能和氧气反应分别生成氧化钠和过氧化钠(加热或点燃),那请同学们分别写 出氧化钠、过氧化钠与二氧化碳、水的反应方程式。 [学生活动] 2Na2O2 + 2CO2 == 2Na2CO3 + O2↑ 2Na2O2 + 2H2O == 4NaOH + O2↑
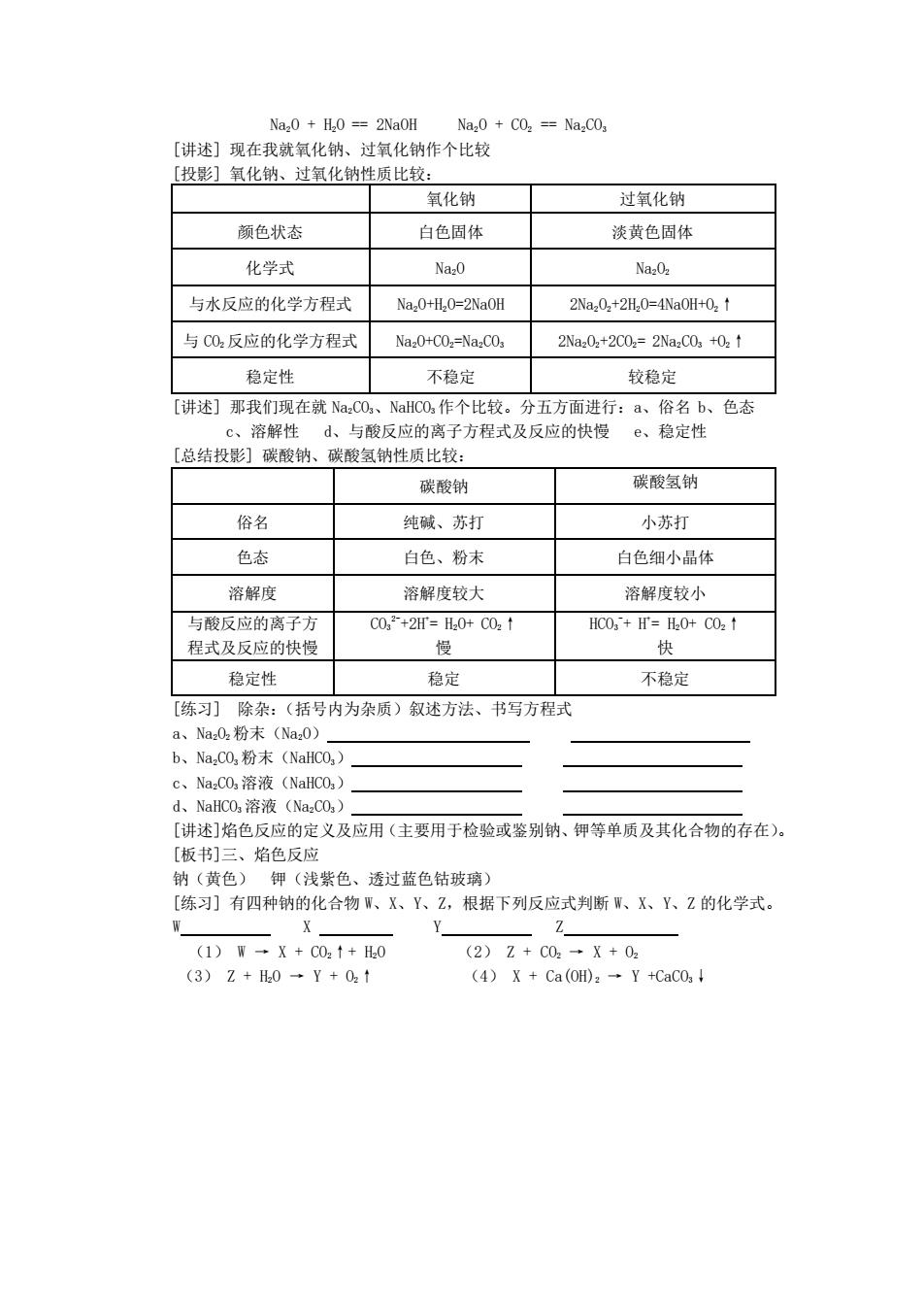
Na20 H20==2NaOH Na20 CO2 =NazCO3 [讲述]现在我就氧化钠、过氧化钠作个比较 [投影]氧化钠、过氧化钠性质比较: 氧化钠 过氧化钠 颜色状态 白色固体 淡黄色固体 化学式 Na20 Na202 与水反应的化学方程式 Na20+H20=2NaOH 2Na202+2H20=4Na0H+02↑ 与C02反应的化学方程式 Na20+COz=Na2CO3 2Na202+2C02=2Na2C03+02↑ 稳定性 不稳定 较稳定 [讲述]那我们现在就NaCo,、NaHCO作个比较。分五方面进行:a、俗名b、色态 c、溶解性d、与酸反应的离子方程式及反应的快慢e、稳定性 [总结投影幻碳酸钠、碳酸氢钠性质比较: 碳酸钠 碳酸氢钠 俗名 纯碱、苏打 小苏打 色态 白色、粉末 白色细小晶体 溶解度 溶解度较大 溶解度较小 与酸反应的离子方 C02+2F=Hz0+C02↑ HC03+Hf=H20+C02↑ 程式及反应的快慢 慢 快 稳定性 稳定 不稳定 [练习]除杂:(括号内为杂质)叙述方法、书写方程式 a、Na02粉末(Naz0) b、Na,CO,粉末(NaHC03) c、NazCO溶液(NaHCO3) d、NaHC03溶液(Na2C03) [讲述]焰色反应的定义及应用(主要用于检验或鉴别钠、钾等单质及其化合物的存在)。 [板书]三、焰色反应 钠(黄色)钾(浅紫色、透过蓝色钴玻璃) [练习]有四种钠的化合物W、X、Y、Z,根据下列反应式判断W、X、Y、Z的化学式。 W X Z (1)W→X+C02↑+H20 (2)Z+C02→X+02 (3)Z+H20→Y+02↑ (4)X+Ca(0H)2→Y+CaC03↓
Na2O + H2O == 2NaOH Na2O + CO2 == Na2CO3 [讲述] 现在我就氧化钠、过氧化钠作个比较 [投影] 氧化钠、过氧化钠性质比较: 氧化钠 过氧化钠 颜色状态 白色固体 淡黄色固体 化学式 Na2O Na2O2 与水反应的化学方程式 Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑ 与 CO2 反应的化学方程式 Na2O+CO2=Na2CO3 2Na2O2+2CO2= 2Na2CO3 +O2↑ 稳定性 不稳定 较稳定 [讲述] 那我们现在就 Na2CO3、NaHCO3 作个比较。分五方面进行:a、俗名 b、色态 c、溶解性 d、与酸反应的离子方程式及反应的快慢 e、稳定性 [总结投影] 碳酸钠、碳酸氢钠性质比较: 碳酸钠 碳酸氢钠 俗名 纯碱、苏打 小苏打 色态 白色、粉末 白色细小晶体 溶解度 溶解度较大 溶解度较小 与酸反应的离子方 程式及反应的快慢 CO3 2- +2H+ = H2O+ CO2↑ 慢 HCO3 - + H+ = H2O+ CO2↑ 快 稳定性 稳定 不稳定 [练习] 除杂:(括号内为杂质)叙述方法、书写方程式 a、Na2O2 粉末(Na2O) b、Na2CO3 粉末(NaHCO3) c、Na2CO3 溶液(NaHCO3) d、NaHCO3 溶液(Na2CO3) [讲述]焰色反应的定义及应用(主要用于检验或鉴别钠、钾等单质及其化合物的存在)。 [板书]三、焰色反应 钠(黄色) 钾(浅紫色、透过蓝色钴玻璃) [练习] 有四种钠的化合物 W、X、Y、Z,根据下列反应式判断 W、X、Y、Z 的化学式。 W X Y Z (1) W → X + CO2↑+ H2O (2) Z + CO2 → X + O2 (3) Z + H2O → Y + O2↑ (4) X + Ca(OH)2 → Y +CaCO3↓