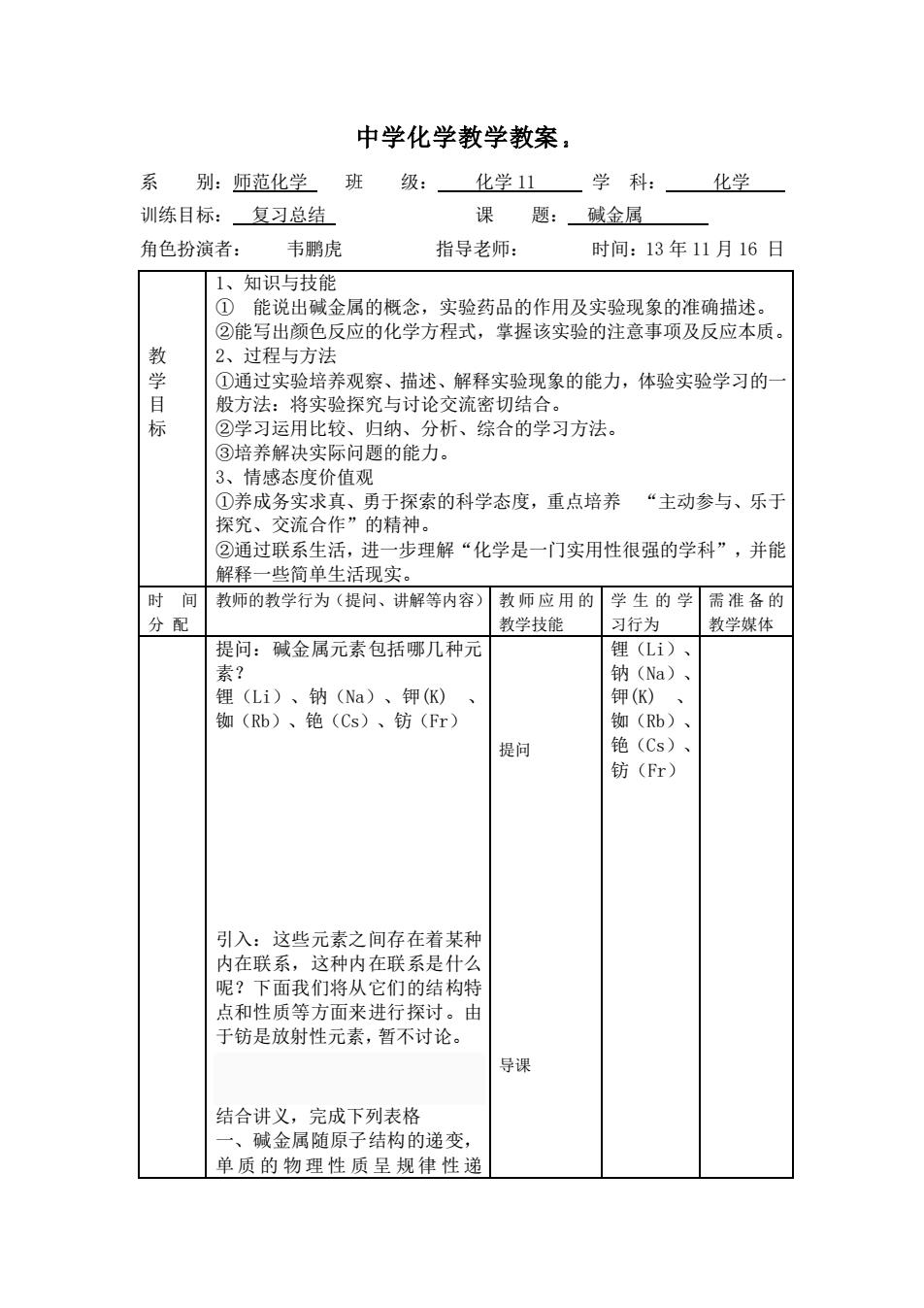
中学化学教学教案 系别:师范化学 级:化学11学科:化学 训练目标:复习总结 课题:碱金属 角色扮演者: 韦鹏虎 指导老师: 时间:13年11月16日 1、知识上与转能 0 能说出碱金属的概念,实验药品的作用及实验现象的准确描述。 ②能写出颜色反应的化学方程式,掌握该实验的注意事项及反应本质 2、过程与方法 ①通过实验培养观察、描述、解释实验现象的能力,体验实验学习的 般方法:将实验探究与讨论交流密切结合 标 ②学习运用比较、归纳 分析、综合的学习方法。 ③培养解决实际问题的能力 3、情感态度价值观 ①养成务实求真、勇于探索的科学态度,重点培养“主动参与、乐于 探究、交流合作”的精神。 ②通过联系生活,进一步理解“化学是一门实用性很强的学科”,并能 解释一些简单生活现实。 时间教师的教学行为(提问、讲解等内容)教师应用的学生的学需准备的 分配 教学技能 习行为 教学媒体 提问:碱金属元素包括哪几种元 锂(1;). 钠(a) 钾(K 钾(K) 铷(Rb)、铯(Cs)、钫(Fr) 物(Rb) 提问 铯(Cs) 钫(Fr) 引入:这些元素之间存在着某种 内在联系,这种内在联系是什么 呢?下面我们将从它们的结构特 点和性质等方面来进行探讨。由 干就是放射性元孝,暂不计论」 导课 结合讲义,完成下列表格 碱金属随原子结构的递变, 单质的物理性质呈规律性递
中学化学教学教案 2 系 别:师范化学 班 级: 化学 11 学 科: 化学 训练目标: 复习总结 课 题: 碱金属 角色扮演者: 韦鹏虎 指导老师: 时间:13 年 11 月 16 日 教 学 目 标 1、知识与技能 ① 能说出碱金属的概念,实验药品的作用及实验现象的准确描述。 ②能写出颜色反应的化学方程式,掌握该实验的注意事项及反应本质。 2、过程与方法 ①通过实验培养观察、描述、解释实验现象的能力,体验实验学习的一 般方法:将实验探究与讨论交流密切结合。 ②学习运用比较、归纳、分析、综合的学习方法。 ③培养解决实际问题的能力。 3、情感态度价值观 ①养成务实求真、勇于探索的科学态度,重点培养 “主动参与、乐于 探究、交流合作”的精神。 ②通过联系生活,进一步理解“化学是一门实用性很强的学科”,并能 解释一些简单生活现实。 时 间 分 配 教师的教学行为(提问、讲解等内容) 教师应用的 教学技能 学生的学 习行为 需准备的 教学媒体 提问:碱金属元素包括哪几种元 素? 锂(Li)、钠(Na)、钾(K) 、 铷(Rb)、铯(Cs)、钫(Fr) 引入:这些元素之间存在着某种 内在联系,这种内在联系是什么 呢?下面我们将从它们的结构特 点和性质等方面来进行探讨。由 于钫是放射性元素,暂不讨论。 结合讲义,完成下列表格 一、碱金属随原子结构的递变, 单 质 的 物 理 性 质 呈 规 律 性 递 提问 导课 锂(Li)、 钠(Na)、 钾(K) 、 铷(Rb)、 铯(Cs)、 钫(Fr)

变元索名称元索符号核电 荷数 电子层结构 原子半径 颜色、状 态 密度 Li3 从 小 到 大 银白色、 柔软 从小到大(钠钾反常) 从 高 到 低从大到 小 钠Na11 钾K19 物R阳37 5 略带金色、柔软 小结:由于价电子数一样,而金 属半径增大,所以核对价电子的 作用力变小,即金属键减弱,而 熔化、沸腾及切割都需打新断金属 键,导致熔沸点降低,硬度变 小。补充:保存Li 一用石蜡 a、 煤油 化学性质 主要. 由最外层电子决定从Li→Cs, 随着原子半径的递增,原子失电 子能力(还原性、金属性)依次 反 应 学过: a+02→ 4Li+02 点燃 2Li20(锂只有一种氧化 物) K+0
变 元素名称 元素符号 核电 荷数 电子层结构 原子半径 颜色、状 态 密度 熔沸 点 硬 度 锂 Li 3 从 小 到 大 银白色、 柔软 从小到大(钠钾反常) 从 高 到 低 从 大 到 小 钠 Na 11 钾 K 19 铷 RB 37 铯 Cs 55 略带金色、柔软 小结:由于价电子数一样,而金 属半径增大,所以核对价电子的 作用力变小,即金属键减弱,而 熔化、沸腾及切割都需打断金属 键,导致熔沸点降低,硬度变 小。 补充:保存 Li——用石蜡 Na、K——煤油 二、化学性质——主要.. 由最外层电子决定 从 Li→Cs, 随着原子半径的递增,原子失电 子能力(还原性、金属性)依次 递增。可见金属越来越活泼。 1 、 与 非 金 属 单 质 反 应 学 过 : Na+O2→ 4Li+O2 点燃 2Li2O( 锂只有一种氧化 物 ) K+O 2

点燃 KO2(超氧化钾)钾的氧化物有: K20、 K202、K02补充:锂 6Li+N2 点燃 2Li3N Li3N+H20-3LiOH+NH3 碱金属的盐类大多数易溶于水, 要注意的是Lif、Li2C03、Li3P0 是难溶于水的。 锂最大的用途是做锂电池。 2、与水反应 实验录像:2R+2H20一 2R0H+H2↑ 反应剧烈程 度:Li一Cs递增 思考: 为什么称为碱金属? 3、与酸 反应 2R+2H+→2R+H2↑ 三、焰色 反应 10 (1)定义,县指全屈成位们的化 合物在灼烧时使火焰呈现特殊的 颜色的现象 注:①在此过程中没 有生成新物质,只是电子能量的 变化产生的不同波长的光,使金 属或它们的化合物的特征颜色, 属于物理性质。 ②焰色反应是元素的性质,与其 存在状态无关。 (2)操作(洗一一烧一一燕 -观) 金属铂丝在每次使用前 用稀盐酸将其表面的氧化物洗 净,然后在火焰上灼烧至无焰色, 因为金属氯化物灼烧时易气化而 挥发,以除去能起焰色反应的少 量杂质。 烧 一所用火焰本身 应无色火焰,采用酒精喷灯较理 想,若用酒精灯焰,则要使用外 焰。蘸一一蘸取待测物的金属
点燃 KO2(超氧化钾) 钾的氧化物有: K2O、K2O2、KO2 补充:锂 6Li+N2 点燃 2Li3N Li3N+H2O → 3LiOH+NH3 ↑ 碱金属的盐类大多数易溶于水, 要注意的是 LiF、Li2C03、Li3P04 是难溶于水的。 锂最大的用途是做锂电池。 2、与水反应 实 验 录 像 : 2R+2H2O → 2ROH+H2↑ 反应剧烈程 度:Li→Cs 递增 思考: 为什么称为碱金属? 3、与酸 反应 2R+2H+→2R++H2↑ 三、焰色 反应 10 (1)定义:是指金属或它们的化 合物在灼烧时使火焰呈现特殊的 颜色的现象。 注:①在此过程中没 有生成新物质,只是电子能量的 变化产生的不同波长的光,使金 属或它们的化合物的特征颜色, 属于物理性质。 ②焰色反应是元素的性质,与其 存在状态无关。 (2)操作(洗——烧——蘸—— 烧——观) 洗——金属铂丝在每次使用前 用稀盐酸将其表面的氧化物洗 净,然后在火焰上灼烧至无焰色, 因为金属氯化物灼烧时易气化而 挥发,以除去能起焰色反应的少 量杂质。 烧——所用火焰本身 应无色火焰,采用酒精喷灯较理 想,若用酒精灯焰,则要使用外 焰。 蘸——蘸取待测物的金属

丝本身在火焰上灼烧时应无色, 同时熔点要高,不易被氧化。用 铂丝效果最好,也可用铁丝 丝、钨丝来代替。(3)焰色 Na一一黄色K一 紫色(透过蓝色钴玻璃片)(4) 应用 ①检验离 子 ②焰火、烟花 讲义:正确理解“焰色反应”: (1)它是元素的一种物质性质。 无论是金属离子或金属原子均能 生焰色反应。它属物理变化过 程 2)不是所有元素都有特征的焰 色。只有碱金属元素以及钙、锶、 钡、铜等少数金属元素才能呈现 焰色反应。 (3)焰色反应的显色过程与气体 物质燃烧时产生各色火焰的过程 有着本质的区别。焰色反应并非 金属及其化合物自身发生燃烧反 应而产生各种颜色火焰的过程, 而是它们的原子或离 的外围电 子被激发而产生的各种颜色的光 的过程
丝本身在火焰上灼烧时应无色, 同时熔点要高,不易被氧化。用 铂丝效果最好,也可用铁丝、镍 丝、钨丝来代替。 (3)焰色 Na——黄色 K—— 紫色(透过蓝色钴玻璃片) (4) 应用 ① 检 验 离 子 ② 焰火、烟花 讲义:正确理解“焰色反应”: (1)它是元素的一种物质性质。 无论是金属离子或金属原子均能 发生焰色反应。它属物理变化过 程。 (2)不是所有元素都有特征的焰 色。只有碱金属元素以及钙、锶、 钡、铜等少数金属元素才能呈现 焰色反应。 (3)焰色反应的显色过程与气体 物质燃烧时产生各色火焰的过程 有着本质的区别。焰色反应并非 金属及其化合物自身发生燃烧反 应而产生各种颜色火焰的过程, 而是它们的原子或离子的外围电 子被激发而产生的各种颜色的光 的过程