
卤族元素教学设计(二) 教材分析 以卤素的制备和加碘盐的鉴别及含量测定作为卤族元素复习的载体,本内容可以作为卤素知识综 合应用的专题讲座。海水中蕴藏者丰富的资源,特别是卤素的化合物,从中可以提取食盐、卤素单 质。食用加碘盐是实现我国政府1991年向全世界承诺“到2000年在全国范围消灭碘缺乏病”的重 要举措,加碘盐的鉴别及含量测定是富有现实意义的课题。 宜以“探究教学”作为本专题内容教学的教学模式,通过师生发现问题、提出问题(课题),进行 理论探究和实验探究,最后获得知识和结论,从而解决问题(课题),是一种学科内综合的课堂研究 性学习,有利于培养学生综合能力。注重了师生的互动和学生的实践活动。 教学目标 知识目标 1.归纳卤族元素性质变化规律: 2.解释可逆反应的涵义: 3.识别卤素的一些特殊性质: 4.区别卤化银的性质、用途 5.制定卤离子的检验及其干扰离子的排除方案: 6.列举碘与人体健康等知识: 7.联系生产和生活实际,通过对卤化物、海水资源及其综合利用的阅读,复述有关卤素的现代 科技发展的情况。 能力目标 1.通过对卤素与氯气性质的比较,初步形成元素族的概念: 3.学会对氯、溴、碘和卤化物进行鉴别。 情感目标 通过对卤族元素的结构决定其性质上相似性和递变性的学习,进一步接受结构决定性质的原理 教学重点 卤素性质的相似性与递变性及与原子结构的关系。 ●散学难点 通过卤素性质的比较,总结出性质的递变规律。 •教学方法
1 卤族元素 教学设计(二) ●教材分析 以卤素的制备和加碘盐的鉴别及含量测定作为卤族元素复习的载体,本内容可以作为卤素知识综 合应用的专题讲座。海水中蕴藏着丰富的资源,特别是卤素的化合物,从中可以提取食盐、卤素单 质。食用加碘盐是实现我国政府 1991 年向全世界承诺“到 2000 年在全国范围消灭碘缺乏病”的重 要举措,加碘盐的鉴别及含量测定是富有现实意义的课题。 宜以“探究教学”作为本专题内容教学的教学模式,通过师生发现问题、提出问题(课题),进行 理论探究和实验探究,最后获得知识和结论,从而解决问题(课题),是一种学科内综合的课堂研究 性学习,有利于培养学生综合能力。注重了师生的互动和学生的实践活动。 ●教学目标 知识目标 1.归纳卤族元素性质变化规律; 2.解释可逆反应的涵义; 3.识别卤素的一些特殊性质; 4.区别卤化银的性质、用途; 5.制定卤离子的检验及其干扰离子的排除方案; 6.列举碘与人体健康等知识; 7.联系生产和生活实际,通过对卤化物、海水资源及其综合利用的阅读,复述有关卤素的现代 科技发展的情况。 能力目标 1.通过对卤素与氯气性质的比较,初步形成元素族的概念; 2.通过卤素性质随着核电荷数的增加,原子半径的增大而递变的规律,学会对同族元素性质进 行类比和递变的推理、判断; 3.学会对氯、溴、碘和卤化物进行鉴别。 情感目标 通过对卤族元素的结构决定其性质上相似性和递变性的学习,进一步接受结构决定性质的原理。 ●教学重点 卤素性质的相似性与递变性及与原子结构的关系。 ●教学难点 通过卤素性质的比较,总结出性质的递变规律。 ●教学方法

引导一探究一实验验证 ·课时安排 第一课时:卤素的物理性质及卤素与氢气、水的反应 第二课时:卤素单质间的置换反应,卤化银和碘化合物的知识。 ·散学用具 、保存少量液溴的试剂瓶、封有碘的玻璃管、固体、溴水、碘水、酒精 第二课时:投影仪、溴水、碘水、I溶液、氯水、NaBr溶液、NaC溶液、CCl:溶液、AgNO 溶液、稀HNO,、淀粉液、胶头滴管。 •敕学过程 ★第一课时 [引入课题]上节课我们学习了有关氯气的性质,知道构成氯分子的氯原子最外层有7个电子, 在自然界存在的元素中,还有另外四种元素原子的最外层电子数也是7,它们是氟、溴、碘、砹, 我们把这些原子最外层电子数均为7的元素称为卤族元素,简称卤素。 [板书】第二节卤族元素 [讲解]我们知道,元素的性质与原子的结构有密切的联系。下面我们来分析卤素原子结构上 的异同点。 [投影]卤素的原子结构 ⊙⊙国国 11555 力) F Cl Br 1 [讲解]卤族元素中的破是放射元素,在中学阶段不讨论。 [学生分析、比较] [板书]卤素原子结构的异同。 相同点:最外层均有7个电子 不同点:(1)核电荷数不同,(2)电子层数不同,(3)原子半径不同。 [过渡]卤素原子结构上的这种相似性与递变性,是如何反映在元素性质上的呢?下面,我们就 来学习卤族元素的性质。 [板书]一、卤素单质的物理性质 [教师]请大家根据表4一,总结出卤素单质在颜色、状态、密度、熔沸点、溶解性等各方面 的递变规律。 [学生总结]
2 引导-探究-实验验证 ●课时安排 第一课时:卤素的物理性质及卤素与氢气、水的反应。 第二课时:卤素单质间的置换反应,卤化银和碘化合物的知识。 ●教学用具 第一课时:投影仪、保存少量液溴的试剂瓶、封有碘的玻璃管、I2 固体、溴水、碘水、酒精、 CCl4 溶液、酒精灯、试管夹、火柴。 第二课时:投影仪、溴水、碘水、KI 溶液、氯水、NaBr 溶液、NaCl 溶液、CCl4 溶液、AgNO3 溶液、稀 HNO3、淀粉液、胶头滴管。 ●教学过程 ★第一课时 [引入课题]上节课我们学习了有关氯气的性质,知道构成氯分子的氯原子最外层有 7 个电子, 在自然界存在的元素中,还有另外四种元素原子的最外层电子数也是 7,它们是氟、溴、碘、砹, 我们把这些原子最外层电子数均为 7 的元素称为卤族元素,简称卤素。 [板书]第二节 卤族元素 [讲解]我们知道,元素的性质与原子的结构有密切的联系。下面我们来分析卤素原子结构上 的异同点。 [投影]卤素的原子结构 [讲解]卤族元素中的砹是放射元素,在中学阶段不讨论。 [学生分析、比较] [板书]卤素原子结构的异同。 相同点:最外层均有 7 个电子 不同点:(1)核电荷数不同,(2)电子层数不同,(3)原子半径不同。 [过渡]卤素原子结构上的这种相似性与递变性,是如何反映在元素性质上的呢?下面,我们就 来学习卤族元素的性质。 [板书]一、卤素单质的物理性质 [教师]请大家根据表 4—1,总结出卤素单质在颜色、状态、密度、熔沸点、溶解性等各方面 的递变规律。 [学生总结]

[板书]颜色:浅→深 状态:气→液→固 密度:小→大 熔沸点:低→高 在水中的溶解性:大→小 有程行受园》,。6等单质在水中的溶解度程小,看起要制得C、e上的流度软大的溶液 [教师]答案是肯定的,我们可以用改变溶剂的办法来达到目的。 [演示实验]1.2加入水中,2加入酒精中。 2.在溴水和碘水中分别加入CC4,振荡。 [注意引导学生观察溶液的颜色变化及分层情况] [讲解]由上面的实验可知,卤素单质不易溶于水,但却溶于酒精和CC4溶液中,除此之外, 它们还易溶于苯、汽油等有机溶剂中,其中h在CC,中显紫色,B2在CC4中呈橙红色,与水混合 分层时,CC,因密度大于下层。 溴和碘除了遵循上述规律外,还有其各自的特性。 [板书]B、上的特性 [展示盛有少量液溴的试剂瓶] 讲解]在盛有少量液溴的试剂瓶中,充满了红棕色的溴蒸气,说明溴是一种易挥发的液体, 保存 又因为溴在水中的溶解度不大,所以保存少量溴时, 可在试剂瓶中加入少量的水, [演示实验4一8,碘的升华] [讲解]碘受热易升华的这个性质,可以帮助我们从上和其他物质的混合物中分离出来。如分 离2和NaC1的固体混合物时,可用加热的方法。 [过渡]卤素单质的物理性质随着核电荷数的递增而呈现出一定的变化规律,那么,它们的化 学性质是否也有着同样的相似性和递变性呢? [板书]二、卤素单质的化学性质 [讲解]元素的性质,决定于原子的结构,卤素原子的最外层电子数均为7,决定了他们的化 学性质上的相似性(元素的化学性质主要决定于其原子的最外层电子数),但原子半径的不同,又导 致了它们性质上的差异性
3 [板书]颜色:浅 ⎯⎯→ 深 状态:气 ⎯⎯→ 液 ⎯⎯→ 固 密度:小 ⎯⎯→ 大 熔沸点:低 ⎯⎯→ 高 在水中的溶解性:大 ⎯⎯→ 小 [设问]Cl2、Br2、I2 等单质在水中的溶解度很小,若想要制得 Cl2、Br2、I2 的浓度较大的溶液 有没有其他办法呢? [教师]答案是肯定的,我们可以用改变溶剂的办法来达到目的。 [演示实验]1.I2 加入水中,I2 加入酒精中。 2.在溴水和碘水中分别加入 CCl4,振荡。 [注意引导学生观察溶液的颜色变化及分层情况] [讲解]由上面的实验可知,卤素单质不易溶于水,但却溶于酒精和 CCl4 溶液中,除此之外, 它们还易溶于苯、汽油等有机溶剂中,其中 I2 在 CCl4 中显紫色,Br2 在 CCl4 中呈橙红色,与水混合 分层时,CCl4 因密度大于下层。 溴和碘除了遵循上述规律外,还有其各自的特性。 [板书]Br2、I2 的特性 [展示盛有少量液溴的试剂瓶] [讲解]在盛有少量液溴的试剂瓶中,充满了红棕色的溴蒸气,说明溴是一种易挥发的液体, 保存时应密闭。又因为溴在水中的溶解度不大,所以保存少量溴时,可在试剂瓶中加入少量的水, 以减少溴的挥发。 [演示实验 4—8,碘的升华] [讲解]碘受热易升华的这个性质,可以帮助我们从 I2 和其他物质的混合物中分离出来。如分 离 I2 和 NaCl 的固体混合物时,可用加热的方法。 [过渡]卤素单质的物理性质随着核电荷数的递增而呈现出一定的变化规律,那么,它们的化 学性质是否也有着同样的相似性和递变性呢? [板书]二、卤素单质的化学性质 [讲解]元素的性质,决定于原子的结构,卤素原子的最外层电子数均为 7,决定了他们的化 学性质上的相似性(元素的化学性质主要决定于其原子的最外层电子数),但原子半径的不同,又导 致了它们性质上的差异性
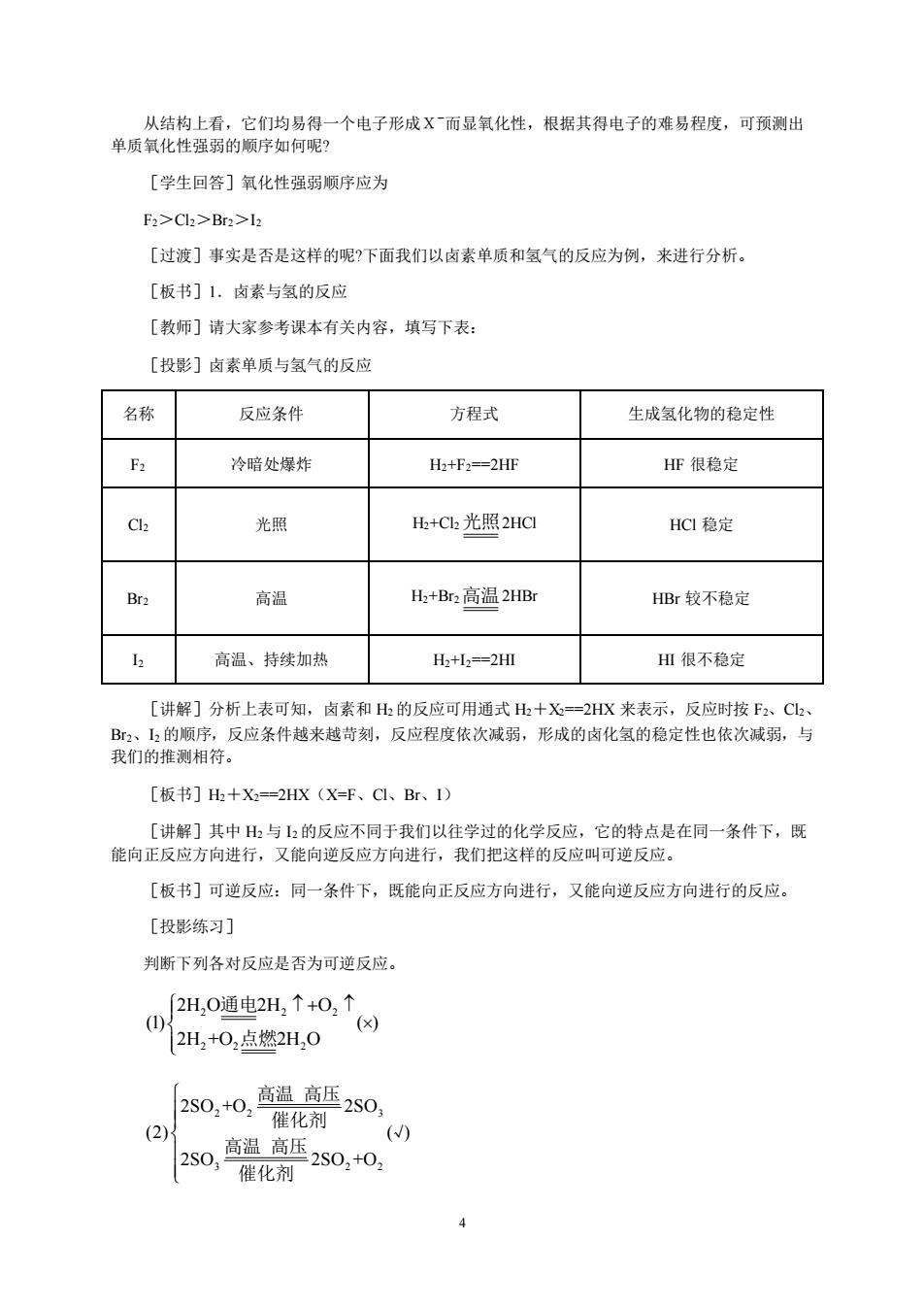
从结构上看,它们均易得一个电子形成X而显氧化性,根据其得电子的难易程度,可预测出 单质氧化性强弱的顺序如何呢? [学生回答]氧化性强弱顺序应为 F2>Cl>Br2>2 [过渡]事实是否是这样的呢?下面我们以卤素单质和氢气的反应为例,来进行分析。 [板书]1,卤素与氢的反应 [教师]请大家参考课本有关内容,填写下表: [投影]卤素单质与氢气的反应 名称 反应条件 方程式 生成氢化物的稳定性 冷暗处爆炸 H2+F2==2HF HF很稳定 C 光照 H+C2光照2HC HCI稳定 高温 +Br2高温2HB HBr较不稳定 高温、持续加热 H:+I3==2HI HⅢ很不稳定 [讲解]分析上表可知,卤素和H的反应可用通式出十X=2HX来表示,反应时按F2、C、 B2、12的顺序,反应条件越来越苛刻,反应程度依次减弱,形成的卤化氢的稳定性也依次减弱,与 我们的推测相符。 [板书]+X=2HX(X=F、CI、Br、I) [讲解]其中与的反应不同于我们以往学过的化学反应,它的特点是在同一条件下,既 能向正反应方向进行,又能向逆反应方向进行,我们把这样的反应叫可逆反应。 [板书]可逆反应:同一条件下,既能向正反应方向进行,又能向逆反应方向进行的反应。 [投影练习] 判断下列各对反应是否为可逆反应。 2H,0通电2H,↑+0,↑ x) 12H2+0,点燃2H,0 [2s0,+0,高温高2s0, (2)X 催化剂 () o0警0o
4 从结构上看,它们均易得一个电子形成X-而显氧化性,根据其得电子的难易程度,可预测出 单质氧化性强弱的顺序如何呢? [学生回答]氧化性强弱顺序应为 F2>Cl2>Br2>I2 [过渡]事实是否是这样的呢?下面我们以卤素单质和氢气的反应为例,来进行分析。 [板书]1.卤素与氢的反应 [教师]请大家参考课本有关内容,填写下表: [投影]卤素单质与氢气的反应 名称 反应条件 方程式 生成氢化物的稳定性 F2 冷暗处爆炸 H2+F2==2HF HF 很稳定 Cl2 光照 H2+Cl2 光照 2HCl HCl 稳定 Br2 高温 H2+Br2 高温 2HBr HBr 较不稳定 I2 高温、持续加热 H2+I2==2HI HI 很不稳定 [讲解]分析上表可知,卤素和 H2 的反应可用通式 H2+X2==2HX 来表示,反应时按 F2、Cl2、 Br2、I2 的顺序,反应条件越来越苛刻,反应程度依次减弱,形成的卤化氢的稳定性也依次减弱,与 我们的推测相符。 [板书]H2+X2==2HX(X=F、Cl、Br、I) [讲解]其中 H2 与 I2 的反应不同于我们以往学过的化学反应,它的特点是在同一条件下,既 能向正反应方向进行,又能向逆反应方向进行,我们把这样的反应叫可逆反应。 [板书]可逆反应:同一条件下,既能向正反应方向进行,又能向逆反应方向进行的反应。 [投影练习] 判断下列各对反应是否为可逆反应。 2 2 2 2 2 2 2H O 2H O (1) ( ) 2H +O 2H O + 通电 点燃 2 2 3 3 2 2 2SO +O 2SO (2) ( ) 2SO 2SO +O 高温 高压 催化剂 √ 高温 高压 催化剂

[过渡]在前面我们曾经学过,C2可与水微弱反应生成HC和HCO,其他卤素单质和水反应 时,情况是否一样呢? [板书]2.卤素与水的反应 [教师]分析卤素原子的结构可知,卤素原子的性质具有相似性,请大家根据C与水的反应, 写出其他卤素单质与水反应的化学方程式,并预测其与水反应程度的强弱。 [学生活动,教师巡视] [讲解]除F外,卤素单质均可与水反应生成氢卤酸与次卤酸,F是所有非金属单质中氧化性 最强的,可与水剧烈反应生成氢氟酸和氧气,它们与水反应的方程式如下表示: [板书]X+HO-=HX+HXO(X=C2、B、2) 2F2+2H0-4HF+02 [结论]、C、B、山与水反应的程度依次减弱。和水的反应比较特殊,这提醒我们在学 习的过程中, 除了注意一般规律以外,还要注意一般之中有特殊 [投影]思考题:1.分析F,与水反应中的氧化剂和还原剂,并比较F2与O2的氧化性强弱。 Ch除了能与出和水反应外,还能与金属和碱反应。想一想,其他卤素单质是否具有这两点 性质。 [小结]卤素单质随着原子核电荷数的递增,在物理性质和化学性质方面,均表现出一定的相 似性和递变性。但一般之中有特殊。 [投影]课后练习: [板书设计] 第二节卤族元素 卤族元素原子结构的异同: 相同点:最外层均有7个电子 不同点:(1)核电荷数不同,(2)电子层数不同,(3)原子半径不同。 一、卤素单质的物理性质 颜色:浅→深 状态:气液》固 密度:小→大 熔沸点:低→高
5 [过渡]在前面我们曾经学过,Cl2 可与水微弱反应生成 HCl 和 HClO,其他卤素单质和水反应 时,情况是否一样呢? [板书]2.卤素与水的反应 [教师]分析卤素原子的结构可知,卤素原子的性质具有相似性,请大家根据 Cl2 与水的反应, 写出其他卤素单质与水反应的化学方程式,并预测其与水反应程度的强弱。 [学生活动,教师巡视] [讲解]除 F2 外,卤素单质均可与水反应生成氢卤酸与次卤酸,F2 是所有非金属单质中氧化性 最强的,可与水剧烈反应生成氢氟酸和氧气,它们与水反应的方程式如下表示: [板书]X2+H2O==HX+HXO(X2=Cl2、Br2、I2) 2F2+2H2O==4HF+O2 [结论]F2、Cl2、Br2、I2 与水反应的程度依次减弱。F2 和水的反应比较特殊,这提醒我们在学 习的过程中,除了注意一般规律以外,还要注意一般之中有特殊。 [投影]思考题:1.分析 F2 与水反应中的氧化剂和还原剂,并比较 F2 与 O2 的氧化性强弱。 2.Cl2 除了能与 H2 和水反应外,还能与金属和碱反应。想一想,其他卤素单质是否具有这两点 性质。 [小结]卤素单质随着原子核电荷数的递增,在物理性质和化学性质方面,均表现出一定的相 似性和递变性。但一般之中有特殊。 [投影]课后练习: 实验室洗刷仪器时,对做过碘升华实验的烧杯壁上残留的碘,可用_洗涤;对制 Cl2 用的烧 瓶底部沾有的 MnO2 固体,可用_洗涤;对玻璃仪器上沾有的铁锈,应用_洗涤。 [板书设计] 第二节 卤族元素 卤族元素原子结构的异同: 相同点:最外层均有 7 个电子 不同点:(1)核电荷数不同,(2)电子层数不同,(3)原子半径不同。 一、卤素单质的物理性质 颜色:浅 ⎯⎯→ 深 状态:气 ⎯⎯→ 液 ⎯⎯→ 固 密度:小 ⎯⎯→ 大 熔沸点:低 ⎯⎯→ 高