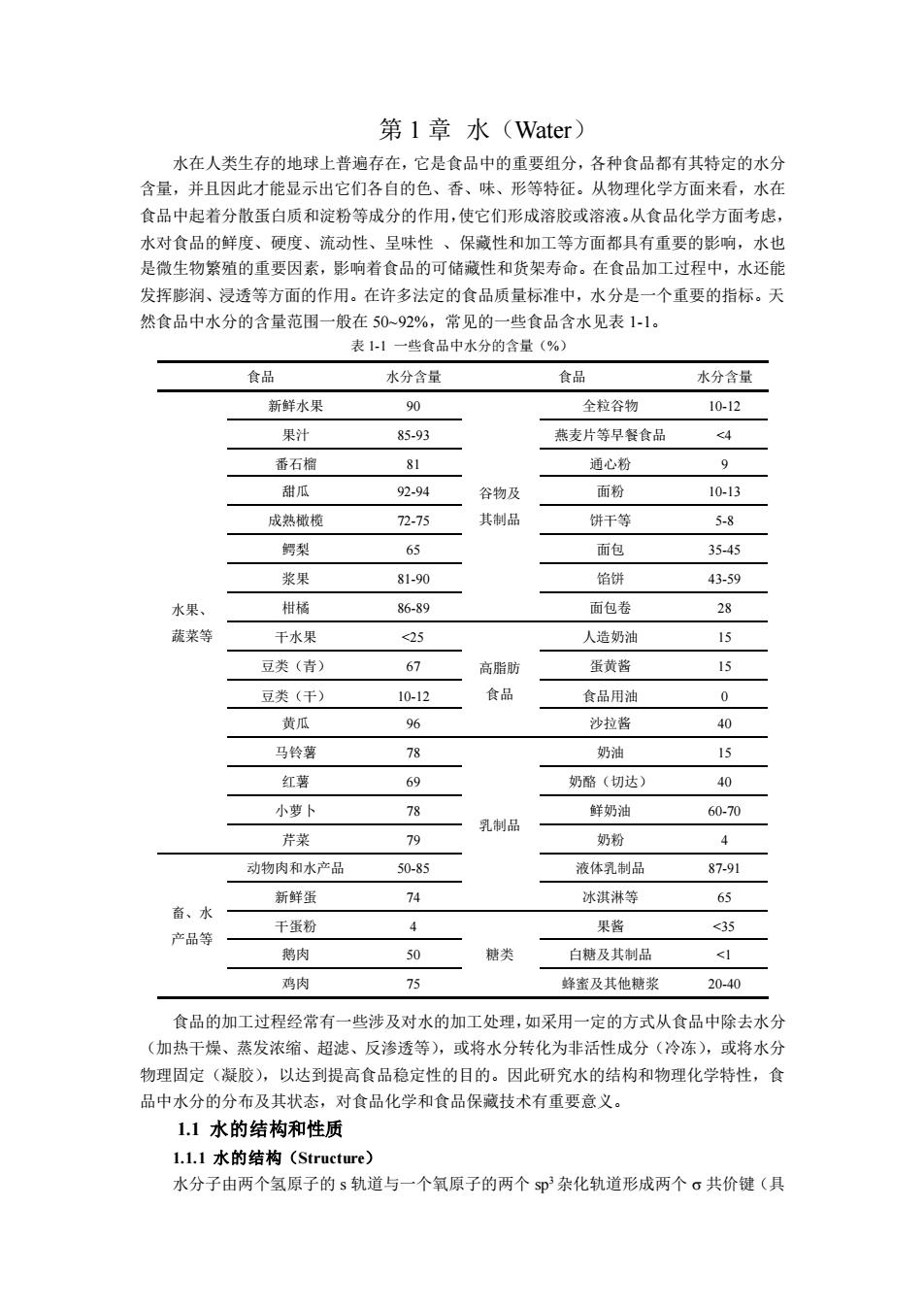
第 1 章 水(Water) 水在人类生存的地球上普遍存在,它是食品中的重要组分,各种食品都有其特定的水分 含量,并且因此才能显示出它们各自的色、香、味、形等特征。从物理化学方面来看,水在 食品中起着分散蛋白质和淀粉等成分的作用,使它们形成溶胶或溶液。从食品化学方面考虑, 水对食品的鲜度、硬度、流动性、呈味性 、保藏性和加工等方面都具有重要的影响,水也 是微生物繁殖的重要因素,影响着食品的可储藏性和货架寿命。在食品加工过程中,水还能 发挥膨润、浸透等方面的作用。在许多法定的食品质量标准中,水分是一个重要的指标。天 然食品中水分的含量范围一般在 50~92%,常见的一些食品含水见表 1-1。 表 1-1 一些食品中水分的含量(%) 食品 水分含量 食品 水分含量 水果、 蔬菜等 新鲜水果 90 谷物及 其制品 全粒谷物 10-12 果汁 85-93 燕麦片等早餐食品 <4 番石榴 81 通心粉 9 甜瓜 92-94 面粉 10-13 成熟橄榄 72-75 饼干等 5-8 鳄梨 65 面包 35-45 浆果 81-90 馅饼 43-59 柑橘 86-89 面包卷 28 干水果 <25 高脂肪 食品 人造奶油 15 豆类(青) 67 蛋黄酱 15 豆类(干) 10-12 食品用油 0 黄瓜 96 沙拉酱 40 马铃薯 78 乳制品 奶油 15 红薯 69 奶酪(切达) 40 小萝卜 78 鲜奶油 60-70 芹菜 79 奶粉 4 畜、水 产品等 动物肉和水产品 50-85 液体乳制品 87-91 新鲜蛋 74 冰淇淋等 65 干蛋粉 4 糖类 果酱 <35 鹅肉 50 白糖及其制品 <1 鸡肉 75 蜂蜜及其他糖浆 20-40 食品的加工过程经常有一些涉及对水的加工处理,如采用一定的方式从食品中除去水分 (加热干燥、蒸发浓缩、超滤、反渗透等),或将水分转化为非活性成分(冷冻),或将水分 物理固定(凝胶),以达到提高食品稳定性的目的。因此研究水的结构和物理化学特性,食 品中水分的分布及其状态,对食品化学和食品保藏技术有重要意义。 1.1 水的结构和性质 1.1.1 水的结构(Structure) 水分子由两个氢原子的 s 轨道与一个氧原子的两个 sp3 杂化轨道形成两个 共价键(具
第 1 章 水(Water) 水在人类生存的地球上普遍存在,它是食品中的重要组分,各种食品都有其特定的水分 含量,并且因此才能显示出它们各自的色、香、味、形等特征。从物理化学方面来看,水在 食品中起着分散蛋白质和淀粉等成分的作用,使它们形成溶胶或溶液。从食品化学方面考虑, 水对食品的鲜度、硬度、流动性、呈味性 、保藏性和加工等方面都具有重要的影响,水也 是微生物繁殖的重要因素,影响着食品的可储藏性和货架寿命。在食品加工过程中,水还能 发挥膨润、浸透等方面的作用。在许多法定的食品质量标准中,水分是一个重要的指标。天 然食品中水分的含量范围一般在 50~92%,常见的一些食品含水见表 1-1。 表 1-1 一些食品中水分的含量(%) 食品 水分含量 食品 水分含量 水果、 蔬菜等 新鲜水果 90 谷物及 其制品 全粒谷物 10-12 果汁 85-93 燕麦片等早餐食品 <4 番石榴 81 通心粉 9 甜瓜 92-94 面粉 10-13 成熟橄榄 72-75 饼干等 5-8 鳄梨 65 面包 35-45 浆果 81-90 馅饼 43-59 柑橘 86-89 面包卷 28 干水果 <25 高脂肪 食品 人造奶油 15 豆类(青) 67 蛋黄酱 15 豆类(干) 10-12 食品用油 0 黄瓜 96 沙拉酱 40 马铃薯 78 乳制品 奶油 15 红薯 69 奶酪(切达) 40 小萝卜 78 鲜奶油 60-70 芹菜 79 奶粉 4 畜、水 产品等 动物肉和水产品 50-85 液体乳制品 87-91 新鲜蛋 74 冰淇淋等 65 干蛋粉 4 糖类 果酱 <35 鹅肉 50 白糖及其制品 <1 鸡肉 75 蜂蜜及其他糖浆 20-40 食品的加工过程经常有一些涉及对水的加工处理,如采用一定的方式从食品中除去水分 (加热干燥、蒸发浓缩、超滤、反渗透等),或将水分转化为非活性成分(冷冻),或将水分 物理固定(凝胶),以达到提高食品稳定性的目的。因此研究水的结构和物理化学特性,食 品中水分的分布及其状态,对食品化学和食品保藏技术有重要意义。 1.1 水的结构和性质 1.1.1 水的结构(Structure) 水分子由两个氢原子的 s 轨道与一个氧原子的两个 sp3 杂化轨道形成两个 共价键(具

有 40%离子性质)。水分子为四面体结构,氧原子位于四面体中心,四面体的四个顶点中有 两个被氢原子占据,其余两个为氧原子的非共用电子对所占有(图 1-1)。气态水分子两个 O-H 键的夹角即 H-O-H 的键角为 104.5°,与典型四面体夹角 109°28′很接近,键角之所 以小了约 5°是由于受到氧原子的孤对电子排斥的影响,此外,O-H 核间距 0.096 nm,氢和 氧的范德瓦尔斯(van der Waals)半径分别为 0.12 nm 和 0.14nm。 图 1-1 单分子水的立体模式 由于自然界中 H、O 两种元素存在着同位素,所以纯水中除常见的 H2O 外,实际上还 存在其它的一些同位素的微量成分,但它们在自然界的水中所占比例极小。 常温下水是一种有结构的液体。在液态水中,若干个水分子缔合成为(H2O)n 的水分 子簇。这是由于水分子是偶极分子(在气态时为 1.84D),它们之间的作用是通过静电吸引 力(氢原子的♁端同氧原子的Θ端)及产生氢键(键能约为 2~40 kJ·mol-1)形成的。氧原子 的两个孤对电子与邻近的两个水分子的氢原子产生氢键,形成如图 1.2 所示的四面体结构。 每个水分子在三维空间的氢键给体数目和受体数目相等,因此,水分子间的吸引力比同样靠 氢键结合成分子簇的其它小分子(如 NH3 和 HF)要大得多。例如,氨分子是由三个氢给体 和一个氢受体构成的四面体;氟化氢的四面体只有一个氢给体和三个氢受体,它们只能在二 维空间形成氢键网络结构,因此比水分子包含的氢键数目要少。水分子形成三维氢键的能力 可以用于解释水分子的一些特殊物理化学性质,例如它的高熔点、高沸点、高比热和相变焓, 这些均与破坏水分子的氢键所需要的额外能量有关;水的高介电常数则是由于氢键所产生的 水分子簇,导致多分子偶极,从而有效地提高了水分子的介电常数。 图 1-2 水分子的四面体构型下的氢键模式(以虚线表示) 水分子的氢键键合程度与温度有关。在 0℃的冰中水分子的配位数为 4,随着温度的升 高,配位数增加,例如在 1.5℃和 83℃时,配位数分别为 4.4 和 4.9,配位数增加有增加水的 密度的效果;另外,由于温度升高,水分子布朗运动加剧,导致水分子间的距离增加,例如 1.5℃和 83℃时水分子之间的距离分别为 0.29 nm、0.305 nm,该变化导致体积膨胀,结果是 水的密度会降低。一般来说,温度在 0~4℃时,配位数的对水的密度影响起主导作用;随着 温度的进一步升高,布朗运动起主要作用,温度越高,水的密度越低。两种因素的最终结果 是水的密度在 3.98℃最大,低于、高于此温度则水的密度均会降低。 1.1.2 冰的结构
有 40%离子性质)。水分子为四面体结构,氧原子位于四面体中心,四面体的四个顶点中有 两个被氢原子占据,其余两个为氧原子的非共用电子对所占有(图 1-1)。气态水分子两个 O-H 键的夹角即 H-O-H 的键角为 104.5°,与典型四面体夹角 109°28′很接近,键角之所 以小了约 5°是由于受到氧原子的孤对电子排斥的影响,此外,O-H 核间距 0.096 nm,氢和 氧的范德瓦尔斯(van der Waals)半径分别为 0.12 nm 和 0.14nm。 图 1-1 单分子水的立体模式 由于自然界中 H、O 两种元素存在着同位素,所以纯水中除常见的 H2O 外,实际上还 存在其它的一些同位素的微量成分,但它们在自然界的水中所占比例极小。 常温下水是一种有结构的液体。在液态水中,若干个水分子缔合成为(H2O)n 的水分 子簇。这是由于水分子是偶极分子(在气态时为 1.84D),它们之间的作用是通过静电吸引 力(氢原子的♁端同氧原子的Θ端)及产生氢键(键能约为 2~40 kJ·mol-1)形成的。氧原子 的两个孤对电子与邻近的两个水分子的氢原子产生氢键,形成如图 1.2 所示的四面体结构。 每个水分子在三维空间的氢键给体数目和受体数目相等,因此,水分子间的吸引力比同样靠 氢键结合成分子簇的其它小分子(如 NH3 和 HF)要大得多。例如,氨分子是由三个氢给体 和一个氢受体构成的四面体;氟化氢的四面体只有一个氢给体和三个氢受体,它们只能在二 维空间形成氢键网络结构,因此比水分子包含的氢键数目要少。水分子形成三维氢键的能力 可以用于解释水分子的一些特殊物理化学性质,例如它的高熔点、高沸点、高比热和相变焓, 这些均与破坏水分子的氢键所需要的额外能量有关;水的高介电常数则是由于氢键所产生的 水分子簇,导致多分子偶极,从而有效地提高了水分子的介电常数。 图 1-2 水分子的四面体构型下的氢键模式(以虚线表示) 水分子的氢键键合程度与温度有关。在 0℃的冰中水分子的配位数为 4,随着温度的升 高,配位数增加,例如在 1.5℃和 83℃时,配位数分别为 4.4 和 4.9,配位数增加有增加水的 密度的效果;另外,由于温度升高,水分子布朗运动加剧,导致水分子间的距离增加,例如 1.5℃和 83℃时水分子之间的距离分别为 0.29 nm、0.305 nm,该变化导致体积膨胀,结果是 水的密度会降低。一般来说,温度在 0~4℃时,配位数的对水的密度影响起主导作用;随着 温度的进一步升高,布朗运动起主要作用,温度越高,水的密度越低。两种因素的最终结果 是水的密度在 3.98℃最大,低于、高于此温度则水的密度均会降低。 1.1.2 冰的结构

冰(ice)是由水分子构成的非常“疏松”的大而长的刚性结构,相比之下液态水则是 一种短而有序的结构,因此,冰的比容较大。冰在熔化时,一部分氢键断裂,所以转变成液 相后水分子紧密地靠拢在一起,密度增加。图 1-3 表示的是最普通的冰的晶胞示意图。 图 1-3 0℃ 时普通冰的晶胞 (圆圈表示水分子中的氧原子,最邻近水分子的 0-0 核间距是 0.276nm, =109°) 在普通冰晶体中,最邻近的水分子的 O-O 核间距为 0.276 nm,O-O-O 键角约为 109º, 接近理想四面体键 109 28'。每个水分子的配位数等于4,均与最邻近的四个水分子缔合可 形成四面体结构。 当几个晶胞结合在一起形成晶胞群时,从图 1-4 中可以清楚地看出冰的正六方结构。 从左图中可见,水分子 W 与水分子 1、2、3 和位于平面下的另外一个水分子(正好位于 W 的下面)形成四面体结构。如果从三维角度观察左图,则可以得到右图的结果,即冰结构中 存在两个平面(由空心和实心的圆分别表示),它们是接近和平行的,冰在压力下滑动或流 动时它们作为一个单元运动,类似于冰川的结构。此类平面构成冰的“基本平面”,许多平 面的堆积就构成了冰的结构,它的结构中水分子在空间的配置是完美的,冰在 C 轴方向是 单折射而在其它方向是双折射,所以 C 轴是冰的光学轴。 (1) (2) 图 1-4 冰的“基本平面”。每个圆代表一个水分子的氧原子,空心和实心代表基本平面上层和下层中氧原子 (1)从 C 轴所观察到的正六边形结构;(2)基本平面的三维图。 冰有 11 种结构,但是在常压和温度 0℃时,只有普通正六方晶系的冰晶体是稳定的。 另外还有 9 种同质多晶(Polymorphism) 和一种非结晶或玻璃态的无定形结构。在冷冻食 品中存在 4 种主要的冰晶体结构,即六方形、不规则树枝状、 粗糙的球形和易消失的球晶, 以及各种中间状态的冰晶体。大多数冷冻食品中的冰晶体是高度有序的六方形结构,但在含 有大量明胶的水溶液中,由于明胶对水分子运动的限制以及妨碍水分子形成高度有序的正六 方结晶,冰晶体主要是立方体和玻璃状冰晶。 在水的冰点温度时,水并不一定结冰,其原因包括溶质可以降低水的冰点,再就是产生 过冷现象。所谓过冷(supercooling)是由于无晶核存在,液体水温度降到冰点以下仍不析 出固体。但是,若向过冷水中投入一粒冰晶或摩擦器壁产生冰晶,过冷现象立即消失。当在 过冷溶液中加入晶核,则会在这些晶核的周围逐渐形成长大的结晶,这种现象称为异相成核 (Heterogeneous nucleation)。过冷度愈高,结晶速度愈慢,这对冰晶的大小是很重要的。当
冰(ice)是由水分子构成的非常“疏松”的大而长的刚性结构,相比之下液态水则是 一种短而有序的结构,因此,冰的比容较大。冰在熔化时,一部分氢键断裂,所以转变成液 相后水分子紧密地靠拢在一起,密度增加。图 1-3 表示的是最普通的冰的晶胞示意图。 图 1-3 0℃ 时普通冰的晶胞 (圆圈表示水分子中的氧原子,最邻近水分子的 0-0 核间距是 0.276nm, =109°) 在普通冰晶体中,最邻近的水分子的 O-O 核间距为 0.276 nm,O-O-O 键角约为 109º, 接近理想四面体键 109 28'。每个水分子的配位数等于4,均与最邻近的四个水分子缔合可 形成四面体结构。 当几个晶胞结合在一起形成晶胞群时,从图 1-4 中可以清楚地看出冰的正六方结构。 从左图中可见,水分子 W 与水分子 1、2、3 和位于平面下的另外一个水分子(正好位于 W 的下面)形成四面体结构。如果从三维角度观察左图,则可以得到右图的结果,即冰结构中 存在两个平面(由空心和实心的圆分别表示),它们是接近和平行的,冰在压力下滑动或流 动时它们作为一个单元运动,类似于冰川的结构。此类平面构成冰的“基本平面”,许多平 面的堆积就构成了冰的结构,它的结构中水分子在空间的配置是完美的,冰在 C 轴方向是 单折射而在其它方向是双折射,所以 C 轴是冰的光学轴。 (1) (2) 图 1-4 冰的“基本平面”。每个圆代表一个水分子的氧原子,空心和实心代表基本平面上层和下层中氧原子 (1)从 C 轴所观察到的正六边形结构;(2)基本平面的三维图。 冰有 11 种结构,但是在常压和温度 0℃时,只有普通正六方晶系的冰晶体是稳定的。 另外还有 9 种同质多晶(Polymorphism) 和一种非结晶或玻璃态的无定形结构。在冷冻食 品中存在 4 种主要的冰晶体结构,即六方形、不规则树枝状、 粗糙的球形和易消失的球晶, 以及各种中间状态的冰晶体。大多数冷冻食品中的冰晶体是高度有序的六方形结构,但在含 有大量明胶的水溶液中,由于明胶对水分子运动的限制以及妨碍水分子形成高度有序的正六 方结晶,冰晶体主要是立方体和玻璃状冰晶。 在水的冰点温度时,水并不一定结冰,其原因包括溶质可以降低水的冰点,再就是产生 过冷现象。所谓过冷(supercooling)是由于无晶核存在,液体水温度降到冰点以下仍不析 出固体。但是,若向过冷水中投入一粒冰晶或摩擦器壁产生冰晶,过冷现象立即消失。当在 过冷溶液中加入晶核,则会在这些晶核的周围逐渐形成长大的结晶,这种现象称为异相成核 (Heterogeneous nucleation)。过冷度愈高,结晶速度愈慢,这对冰晶的大小是很重要的。当

大量的水慢慢冷却时,由于有足够的时间在冰点温度产生异相成核,因而形成粗大的晶体结 构。若冷却速度很快就会发生很高的过冷现象,则很快形成晶核,但由于晶核增长速度相对 较慢,因而就会形成微细的结晶结构,这对于冷冻食品的品质提高是十分重要的。 冰晶体的大小和结晶速度受溶质、温度、降温速度等因素影响,溶质的种类和数量也影 响冰晶体的数量、大小、结构、位置和取向。图 1-5 为冷冻时晶核形成速率与晶体长大速率 的关系示意图。 图 1-5 晶核形成与晶体成长速率示意图 冰晶的大小与晶核数目有关,形成的晶核愈多则晶体愈小。结晶温度和结晶热传递速度 直接影响晶核数目的多少。若使体系温度维持在冰点和 A 点(图 1-5)之间将只能形成少量 的晶核,每个晶核可很快长大为的大冰晶;缓慢除去冷冻体系的热能,也同样可以得到相似 的结果,例如对食品或未搅动的液体体系,若缓慢地除去热能,则会慢慢形成连续的冰晶相; 如果很快除去热能使温度下降至 A 点,即可形成许多晶核,但每个晶体只能长大到一定的 程度,结果得到许多小结晶;搅拌则可以促进晶核的生成并使晶体变小。临界温度结冰时形 成小的结晶,所存在的其它物质不但能使冰点下降,而且还降低晶核形成的温度;低浓度蛋 白质、酒精和糖等均可阻滞晶体的成长过程。另外,一旦冰结晶形成并在冰点温度下贮存时 就会促使晶体长大。当贮存温度在很大范围内变化时,就很容易产生重结晶现象,结果是小 结晶数量减少并形成大结晶。食品组织缓慢冷冻,可以使大冰晶全部分布在细胞外部,而快 速冻结则可在细胞内外都形成小冰晶。 虽然有关冰晶的分布与冷冻食品质量的关系还不十分了解,但是食品在冷冻时,由于水 转变成冰时可产生“浓缩效应”,即食品体系中有一部分水转变为冰的时候,溶质的浓度相 应增加,同时 pH、离子强度、粘度、渗透压、蒸汽压及其它性质也会发生变化,从而会影 响食品的品质。 “浓缩效应”可以导致蛋白质絮凝、鱼肉质地变硬,化学反应速度增加等 不良变化,甚至一些酶在冷冻时被激活,从而对食品的品质产生影响,这些在具体食品加工 中需注意。 1.1.3 水的物理性质特点 (1)水的比热、汽化热、熔化热大 这是由于水分子间强烈的氢键缔合作用而导致产生的,当发生相转变时,必须供给额外 的能量来破坏水分子之间的氢键。这对食品冷冻、干燥和加工都是非常重要的因素。 (2)水的介电常数大、溶解力强 水的介电常数同样会受到氢键键合的影响,虽然水分子是一个偶极子,但水分子间靠氢 键键合形成分子群,成为多极子,这便导致水的介电常数增大。20℃时水的介电常数 80.36。 而大多数生物体内干物质的介电常数为 2.2~4.0。理论上,任何物质的水分含量增加 1%,介 电常数增加 0.8 左右。 由于水的介电常数大,因此水溶解离子型化合物的能力较强;至于非离子极性化合物如 糖类、醇类、醛类等均可与水形成氢键而溶于水中。即使不溶于水的物质,如脂肪和某些蛋 白质,也能在适当的条件下分散在水中形成乳浊液或胶体溶液
大量的水慢慢冷却时,由于有足够的时间在冰点温度产生异相成核,因而形成粗大的晶体结 构。若冷却速度很快就会发生很高的过冷现象,则很快形成晶核,但由于晶核增长速度相对 较慢,因而就会形成微细的结晶结构,这对于冷冻食品的品质提高是十分重要的。 冰晶体的大小和结晶速度受溶质、温度、降温速度等因素影响,溶质的种类和数量也影 响冰晶体的数量、大小、结构、位置和取向。图 1-5 为冷冻时晶核形成速率与晶体长大速率 的关系示意图。 图 1-5 晶核形成与晶体成长速率示意图 冰晶的大小与晶核数目有关,形成的晶核愈多则晶体愈小。结晶温度和结晶热传递速度 直接影响晶核数目的多少。若使体系温度维持在冰点和 A 点(图 1-5)之间将只能形成少量 的晶核,每个晶核可很快长大为的大冰晶;缓慢除去冷冻体系的热能,也同样可以得到相似 的结果,例如对食品或未搅动的液体体系,若缓慢地除去热能,则会慢慢形成连续的冰晶相; 如果很快除去热能使温度下降至 A 点,即可形成许多晶核,但每个晶体只能长大到一定的 程度,结果得到许多小结晶;搅拌则可以促进晶核的生成并使晶体变小。临界温度结冰时形 成小的结晶,所存在的其它物质不但能使冰点下降,而且还降低晶核形成的温度;低浓度蛋 白质、酒精和糖等均可阻滞晶体的成长过程。另外,一旦冰结晶形成并在冰点温度下贮存时 就会促使晶体长大。当贮存温度在很大范围内变化时,就很容易产生重结晶现象,结果是小 结晶数量减少并形成大结晶。食品组织缓慢冷冻,可以使大冰晶全部分布在细胞外部,而快 速冻结则可在细胞内外都形成小冰晶。 虽然有关冰晶的分布与冷冻食品质量的关系还不十分了解,但是食品在冷冻时,由于水 转变成冰时可产生“浓缩效应”,即食品体系中有一部分水转变为冰的时候,溶质的浓度相 应增加,同时 pH、离子强度、粘度、渗透压、蒸汽压及其它性质也会发生变化,从而会影 响食品的品质。 “浓缩效应”可以导致蛋白质絮凝、鱼肉质地变硬,化学反应速度增加等 不良变化,甚至一些酶在冷冻时被激活,从而对食品的品质产生影响,这些在具体食品加工 中需注意。 1.1.3 水的物理性质特点 (1)水的比热、汽化热、熔化热大 这是由于水分子间强烈的氢键缔合作用而导致产生的,当发生相转变时,必须供给额外 的能量来破坏水分子之间的氢键。这对食品冷冻、干燥和加工都是非常重要的因素。 (2)水的介电常数大、溶解力强 水的介电常数同样会受到氢键键合的影响,虽然水分子是一个偶极子,但水分子间靠氢 键键合形成分子群,成为多极子,这便导致水的介电常数增大。20℃时水的介电常数 80.36。 而大多数生物体内干物质的介电常数为 2.2~4.0。理论上,任何物质的水分含量增加 1%,介 电常数增加 0.8 左右。 由于水的介电常数大,因此水溶解离子型化合物的能力较强;至于非离子极性化合物如 糖类、醇类、醛类等均可与水形成氢键而溶于水中。即使不溶于水的物质,如脂肪和某些蛋 白质,也能在适当的条件下分散在水中形成乳浊液或胶体溶液

(3)水的密度 水的密度的变化和温度变化相关,另外冰的密度也与温度有关,冰结晶的成长及冰体积 的膨胀都会引起食品的细胞组织机械损伤和破坏,从而使冷冻食品质地发生物理变化。 1.2 水的等温吸着曲线(Moisture sorption isotherms) 1.2.1 水的存在状态 人类在很早就认识到食品的腐败变质同水之间有着紧密的联系。虽然早期的这种认识不 够全面,但脱水仍然成为人类保存食品的一种重要的方法,因为食品浓缩或干燥处理均是降 低食品中水分的含量,提高溶质的浓度。食品中溶质的存在,使得食品中的水分以不同的状 态存在。从水与食品中非水成分的作用情况来划分,水在食品中是以游离水(或称为体相水、 自由水)和结合水(或称为固定水)两种状态存在的,这两种状态水的区别就在于它们同亲 水性物质的缔合程度的大小,而缔合程度的大小则又与非水成分的性质、盐的组成、pH、 温度等因素有关。 结合水(Bound water)或固定水(Immobilized water)是指存在于溶质及其它非水组分 邻近的那一部分水,与同一体系的游离水相比,它们呈现出低的流动性和其它显著不同的性 质,这些水在-40℃ 不会结冰,不能作为溶剂,在质子核磁共振(NMR)试验中使氢的谱 线变宽。 在复杂体系中存在着不同结合程度的水。结合程度最强的水已成为非水物质的整体部 分,这部分水被看作为“化合水”或者称为“组成水”(Constitutional water),它在高水分 含量食品中只占很小比例,例如,它们存在于蛋白质的空隙区域内或者成为化学水合物的一 部分。结合强度稍强的结合水称为“单层水”(Monolayer water)或邻近水(Vicinal water), 它们占据着非水成分的大多数亲水基团的第一层位置,按这种方式与离子或离子基团相缔合 的水是结合最紧的一种邻近水。“多层水”(Multilayer water)占有第一层中剩下的位置以及 形成单层水以外的几个水层,虽然多层水的结合强度不如单层水,但是仍与非水组分靠得足 够近,以致于它的性质也大大不同于纯水的性质。因此,结合水是由化合水和吸附水(单层 水+多层水)组成的。应该注意的是,结合水不是完全静止不动的,它们同邻近水分子之间 的位置交换作用会随着水结合程度的增加而降低,但是它们之间的交换速度不会为零。 游离水(Free water)或体相水(Bulk water)就是指没有与非水成分结合的水。它又可 分为三类:不移动水或滞化水、毛细管水和自由流动水。滞化水(Entrapped water)是指被 组织中的显微和亚显微结构与膜所阻留住的水,由于这些水不能自由流动,所以称为不可移 动水或滞化水,例如一块重 100 g 的动物肌肉组织中,总含水量为 70~75g,含蛋白质 20 g, 除去近 10 g 结合水外,还有 60~65 g 的水,这部分水中极大部分是滞化水。毛细管水(Capillary water)是指在生物组织的细胞间隙、制成食品的结构组织中,存在着的一种由毛细管力所 截留的水,在生物组织中又称为细胞间水,其物理和化学性质与滞化水相同。而自由流动水 (Free flow water)是指动物的血浆、淋巴和尿液、植物的导管和细胞内液泡中的水,因为 都可以自由流动,所以叫自由流动水。 表 1-2 食品中水的分类与特征 分 类 特 征 典型食品中比例(%) 结合水 化合水 食品非水成分的组成部分 0.03% 单层水 与非水成分的亲水基团强烈作用形成单分 子层;水-离子以及水-偶极结合 0.1~0.9%
(3)水的密度 水的密度的变化和温度变化相关,另外冰的密度也与温度有关,冰结晶的成长及冰体积 的膨胀都会引起食品的细胞组织机械损伤和破坏,从而使冷冻食品质地发生物理变化。 1.2 水的等温吸着曲线(Moisture sorption isotherms) 1.2.1 水的存在状态 人类在很早就认识到食品的腐败变质同水之间有着紧密的联系。虽然早期的这种认识不 够全面,但脱水仍然成为人类保存食品的一种重要的方法,因为食品浓缩或干燥处理均是降 低食品中水分的含量,提高溶质的浓度。食品中溶质的存在,使得食品中的水分以不同的状 态存在。从水与食品中非水成分的作用情况来划分,水在食品中是以游离水(或称为体相水、 自由水)和结合水(或称为固定水)两种状态存在的,这两种状态水的区别就在于它们同亲 水性物质的缔合程度的大小,而缔合程度的大小则又与非水成分的性质、盐的组成、pH、 温度等因素有关。 结合水(Bound water)或固定水(Immobilized water)是指存在于溶质及其它非水组分 邻近的那一部分水,与同一体系的游离水相比,它们呈现出低的流动性和其它显著不同的性 质,这些水在-40℃ 不会结冰,不能作为溶剂,在质子核磁共振(NMR)试验中使氢的谱 线变宽。 在复杂体系中存在着不同结合程度的水。结合程度最强的水已成为非水物质的整体部 分,这部分水被看作为“化合水”或者称为“组成水”(Constitutional water),它在高水分 含量食品中只占很小比例,例如,它们存在于蛋白质的空隙区域内或者成为化学水合物的一 部分。结合强度稍强的结合水称为“单层水”(Monolayer water)或邻近水(Vicinal water), 它们占据着非水成分的大多数亲水基团的第一层位置,按这种方式与离子或离子基团相缔合 的水是结合最紧的一种邻近水。“多层水”(Multilayer water)占有第一层中剩下的位置以及 形成单层水以外的几个水层,虽然多层水的结合强度不如单层水,但是仍与非水组分靠得足 够近,以致于它的性质也大大不同于纯水的性质。因此,结合水是由化合水和吸附水(单层 水+多层水)组成的。应该注意的是,结合水不是完全静止不动的,它们同邻近水分子之间 的位置交换作用会随着水结合程度的增加而降低,但是它们之间的交换速度不会为零。 游离水(Free water)或体相水(Bulk water)就是指没有与非水成分结合的水。它又可 分为三类:不移动水或滞化水、毛细管水和自由流动水。滞化水(Entrapped water)是指被 组织中的显微和亚显微结构与膜所阻留住的水,由于这些水不能自由流动,所以称为不可移 动水或滞化水,例如一块重 100 g 的动物肌肉组织中,总含水量为 70~75g,含蛋白质 20 g, 除去近 10 g 结合水外,还有 60~65 g 的水,这部分水中极大部分是滞化水。毛细管水(Capillary water)是指在生物组织的细胞间隙、制成食品的结构组织中,存在着的一种由毛细管力所 截留的水,在生物组织中又称为细胞间水,其物理和化学性质与滞化水相同。而自由流动水 (Free flow water)是指动物的血浆、淋巴和尿液、植物的导管和细胞内液泡中的水,因为 都可以自由流动,所以叫自由流动水。 表 1-2 食品中水的分类与特征 分 类 特 征 典型食品中比例(%) 结合水 化合水 食品非水成分的组成部分 0.03% 单层水 与非水成分的亲水基团强烈作用形成单分 子层;水-离子以及水-偶极结合 0.1~0.9%