
第 4 章 蛋白质 蛋白质(protein)是生物体细胞的重要组成成分,在生物体系中起着核心作用;蛋白质 也是一种重要的产能营养素,并提供人体所需的必需氨基酸;蛋白质还对食品的质构、风味 和加工产生重大影响。 蛋白质是由多种不同的α—氨基酸通过肽链相互连接而成的,并具有多种多样的二级和 三级结构。不同的蛋白质具有不同的氨基酸组成,因此也具有不同的理化特性。蛋白质在生 物具有多种生物功能,可归类如下:酶催化、结构蛋白、收缩蛋白(肌球蛋白、肌动蛋白、 微管蛋白)、激素(胰岛素、生长激素)、传递蛋白(血清蛋白、铁传递蛋白、血红蛋白)、 抗体蛋白(免疫球蛋白)、储藏蛋白(蛋清蛋白、种子蛋白)和保护蛋白(毒素和过敏素) 等。 4.1 概述 4.1.1 蛋白质的化学组成 一般蛋白质的相对分子量在 1 万至几百万之间。根据元素分析,蛋白质主要含有 C、H、 O、N 等元素,有些蛋白质还含有 P、S 等,少数蛋白质含有 Fe、Zn、Mg、Mn、Co、Cu 等。多数蛋白质的元素组成如下:C 约为 50%~56%,H 为 6%~7%,O 为 20%~30%,N 为 14%~19%,平均含量为 16%;S 为 0.2%~3%;P 为 0~3%。 4.1.2 组成蛋白质的基本单位—氨基酸 蛋白质在酸、碱或酶的作用下,完全水解的最终产物是性质各不相同的一类特殊的氨基 酸,即 L—α—氨基酸。L—α—氨基酸是组成蛋白质的基本单位,其通式如图 4—1。 NH2 H R C COOH NH3 H R C COO + 非 解 离 形式 两 性 离 子 形 式 图 4—1 L—α—氨基酸 4.2 氨基酸和蛋白质的分类和结构 4.2.1 氨基酸的分类和结构 自然界氨基酸种类很多,但组成蛋白质的氨基酸仅 20 余种。根据氨基酸通式中 R 基团 极性的不同,可将氨基酸分为 3 类:①非极性或疏水的氨基酸;②极性但不带电荷的氨基酸; ③在介质中性条件下带电荷的氨基酸;见表 4—1。 表中由于脯氨酸的结构不符合通式,所以给出了它的全结构式;第一类氨基酸的水溶性 低于后两类,这类氨基酸的疏水性随着 R 侧链的碳数增加而增加;第二类氨基酸含极性但 不带电荷的侧链,它们能和水分子形成氢键,其中半胱氨酸和酪氨酸侧链的极性最高,甘氨 酸的最小;第三类氨基酸的侧链在 pH 接近 7 时带有电荷。随着 pH 变化这些侧链电荷可以 通过质子的得失而得失,这是蛋白质具有两性和等电点的基础。 表 4—1 组成蛋白质的主要氨基酸 分 名称 常用缩写符号 R 基结构
第 4 章 蛋白质 蛋白质(protein)是生物体细胞的重要组成成分,在生物体系中起着核心作用;蛋白质 也是一种重要的产能营养素,并提供人体所需的必需氨基酸;蛋白质还对食品的质构、风味 和加工产生重大影响。 蛋白质是由多种不同的α—氨基酸通过肽链相互连接而成的,并具有多种多样的二级和 三级结构。不同的蛋白质具有不同的氨基酸组成,因此也具有不同的理化特性。蛋白质在生 物具有多种生物功能,可归类如下:酶催化、结构蛋白、收缩蛋白(肌球蛋白、肌动蛋白、 微管蛋白)、激素(胰岛素、生长激素)、传递蛋白(血清蛋白、铁传递蛋白、血红蛋白)、 抗体蛋白(免疫球蛋白)、储藏蛋白(蛋清蛋白、种子蛋白)和保护蛋白(毒素和过敏素) 等。 4.1 概述 4.1.1 蛋白质的化学组成 一般蛋白质的相对分子量在 1 万至几百万之间。根据元素分析,蛋白质主要含有 C、H、 O、N 等元素,有些蛋白质还含有 P、S 等,少数蛋白质含有 Fe、Zn、Mg、Mn、Co、Cu 等。多数蛋白质的元素组成如下:C 约为 50%~56%,H 为 6%~7%,O 为 20%~30%,N 为 14%~19%,平均含量为 16%;S 为 0.2%~3%;P 为 0~3%。 4.1.2 组成蛋白质的基本单位—氨基酸 蛋白质在酸、碱或酶的作用下,完全水解的最终产物是性质各不相同的一类特殊的氨基 酸,即 L—α—氨基酸。L—α—氨基酸是组成蛋白质的基本单位,其通式如图 4—1。 NH2 H R C COOH NH3 H R C COO + 非 解 离 形式 两 性 离 子 形 式 图 4—1 L—α—氨基酸 4.2 氨基酸和蛋白质的分类和结构 4.2.1 氨基酸的分类和结构 自然界氨基酸种类很多,但组成蛋白质的氨基酸仅 20 余种。根据氨基酸通式中 R 基团 极性的不同,可将氨基酸分为 3 类:①非极性或疏水的氨基酸;②极性但不带电荷的氨基酸; ③在介质中性条件下带电荷的氨基酸;见表 4—1。 表中由于脯氨酸的结构不符合通式,所以给出了它的全结构式;第一类氨基酸的水溶性 低于后两类,这类氨基酸的疏水性随着 R 侧链的碳数增加而增加;第二类氨基酸含极性但 不带电荷的侧链,它们能和水分子形成氢键,其中半胱氨酸和酪氨酸侧链的极性最高,甘氨 酸的最小;第三类氨基酸的侧链在 pH 接近 7 时带有电荷。随着 pH 变化这些侧链电荷可以 通过质子的得失而得失,这是蛋白质具有两性和等电点的基础。 表 4—1 组成蛋白质的主要氨基酸 分 名称 常用缩写符号 R 基结构
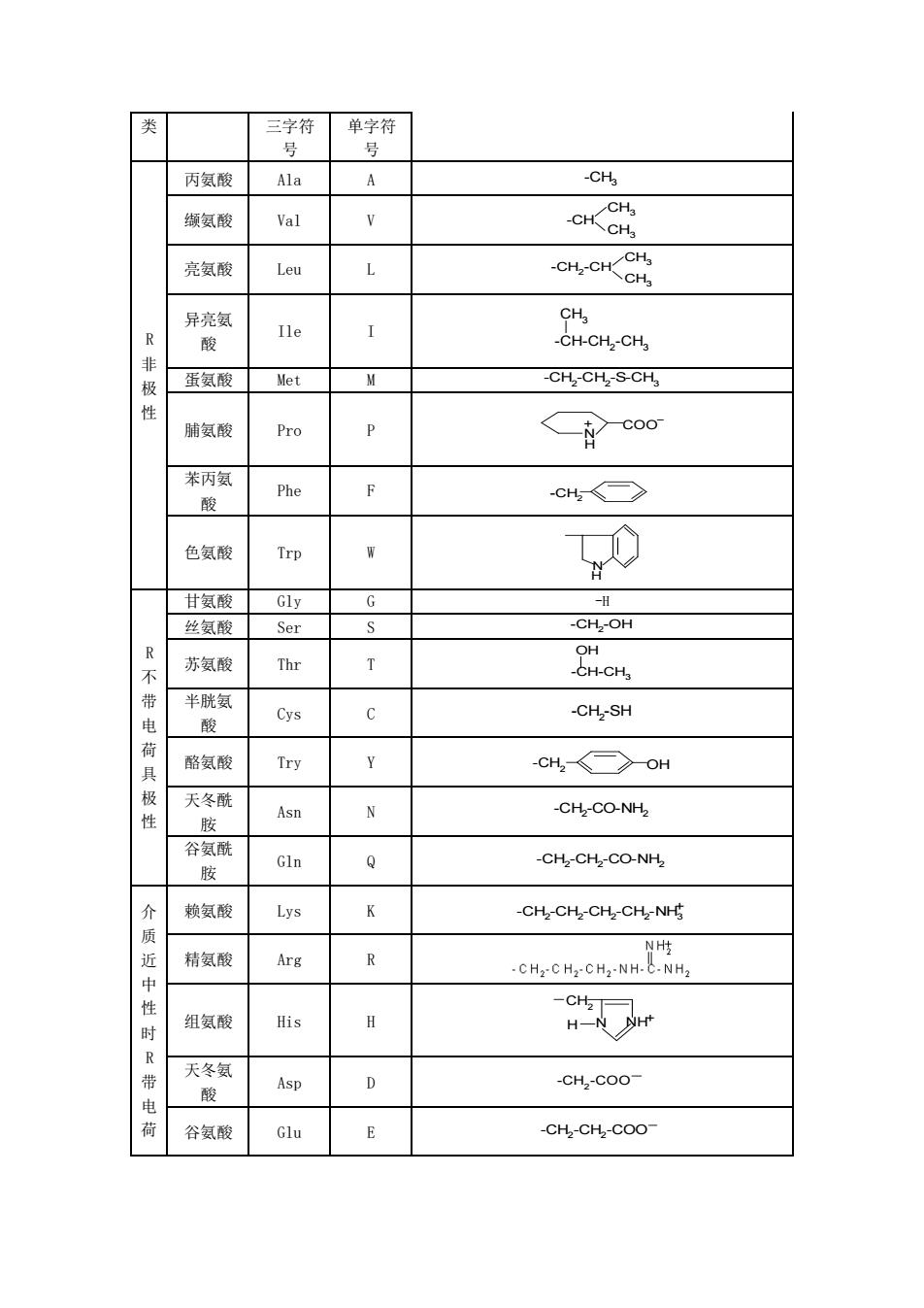
类 三字符号 单字符号 R非极性 丙氨酸 Al a A - C H 3 缬氨酸 Val V - C H C H 3 C H 3 亮氨酸 Leu L - C H 2 - C H C H 3 C H 3 异亮氨酸 Ile I - C H - C H 2 - C H 3 C H 3 蛋氨酸 Met M - C H 2 - C H 2 - S - C H 3 脯氨酸 Pro P N C O O H+ 苯丙氨酸 Phe F - C H 2 色氨酸 Trp W NH R不带电荷具极性 甘氨酸 Gly G - H 丝氨酸 Ser S - C H 2 - O H 苏氨酸 Thr T - C H - C H 3 O H 半胱氨酸 Cys C - C H 2 - S H 酪氨酸 Try Y - C H 2 O H 天冬酰胺 Asn N - C H 2 - C O - N H 2 谷氨酰胺 Gln Q - C H 2 - C H 2 - C O - N H 2 介质近中性时R带电荷 赖氨酸 Lys K - C H 2 - C H 2 - C H 2 - C H 2 - N H 3+ 精氨酸 Arg R 组氨酸 His H N + C H 2 H N H 天冬氨酸 Asp D - C H 2 - C O O 谷氨酸 Glu E - C H 2 - C H 2 - C O O
类 三字符号 单字符号 R非极性 丙氨酸 Al a A - C H 3 缬氨酸 Val V - C H C H 3 C H 3 亮氨酸 Leu L - C H 2 - C H C H 3 C H 3 异亮氨酸 Ile I - C H - C H 2 - C H 3 C H 3 蛋氨酸 Met M - C H 2 - C H 2 - S - C H 3 脯氨酸 Pro P N C O O H+ 苯丙氨酸 Phe F - C H 2 色氨酸 Trp W NH R不带电荷具极性 甘氨酸 Gly G - H 丝氨酸 Ser S - C H 2 - O H 苏氨酸 Thr T - C H - C H 3 O H 半胱氨酸 Cys C - C H 2 - S H 酪氨酸 Try Y - C H 2 O H 天冬酰胺 Asn N - C H 2 - C O - N H 2 谷氨酰胺 Gln Q - C H 2 - C H 2 - C O - N H 2 介质近中性时R带电荷 赖氨酸 Lys K - C H 2 - C H 2 - C H 2 - C H 2 - N H 3+ 精氨酸 Arg R 组氨酸 His H N + C H 2 H N H 天冬氨酸 Asp D - C H 2 - C O O 谷氨酸 Glu E - C H 2 - C H 2 - C O O

4.2.2 蛋白质的分类和结构 按照化学组成,蛋白质通常可以分为简单蛋白质和结合蛋白质。简单蛋白质是水解后只 产生氨基酸的蛋白质;结合蛋白质是水解后不仅产生氨基酸,还产生其他有机或无机化合物 (如碳水化合物、脂质、核酸、金属离子等)的蛋白质。结合蛋白质的非氨基酸部分称为辅 基。 简单蛋白质(simpleproteins)可分为: ①清蛋白(albumins):溶于水及稀盐、稀酸或稀碱溶液,能被饱和硫酸铵所沉淀,加 热可凝固。广泛存在于生物体内,如血清蛋白、乳清蛋白、蛋清蛋白等。 ②球蛋白(globulins):不溶于水而溶于稀盐、稀酸和稀碱溶液,能被半饱和硫酸铵所 沉淀。普遍存在于生物体内,如血清球蛋白、肌球蛋白和植物种子球蛋白等。 ③谷蛋白(glutelins):不溶于水、乙醇及中性盐溶液,但易溶于稀酸或稀碱。如米谷蛋 白和麦谷蛋白等。 ④醇溶谷蛋白(prolamines):不溶于水及无水乙醇,但溶于 70%~80%乙醇、稀酸和 稀碱。分子中脯氨酸和酰胺较多,非极性侧链远较极性侧链多。这类蛋白质主要存在于谷物 种子中,如玉米醇溶蛋白、麦醇溶蛋白等。 ⑤组蛋白(histones):溶于水及稀酸,但为稀氨水所沉淀。分子中组氨酸、赖氨酸较多, 分子呈碱性,如小牛胸腺组蛋白等。 ⑥鱼精蛋白(protamines):溶于水及稀酸,不溶于氨水。分子中碱性氨基酸(精氨酸和 赖氨酸)特别多,因此呈碱性,如鲑精蛋白等。 ⑦硬蛋白(scleroprotein):不溶于水、盐、稀酸或稀碱。这类蛋白质是动物体内作为结 缔组织及保护功能的蛋白质,如角蛋白、胶原、网硬蛋白和弹性蛋白等。 根据辅基的不同,结合蛋白质(conjugated proteins)可分为: ①核蛋白(nucleoproteins):辅基是核酸,如脱氧核糖核蛋白、核糖体、烟草花叶病毒 等。 ②脂蛋白(1ipoproteins):与脂质结合的蛋白质。脂质成分有磷脂、固醇和中性脂等, 如血液中的β1—脂蛋白、卵黄球蛋白等。 ③糖蛋白和黏蛋白(glycoproteins):辅基成分为半乳糖、甘露糖、己糖胺、己糖醛酸、 唾液酸、硫酸或磷酸等中的一种或多种。糖蛋白可溶于碱性溶液中,如卵清蛋白、γ—球蛋 白、血清类黏蛋白等。 ④磷蛋白(phosphoproteins):磷酸基通过酯键与蛋白质中的丝氨酸或苏氨酸残基侧链 的羟基相连,如酪蛋白、胃蛋白酶等。 ⑤血红素蛋白(hemoproteins):辅基为血红素。含铁的如血红蛋白、细胞色素 c,含镁 的有叶绿蛋白,含铜的有血蓝蛋白等。 ⑥黄素蛋白(flavoproteins):辅基为黄素腺嘌呤二核苷酸,如琥珀酸脱氢酶、D—氨基 酸氧化酶等。 ⑦金属蛋白(metalioproteins):与金属直接结合的蛋白质,如铁蛋白含铁,乙醇脱氢酶 含锌,黄嘌呤氧化酶含钼和铁等。 蛋白质按其分子形状分为球状蛋白质和纤维状蛋白质两大类。球状蛋白质,分子对称性 佳,外形接近球状或椭球状,溶解度较好,能结晶,大多数蛋白质属于这一类。纤维状蛋白 质,对称性差,分子类似细棒或纤维,它又可分成可溶性纤维状蛋白质,如肌球蛋白、血纤
4.2.2 蛋白质的分类和结构 按照化学组成,蛋白质通常可以分为简单蛋白质和结合蛋白质。简单蛋白质是水解后只 产生氨基酸的蛋白质;结合蛋白质是水解后不仅产生氨基酸,还产生其他有机或无机化合物 (如碳水化合物、脂质、核酸、金属离子等)的蛋白质。结合蛋白质的非氨基酸部分称为辅 基。 简单蛋白质(simpleproteins)可分为: ①清蛋白(albumins):溶于水及稀盐、稀酸或稀碱溶液,能被饱和硫酸铵所沉淀,加 热可凝固。广泛存在于生物体内,如血清蛋白、乳清蛋白、蛋清蛋白等。 ②球蛋白(globulins):不溶于水而溶于稀盐、稀酸和稀碱溶液,能被半饱和硫酸铵所 沉淀。普遍存在于生物体内,如血清球蛋白、肌球蛋白和植物种子球蛋白等。 ③谷蛋白(glutelins):不溶于水、乙醇及中性盐溶液,但易溶于稀酸或稀碱。如米谷蛋 白和麦谷蛋白等。 ④醇溶谷蛋白(prolamines):不溶于水及无水乙醇,但溶于 70%~80%乙醇、稀酸和 稀碱。分子中脯氨酸和酰胺较多,非极性侧链远较极性侧链多。这类蛋白质主要存在于谷物 种子中,如玉米醇溶蛋白、麦醇溶蛋白等。 ⑤组蛋白(histones):溶于水及稀酸,但为稀氨水所沉淀。分子中组氨酸、赖氨酸较多, 分子呈碱性,如小牛胸腺组蛋白等。 ⑥鱼精蛋白(protamines):溶于水及稀酸,不溶于氨水。分子中碱性氨基酸(精氨酸和 赖氨酸)特别多,因此呈碱性,如鲑精蛋白等。 ⑦硬蛋白(scleroprotein):不溶于水、盐、稀酸或稀碱。这类蛋白质是动物体内作为结 缔组织及保护功能的蛋白质,如角蛋白、胶原、网硬蛋白和弹性蛋白等。 根据辅基的不同,结合蛋白质(conjugated proteins)可分为: ①核蛋白(nucleoproteins):辅基是核酸,如脱氧核糖核蛋白、核糖体、烟草花叶病毒 等。 ②脂蛋白(1ipoproteins):与脂质结合的蛋白质。脂质成分有磷脂、固醇和中性脂等, 如血液中的β1—脂蛋白、卵黄球蛋白等。 ③糖蛋白和黏蛋白(glycoproteins):辅基成分为半乳糖、甘露糖、己糖胺、己糖醛酸、 唾液酸、硫酸或磷酸等中的一种或多种。糖蛋白可溶于碱性溶液中,如卵清蛋白、γ—球蛋 白、血清类黏蛋白等。 ④磷蛋白(phosphoproteins):磷酸基通过酯键与蛋白质中的丝氨酸或苏氨酸残基侧链 的羟基相连,如酪蛋白、胃蛋白酶等。 ⑤血红素蛋白(hemoproteins):辅基为血红素。含铁的如血红蛋白、细胞色素 c,含镁 的有叶绿蛋白,含铜的有血蓝蛋白等。 ⑥黄素蛋白(flavoproteins):辅基为黄素腺嘌呤二核苷酸,如琥珀酸脱氢酶、D—氨基 酸氧化酶等。 ⑦金属蛋白(metalioproteins):与金属直接结合的蛋白质,如铁蛋白含铁,乙醇脱氢酶 含锌,黄嘌呤氧化酶含钼和铁等。 蛋白质按其分子形状分为球状蛋白质和纤维状蛋白质两大类。球状蛋白质,分子对称性 佳,外形接近球状或椭球状,溶解度较好,能结晶,大多数蛋白质属于这一类。纤维状蛋白 质,对称性差,分子类似细棒或纤维,它又可分成可溶性纤维状蛋白质,如肌球蛋白、血纤
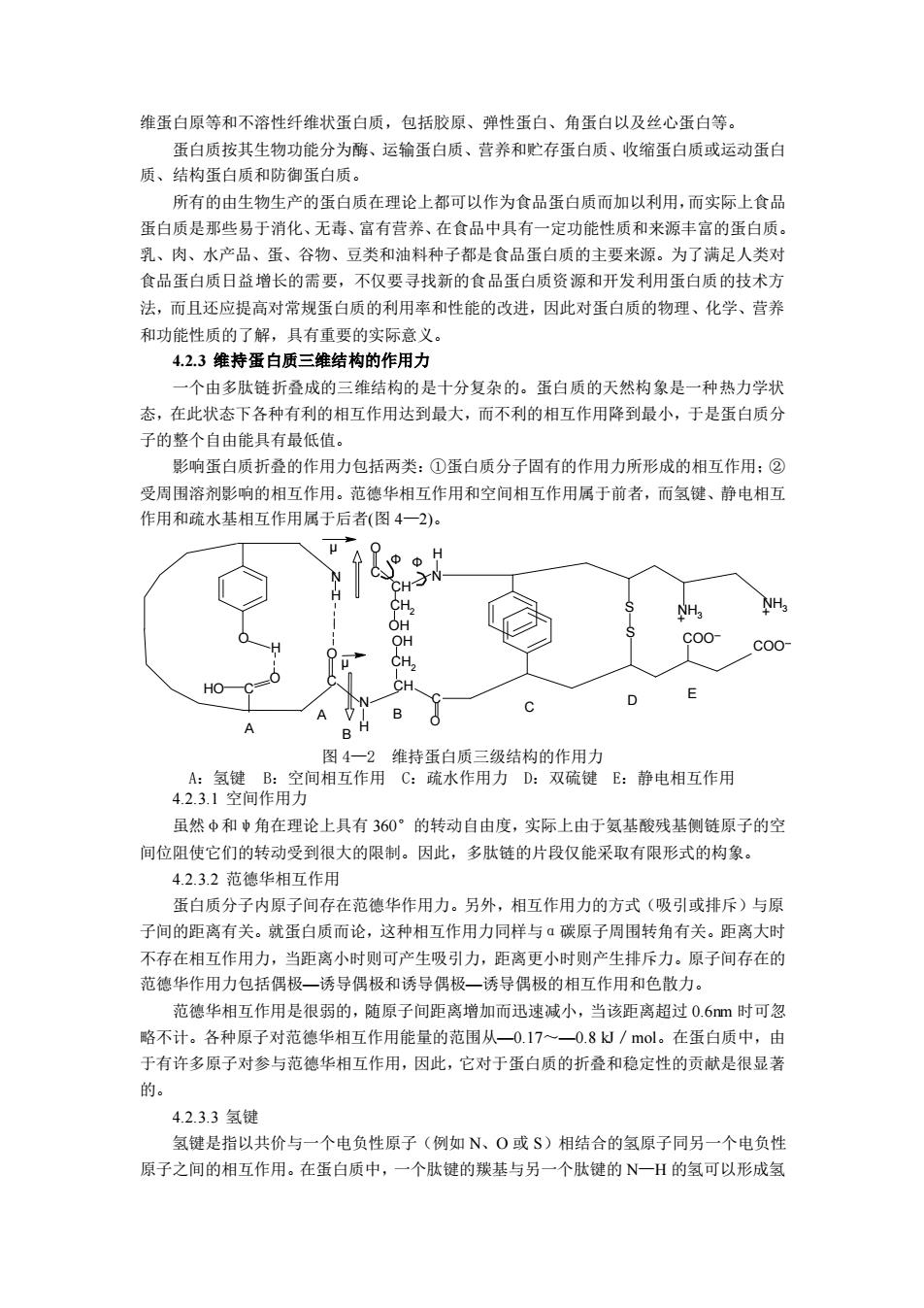
维蛋白原等和不溶性纤维状蛋白质,包括胶原、弹性蛋白、角蛋白以及丝心蛋白等。 蛋白质按其生物功能分为酶、运输蛋白质、营养和贮存蛋白质、收缩蛋白质或运动蛋白 质、结构蛋白质和防御蛋白质。 所有的由生物生产的蛋白质在理论上都可以作为食品蛋白质而加以利用,而实际上食品 蛋白质是那些易于消化、无毒、富有营养、在食品中具有一定功能性质和来源丰富的蛋白质。 乳、肉、水产品、蛋、谷物、豆类和油料种子都是食品蛋白质的主要来源。为了满足人类对 食品蛋白质日益增长的需要,不仅要寻找新的食品蛋白质资源和开发利用蛋白质的技术方 法,而且还应提高对常规蛋白质的利用率和性能的改进,因此对蛋白质的物理、化学、营养 和功能性质的了解,具有重要的实际意义。 4.2.3 维持蛋白质三维结构的作用力 一个由多肽链折叠成的三维结构的是十分复杂的。蛋白质的天然构象是一种热力学状 态,在此状态下各种有利的相互作用达到最大,而不利的相互作用降到最小,于是蛋白质分 子的整个自由能具有最低值。 影响蛋白质折叠的作用力包括两类:①蛋白质分子固有的作用力所形成的相互作用;② 受周围溶剂影响的相互作用。范德华相互作用和空间相互作用属于前者,而氢键、静电相互 作用和疏水基相互作用属于后者(图 4—2)。 O H HO C O N N H H C O OH OH CH2 CH2 CH CH C O C O N S S NH3 COO + NH3 COO + H Ф μ μ Ф A B C D E A B 图 4—2 维持蛋白质三级结构的作用力 A:氢键 B:空间相互作用 C:疏水作用力 D:双硫键 E:静电相互作用 4.2.3.1 空间作用力 虽然φ和ψ角在理论上具有 360°的转动自由度,实际上由于氨基酸残基侧链原子的空 间位阻使它们的转动受到很大的限制。因此,多肽链的片段仅能采取有限形式的构象。 4.2.3.2 范德华相互作用 蛋白质分子内原子间存在范德华作用力。另外,相互作用力的方式(吸引或排斥)与原 子间的距离有关。就蛋白质而论,这种相互作用力同样与α碳原子周围转角有关。距离大时 不存在相互作用力,当距离小时则可产生吸引力,距离更小时则产生排斥力。原子间存在的 范德华作用力包括偶极—诱导偶极和诱导偶极—诱导偶极的相互作用和色散力。 范德华相互作用是很弱的,随原子间距离增加而迅速减小,当该距离超过 0.6nm 时可忽 略不计。各种原子对范德华相互作用能量的范围从—0.17~—0.8 kJ/mol。在蛋白质中,由 于有许多原子对参与范德华相互作用,因此,它对于蛋白质的折叠和稳定性的贡献是很显著 的。 4.2.3.3 氢键 氢键是指以共价与一个电负性原子(例如 N、O 或 S)相结合的氢原子同另一个电负性 原子之间的相互作用。在蛋白质中,一个肽键的羰基与另一个肽键的 N—H 的氢可以形成氢
维蛋白原等和不溶性纤维状蛋白质,包括胶原、弹性蛋白、角蛋白以及丝心蛋白等。 蛋白质按其生物功能分为酶、运输蛋白质、营养和贮存蛋白质、收缩蛋白质或运动蛋白 质、结构蛋白质和防御蛋白质。 所有的由生物生产的蛋白质在理论上都可以作为食品蛋白质而加以利用,而实际上食品 蛋白质是那些易于消化、无毒、富有营养、在食品中具有一定功能性质和来源丰富的蛋白质。 乳、肉、水产品、蛋、谷物、豆类和油料种子都是食品蛋白质的主要来源。为了满足人类对 食品蛋白质日益增长的需要,不仅要寻找新的食品蛋白质资源和开发利用蛋白质的技术方 法,而且还应提高对常规蛋白质的利用率和性能的改进,因此对蛋白质的物理、化学、营养 和功能性质的了解,具有重要的实际意义。 4.2.3 维持蛋白质三维结构的作用力 一个由多肽链折叠成的三维结构的是十分复杂的。蛋白质的天然构象是一种热力学状 态,在此状态下各种有利的相互作用达到最大,而不利的相互作用降到最小,于是蛋白质分 子的整个自由能具有最低值。 影响蛋白质折叠的作用力包括两类:①蛋白质分子固有的作用力所形成的相互作用;② 受周围溶剂影响的相互作用。范德华相互作用和空间相互作用属于前者,而氢键、静电相互 作用和疏水基相互作用属于后者(图 4—2)。 O H HO C O N N H H C O OH OH CH2 CH2 CH CH C O C O N S S NH3 COO + NH3 COO + H Ф μ μ Ф A B C D E A B 图 4—2 维持蛋白质三级结构的作用力 A:氢键 B:空间相互作用 C:疏水作用力 D:双硫键 E:静电相互作用 4.2.3.1 空间作用力 虽然φ和ψ角在理论上具有 360°的转动自由度,实际上由于氨基酸残基侧链原子的空 间位阻使它们的转动受到很大的限制。因此,多肽链的片段仅能采取有限形式的构象。 4.2.3.2 范德华相互作用 蛋白质分子内原子间存在范德华作用力。另外,相互作用力的方式(吸引或排斥)与原 子间的距离有关。就蛋白质而论,这种相互作用力同样与α碳原子周围转角有关。距离大时 不存在相互作用力,当距离小时则可产生吸引力,距离更小时则产生排斥力。原子间存在的 范德华作用力包括偶极—诱导偶极和诱导偶极—诱导偶极的相互作用和色散力。 范德华相互作用是很弱的,随原子间距离增加而迅速减小,当该距离超过 0.6nm 时可忽 略不计。各种原子对范德华相互作用能量的范围从—0.17~—0.8 kJ/mol。在蛋白质中,由 于有许多原子对参与范德华相互作用,因此,它对于蛋白质的折叠和稳定性的贡献是很显著 的。 4.2.3.3 氢键 氢键是指以共价与一个电负性原子(例如 N、O 或 S)相结合的氢原子同另一个电负性 原子之间的相互作用。在蛋白质中,一个肽键的羰基与另一个肽键的 N—H 的氢可以形成氢

键。氢键距离 O.H 约 1.75Å,键能量约为 8~40kJ/mol。 氢键对于稳定α螺旋和β折叠的二级结构和三级结构起着主要作用。氨基酸的极性基团 位于蛋白质分子表面,可以和水分子形成许多个氢键,因此氢键有利于某些蛋白质的结构保 持稳定和溶解度增加。 4.2.3.4 静电相互作用力 蛋白质可以看成是多聚电解质,因为氨基酸的侧链(如天冬氨酸、谷氨酸、酪氨酸、赖 氨酸、组氨酸、精氨酸、半胱氨酸)以及碳和氮末端氨基酸的可解离基团参与酸碱平衡,肽 键中的α氨基和α羧基在蛋白质的离子性中只占很小的一部分。可解离的基团能产生使二级 结构或三级结构稳定的吸引力或排斥力,例如天冬氨酸和谷氨酸的β和γ羧基、C 末端氨基 酸和羧基通常带有负电荷;赖氨酸的ε氨基、N 末端氨基酸的α氨基、精氨酸的胍基和组氨 酸的咪唑基等带有正电荷。静电相互作用能量范围为 42~84kJ/mol。 某些离子—蛋白质的相互作用有利于蛋白质四级结构的稳定,蛋白质—Ca2+—蛋白质型 的静电相互作用力对维持酪蛋白胶束的稳定性起着重要作用。在某些情况下,离子—蛋白质 的复合物还可产生生物活性,像铁的运载或酶活性。通常,离子在蛋白质分子一定的位点上 结合,过渡金属离子(Cr、Mn、Fe、Cu、Zn、Hg 等)可同时通过部分离子键与几种氨基 酸的咪唑基和巯基结合。 4.2.3.5 疏水作用力 蛋白质分子的极性相互作用是非常不稳定的,蛋白质的稳定性取决于能否保持在一个非 极性的环境中。驱动蛋白质折叠的重要力量来自于非极性基团的疏水作用力。 在水溶液中,非极性基团之间的疏水作用力是水与非极性基团之间热力学上不利的相互 作用的结果。在水溶液中非极性基团倾向于聚集,使得与水直接接触的面积降至最低。水结 构诱导的水溶液中非极性基团的相互作用被称为疏水相互作用。在蛋白质中,氨基酸残基非 极性侧链之间的疏水作用力是蛋白质折叠成独特的三维结构的主要因素。 4.2.3.6 二硫键 二硫键是天然存在于蛋白质中唯一的共价侧链交联,它们既能存在于分子内,也能存在 于分子间。在单体蛋白质中,二硫键的形成是蛋白质折叠的结果。当两个 Cys 残基接近并 适当定向时,在分子氧的氧化作用下形成二硫键。二硫键的形成能帮助稳定蛋白质的折叠结 构。 某些蛋白质含有半胱氨酸和胱氨酸残基,能够发生巯基和二硫键的交换反应。 总之,一个独特的三维蛋白质结构的形成是各种排斥和吸引的非共价相互作用以及几个 共价二硫键作用的结果。 4.3 蛋白质在食品加工中的功能性质 蛋白质的功能性质(functionality)是指在食品加工、贮藏和销售过程中蛋白质对食品 需宜特征做出贡献的那些物理和化学性质。可分为 3 个主要方面: (1)水化性质 取决于蛋白质与水的相互作用,包括水的吸收与保留、湿润性、溶胀、黏着性、分散性、 溶解度和黏度等。 (2)蛋白质——蛋白质相互作用有关的性质 指控制沉淀、胶凝和形成各种其它结构时起作用的那些性质。 (3)表面性质
键。氢键距离 O.H 约 1.75Å,键能量约为 8~40kJ/mol。 氢键对于稳定α螺旋和β折叠的二级结构和三级结构起着主要作用。氨基酸的极性基团 位于蛋白质分子表面,可以和水分子形成许多个氢键,因此氢键有利于某些蛋白质的结构保 持稳定和溶解度增加。 4.2.3.4 静电相互作用力 蛋白质可以看成是多聚电解质,因为氨基酸的侧链(如天冬氨酸、谷氨酸、酪氨酸、赖 氨酸、组氨酸、精氨酸、半胱氨酸)以及碳和氮末端氨基酸的可解离基团参与酸碱平衡,肽 键中的α氨基和α羧基在蛋白质的离子性中只占很小的一部分。可解离的基团能产生使二级 结构或三级结构稳定的吸引力或排斥力,例如天冬氨酸和谷氨酸的β和γ羧基、C 末端氨基 酸和羧基通常带有负电荷;赖氨酸的ε氨基、N 末端氨基酸的α氨基、精氨酸的胍基和组氨 酸的咪唑基等带有正电荷。静电相互作用能量范围为 42~84kJ/mol。 某些离子—蛋白质的相互作用有利于蛋白质四级结构的稳定,蛋白质—Ca2+—蛋白质型 的静电相互作用力对维持酪蛋白胶束的稳定性起着重要作用。在某些情况下,离子—蛋白质 的复合物还可产生生物活性,像铁的运载或酶活性。通常,离子在蛋白质分子一定的位点上 结合,过渡金属离子(Cr、Mn、Fe、Cu、Zn、Hg 等)可同时通过部分离子键与几种氨基 酸的咪唑基和巯基结合。 4.2.3.5 疏水作用力 蛋白质分子的极性相互作用是非常不稳定的,蛋白质的稳定性取决于能否保持在一个非 极性的环境中。驱动蛋白质折叠的重要力量来自于非极性基团的疏水作用力。 在水溶液中,非极性基团之间的疏水作用力是水与非极性基团之间热力学上不利的相互 作用的结果。在水溶液中非极性基团倾向于聚集,使得与水直接接触的面积降至最低。水结 构诱导的水溶液中非极性基团的相互作用被称为疏水相互作用。在蛋白质中,氨基酸残基非 极性侧链之间的疏水作用力是蛋白质折叠成独特的三维结构的主要因素。 4.2.3.6 二硫键 二硫键是天然存在于蛋白质中唯一的共价侧链交联,它们既能存在于分子内,也能存在 于分子间。在单体蛋白质中,二硫键的形成是蛋白质折叠的结果。当两个 Cys 残基接近并 适当定向时,在分子氧的氧化作用下形成二硫键。二硫键的形成能帮助稳定蛋白质的折叠结 构。 某些蛋白质含有半胱氨酸和胱氨酸残基,能够发生巯基和二硫键的交换反应。 总之,一个独特的三维蛋白质结构的形成是各种排斥和吸引的非共价相互作用以及几个 共价二硫键作用的结果。 4.3 蛋白质在食品加工中的功能性质 蛋白质的功能性质(functionality)是指在食品加工、贮藏和销售过程中蛋白质对食品 需宜特征做出贡献的那些物理和化学性质。可分为 3 个主要方面: (1)水化性质 取决于蛋白质与水的相互作用,包括水的吸收与保留、湿润性、溶胀、黏着性、分散性、 溶解度和黏度等。 (2)蛋白质——蛋白质相互作用有关的性质 指控制沉淀、胶凝和形成各种其它结构时起作用的那些性质。 (3)表面性质