
考九帝装基化合物97 第九章 碳基化合物 一、内容提要 (一)醛,酮的结构和命名 碳基C0是醛,闺的官能团。候基碳以三个罗杂化轨道分别与氧及其它两个 原子(碳原子或氢原子)构成三个σ-链:碳原子上未杂化的P轨道和氧原子上的轨道在 侧血重叠形成键(氧乐子上还有两个瓢电了对)。基是极性不饱和基团,碳原了书 部分正电荷,有利丁亲核试剂的进攻而发生亲核性加成反应, 酮的系统命名法与醇相似,主链编号时给基最小数。不饱和醛、酮及多元醒 酮的命名原测也与不饱和醇、多元醇相似。 【二)醛围的反应 醛、酮的反应主要表现在以下几方面: ①联基的亲核加成反应 必能及。活流氢的反因 氧化,还泉反应 活性氢 ④其它反成 1.亲核加成反应 不同结构的醛牌洗行亲枝加成反应时,其活性受电性效利空间效应两种因素的 影响。在脂肪族醛,酮系列中,反应活性次序为: 0 0 HC H>RCH>RC CH R C R 芳香疾系列中,其活性受环上取代基性质的影响。吸电子基使骤基活性增加,供电 子基使羡基活性降低。 醛刷的亲核加成反应,根据加成试剂的不同,大致可分为以下三种类型: (I)简单加成:醛附与HCN.NaHSO,、RC一CNaR-MgX等的加成属于该类型,其 机理可用通式表示如下: 朝负实子中间体成产物 PDF created with pdfFactory trial version www.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
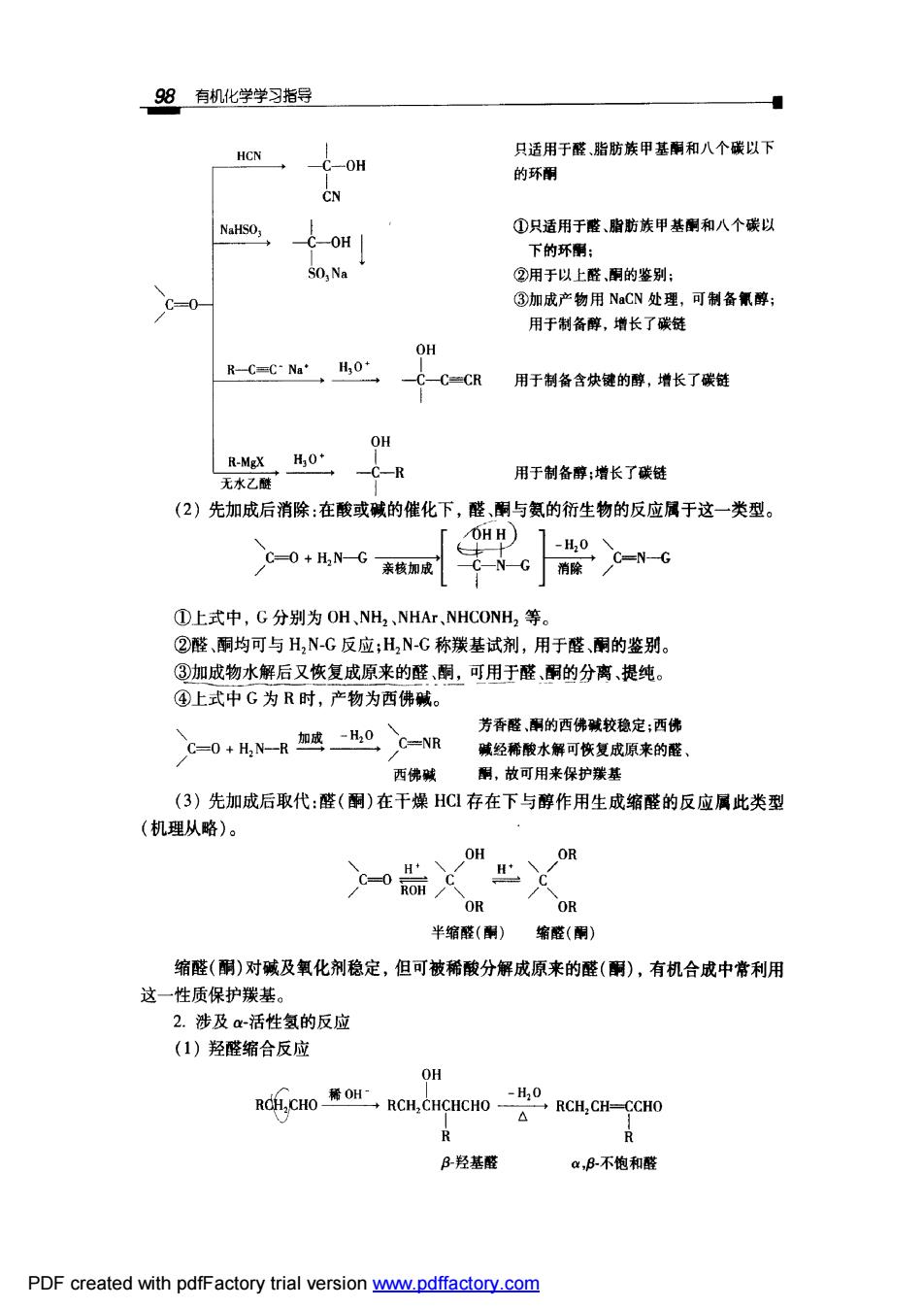
98有机化学学习指导 HCN 只话用于醛脂肪鞋甲基酮和八个碳以下 C-OH 的环酮 NaHSO, ①只适用于酸、脂肪族甲基酮和八个碳以 下的环 50,Na ②用于以上醛酮的鉴别 ③加成产物用NaCN处理,可制备氰醇; 用于制备醇,增长了碳链 OH R-C=C-Na'H30* -C-C-CR 用于制备含块键的醇,增长了碳链 -C-R 用于制备醇:增长了碳链 (2)先加成后消除:在酸或碱的催化下,醛、酮与氨的衍生物的反应属于这一类型。 OHH 心0+成N-G亲转如成 -H,0 ①上式中,G分别为OH、NH,、NHAr,NHCONH,等。 ②醛、酮均可与H,N-G反应;H2N-C称羰基试剂,用于醛、酮的鉴别。 ③加成物水解后又恢复成原来的醛、酮,可用于醛酮的分离、提纯 ④上式中G为R时,产物为西佛碱。 芳香醛,的西佛碱较稳定:西佛 碱经稀酸水解可恢复成原来的醛 西佛碱 酮,放可用来保护羰基 (3)先加成后取代:醛(酮)在干燥HC存在下与醇作用生成缩醛的反应属此类型 (机理从略)。 H OH OR 半缩醛(酮)缩醛(酮) 缩醛(酮)对碱及氧化剂稳定,但可被稀酸分解成原来的醛(酮),有机合成中常利用 这一性质保护基 2.涉及c活性氢的反应 (1)羟醛缩合反应 OH RCH,CH-CH B羟基醛 a,B不饱和醛 PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

第九章族墓化合物99 1)机理:稀碱催化下的羟醛缩合反应机理:(酸催化机理从略》 O+RCHCHO- ±RCHCHO←◆RCH=CHO] Re2:+G0-一kcH-gCO 0 RC-CCO RCCOCCO OH H R R R B羟基醛 a,B-不饱和醛 2)用途:制备B羟基醛(酮)或4,B不饱和醛(酮),且碳数成倍增加。 3)交叉羟醛缩合:一分子具有α活性氢的醛(酮)与另一分子不具有活性氢的醛 酮之间的缩合,产物单一,有制备意义。 4)分子内羟醛缩合:可用来合成5-7元环状化合物。 (2)卤代反应 1)酸催化的卤代反应是通过烯醇进行的,可停留在一卤代阶段,有制备意义。 2)碱催化的卤代反应是通过烯醇负离子进行的,往往得多卤代产物。甲基酮的多 0 卤代产物,发生碳键断裂后,生成卤仿和少一个碳的羧酸,可用于含CH,C及 OH CH,CH一的化合物的鉴别及制备羧酸。 3.氧化、还原反应 醛,酮的氧化、还原反应按试剂归纳如下: 说明 试剂 Ag(NH,):' -CHO 一一0ONH+Ag!魔反应,雨不反应,可区别醛和弱, 分子中烯健不受影响 Fehling试剂 CH0一一C00+Cu,0!脂防酸易反应,芳香醛难反应,可用 Cu/OH 于区别脂肪醛和芳香醛:分子中双 KMnO,/H°或 不受影响 -CHO→-COOH 分子中摇键也被氧化 NaCr,O,/H* 7n-He/浓HC =0 CH, Clemmensen还原,适用于对酸稳定的 H:NNH/OH/ 化 CH, 黄鸥龙还原,适用于对 (HOCH.CH,):O/A 碱稳定的化合物 2 C- Me/Hg非质子溶剂 C-0 酮的双分子还原,可制备邻二醇 PDF created with pdfFactory trial version www.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

100有机化学学习指导 Cannirzaro反应,只限于无c-氢的醛 浓OH 2RCHO一RCO0+RCH,0H甲醛与其它无a氢的醛反应时,总是 甲醛被氧化成酸 4.其它反应 R, Wittig反应:C=0+(C,H,),P9C© ,C=C 用于制备烯烃 R 0 Darn反应:RCH(R')+XCH,C0,CH,NoCL -CHCO,C,H, (R)H 用于制备αB环氧酸酯,产物可转化为比原料醛、酮增加一个碳的醛、酮 OH O Beia缩合:2Ar一CH0 KCX Ar CH-C∠A 产物为羟基酮 (三)aB-不饱和醛、酮的反应 除具有烯键和羰基的一般反应外,因羰基与烯键形成共轭体系,还可发生1,4加成 反应。现将其反应归纳如下: 试剂 说明 HNu(HCN,NaHSO,、胺及 NH,OH等) 1,4亲核加成为主,产物适式)。CC一0 Nu R-MgX 得1,4和1,2加成产物混合物,其主要产物受试剂的体积,基附近 的位阻大小反应条件等影响 X.HOX 只发生双键的亲电加成 y H ①为Mhad加成反应,产物通式cH-CC一C0 y-CH2-y'/碱 ②与y'为-C0,R、一C0R、一CN,一NO,等吸电子基 ③碱常用R一ONa,NaNH,等 共瓶二桥 发生D一A反应,是制备六元环的常用方法 H,/Ni(pdt等) 烯健、基同时被还原,也可控制反应条件,选择性还原双健 LiAIH,、NaBH,异丙醇铝 可选择性将C-0还原成CH,0H:异丙醇铝还原的反应称Mcr Wein-Ponndorf还原 (四)醛、酮的制备 1,官能团转化法 醇的氧化:烯、炔转化;芳烃侧链的控制氧化(氧化剂为M0,/H,S0,、C0, (CH,C0),0等);Rosenmund还原法。 PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

第九章碳基化合物101 2.向分子中直接引入羰基 F-一C酰化反应制备得芳酮;Fies重排反应制得酚酮;Reimer-Timann的反应制备酚 醛;Gettermann-koch反应制备芳醛(环上有烷基、酚等不宜用此法,甲基、甲氧基时一CHO 主要进人原官能团对位);含有强钝化基团时,不发生反应。 此外,通过羟醛缩合(包括交叉羟醛缩合及分子内羟醛编合)也可获得相应的基化 合物。 二、例题解析 [例1]根据题意回答问题。 1.与HCN加成的反应活性: 0,9) (1)CH,CHO (2)C H,COCH,(3)CH,COCH,(4)C.H,COC,H 2.化合物的pKa值: (1)CH,CH,CHO (2)CH,COCH,COCH,(3)CH,COCHCOC H, (4)C.H.COCH.COC.H. 解:L.HCN与醛、酮的反应属亲核加成反应,不同的醛、酮进行亲核加成反应时,其 活性受电性效应和空间位阻两种因素的影响。一般情况下,羰基的活性次序是:醛>酮, 脂肪醛>芳香醛,脂肪酮>芳香酮。 上述四个化合物除(1)是醛外,其余三个化合物均为酮,因此(1)的反应活性最大。 在(2)、(3)、(4)中,(3)是脂肪酮,(2)是芳脂酮,(4)是芳香酮,故四个化合物的反应 活性次序为:(1)>(3)>(2)>(4) 2.比较上述化合物的pKa值,就是比较羰基旁ac氢的酸性。a-氢的酸性取决于α 氢解离后生成的相应负离子的稳定性。酸性越强,pKa值越小;反之,pKa值越大。上述 四个化合物的α-氢解离后的负离子稳定性的次序为:(4)>(3)>(2)>(1)。 即-氢的酸性为上述次序,那么pKa值的大小次序为:(1)>(2)>(3)>(4) [例2]下列各步反应产物是否正确?若是错的,请给出正确答案,并简要说明 之 1C.H,CHO+CH,CH,COCH,CH,CH-CCOCH, CH. OH SO,Na PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com