
凭六草第经乏 第六章 一、内容提要 烯烃的通式为GH。,比烷烃少两个氢原子,是不饱和烃。碳碳双健也称烯键,是烯 烃的官能团 (一)结构 碳碳双提中的碳以中杂化轨道垂叠形成一个C一Cσ键,两个碳原子上未杂化的 轨道平行侧面重叠形成:锭。两个烯碳及与其相连的四个原子在同一平面上,例如乙烯 为半自分子、 键与σ健相比较有以下特点: 1.π电子云不是密集于两个原子核之间,而是分布在烯烃分子平面的上下,因此受 核的吸引力小、发生投化,化学性喷活泼 2,烯碳原子不能围绕CC旋转,因为旋转会使P轨道重叠程度减小,甚至破坏。 (二)同分异构体 烯烃除了碳架异构和C一(位置不同引起的位置异构外,因为双键不能自由旋转。 两个烯碳原子上各连有不问的原子或原子团的分子有顺反异构体,顺反异构体属于立体 异构体。 (1) (2) db)a≠b C-C d(b) c(a)e≠d 顺反异构体之向在室湘下不能相互转化.它们的理化性质也有差别。 (三】命名 【.选择合CC的最长链为主链,以此为丹体称某橘,编号时使表示C(位次的 数字最小,其数字放在某烯前面,其它原则与命名烷烃类似。 2.顺反异构体还需注明构型 (1)顺反构型标记法:只适用于烯箧两个碳原子上连有相同的原子或原子团的分 子。两个相同的原子或原子团处于双健同侧者为顺式,处于异侧者为反式。 4 6 C-C 限式 反式 (2)乙、E构型标记法:双键两侧若没有相同的原子或原子团时,则首先根据次序 PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

5免有机化学学习指导 规则,确定每个烯碳上基团的优先次序,若两个优先基团在双键的同侧称Z构型( 型),若在异侧称E构型(E型)。如: a、 a(e) b(d) a优于 C b(d) 6 a(c) c优于d 2型 R型 表示顺反异构体构型的符号应在该稀烃分子的名称前面。若分子中有几个具有顺反 异构的双键,在表示构型的符号前还应写上C=C的位次。 (四)化学反应 烯烃化学反应主要发生的部位如下: 加成反应和氧化反应 1.催化加氢 ①常用的催化剂(ca) P,P,活性等:②若反应在 加压下进行称高压氢化 2.亲电性如成版应 (1)主要反应 加H一X、HOS0,0H(H,S04)、H-OH、X2、次卤酸(实际用X2/H,0)和硼烷等的反 应如下: H-X 制备卤代铠 H X 反应速度H>HBr>HC HOSO,OH 间接水合制备酶 H OSO,OH H OH 直接水合制备醇,活性低的烯需高温和加压 C-C- HOH X 一制备邻二卤代烷 X又X=B鉴别C-C键 风0个大制备商 HO-X B,H OH 一C一C-顺式加成,没有重排产物,可得反马氏加成的醇 H OH PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
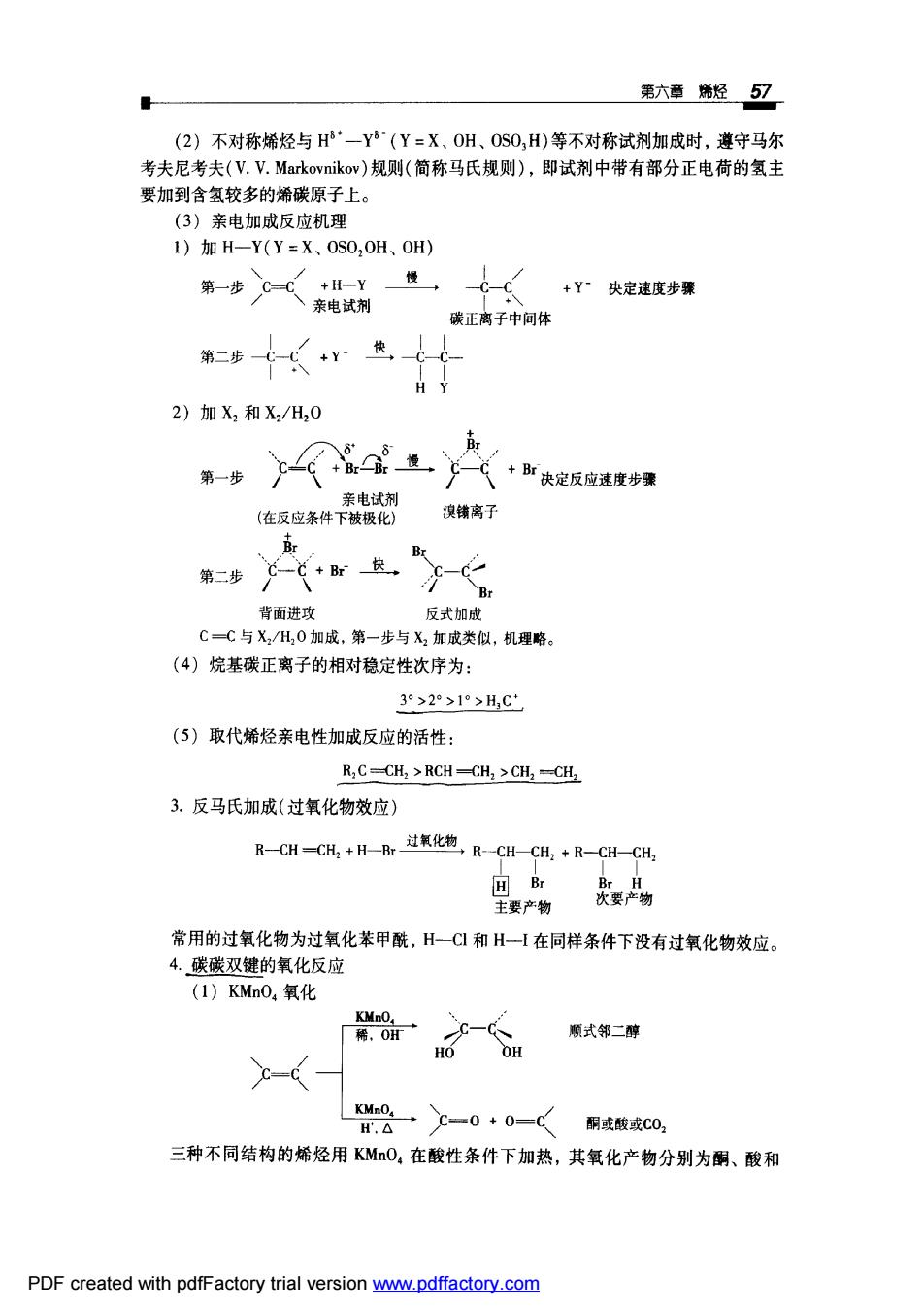
第六章烯烃57 (2)不对称烯经与H·一Y~(Y=X、0H、0S0,H)等不对称试剂加成时,遵守马尔 考夫尼考夫(V.V.Markovnikov)规则(简称马氏规则),即试剂中带有部分正电荷的氢主 要加到含氢较多的烯碳原子上。 (3)亲电加成反应机理 1)加H-Y(Y=X、0S0,0H、0H) 慢 +Y”决定速度步骤 碳正离子中间体 第二步 H Y 2)加X和X2/H,0 亲电试剂 (在反应条件下被极化 澳铺离子 Br 背面进攻 反式加成 CC与X,/H0加成,第一步与X2加成类似,机理略 (4)烷基碳正离子的相对稳定性次序为: 3°>2>1°>H,C (⑤)取代烯烃亲电性加成反应的活性 R,C-CH,>RCH-CH,>CH2-CH 3.反马氏加成(过氧化物效应) R-CH一CH+H-B过化电R-CH-CH,+R-CH-CH, 主要产物 大要物 常用的过氧化物为过氧化苯甲酰,H一C和H在同样条件下没有过氧化物效应。 4.碳碳双键的氧化反应 (1)KMn0,氧化 顺式邻二醇 -( 8-0+0- 酮或酸或C0 三种不同结构的烯烃用KMO,在酸性条件下加热,其氧化产物分别为酮、酸和 PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
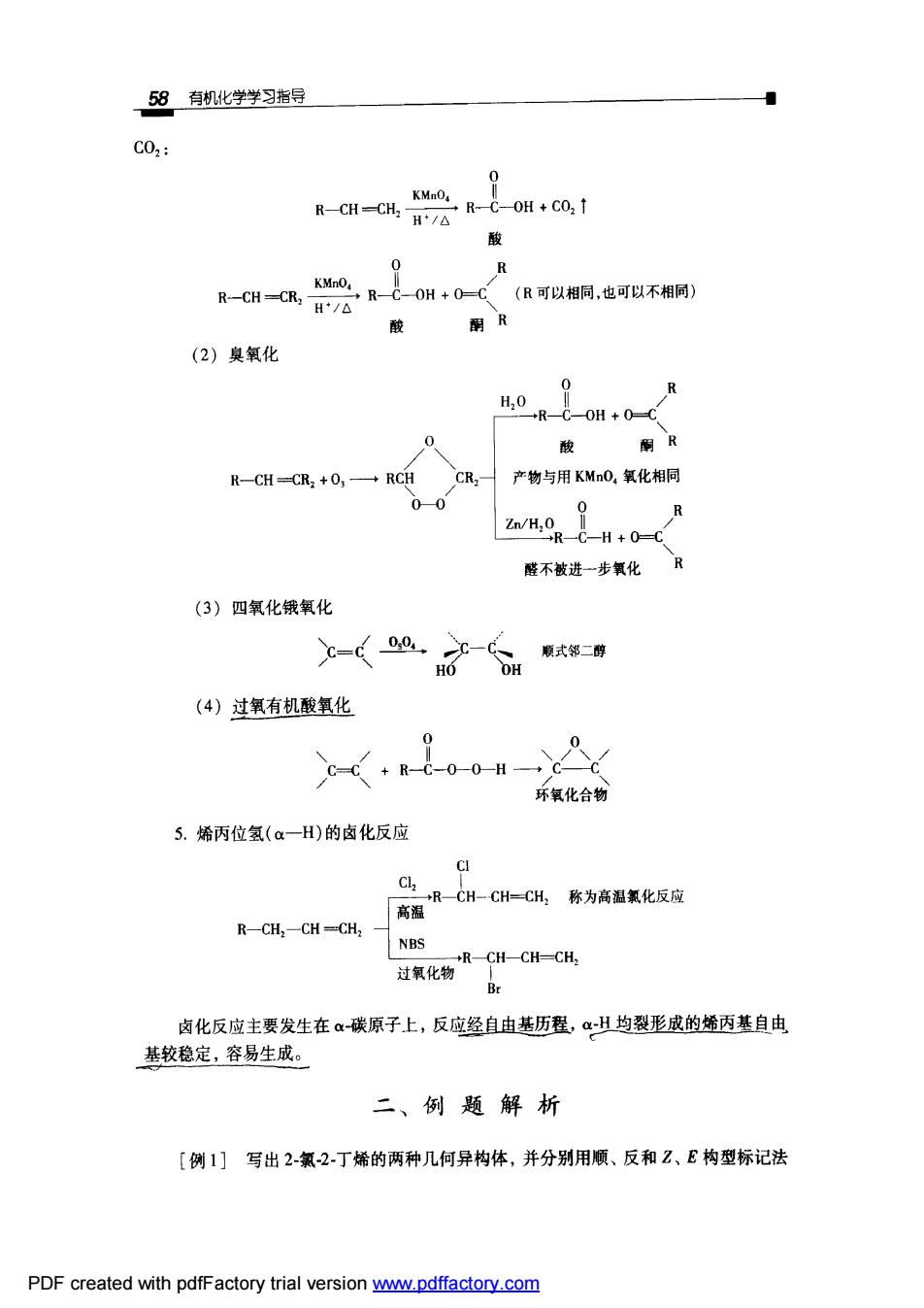
58有机化学学习指导 C02: 0 -. 0 R R-H=C,R-0H+0-(R可以相铜,也可不相同 H/△ 酸 酮R (2)臭氧化 0 0 酸 酮R R-CH=CR2+O,一RCH CR,产物与用KMnO,氧化相同 00 R 隆不被进一步氧化凡 (3)四氧化银氧化 (4)过氧有机酸氧化 环氧化合物 5.烯丙位氢(a一H)的卤化反应 R-CH:-CH-CH2 NBS 卤化反应主要发生在a碳原子上,反应经自由基历程,αH均裂形成的烯丙基自由 基较稳定,容易生成。 二、例题解析 [例1]写出2-氯2丁烯的两种几何异构体,并分别用顺、反和Z、E构型标记法 PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
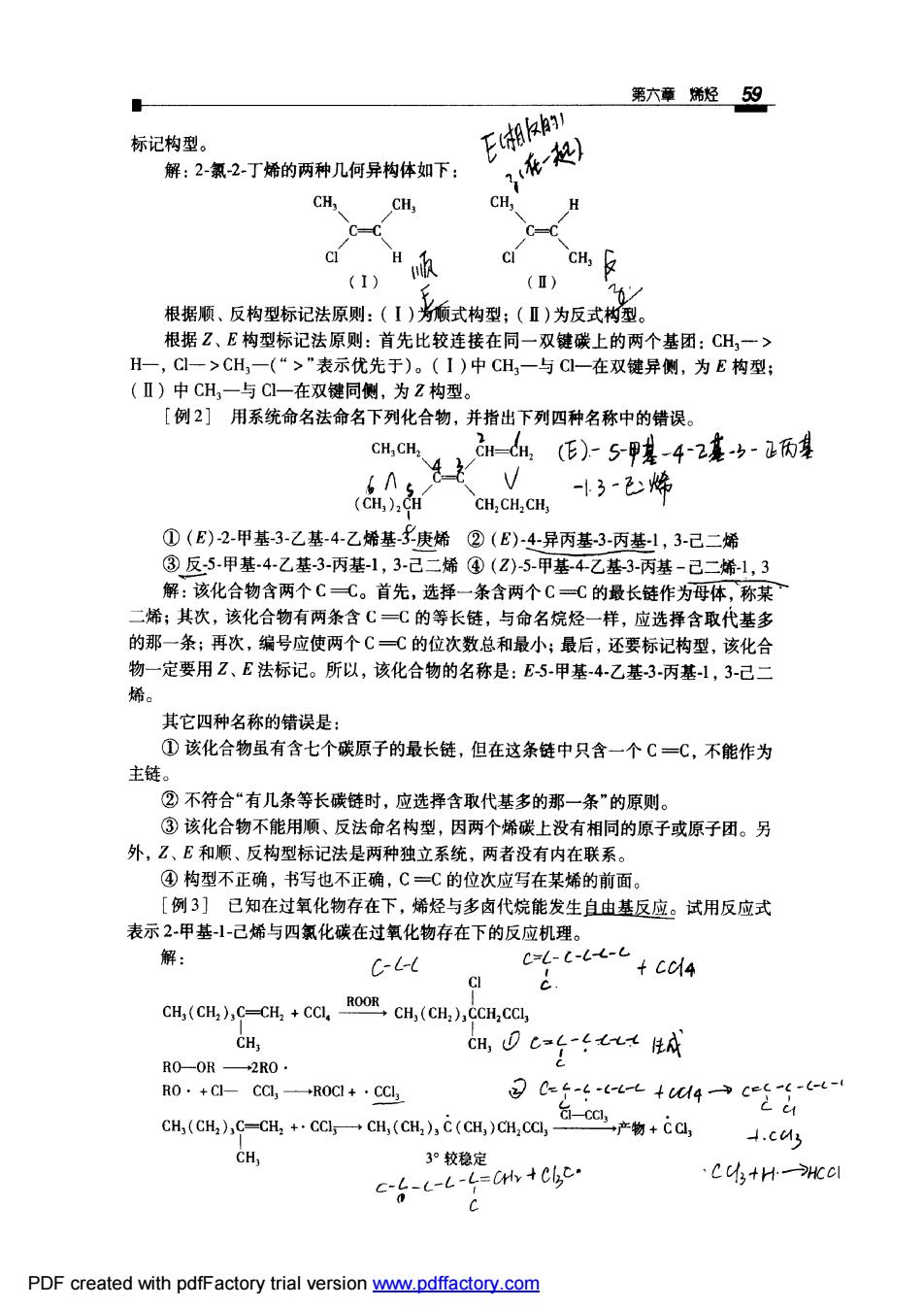
第六童经59 标记构型。 E潮k 解:2-氯-2丁烯的两种几何异构体如下: -起) CH, CH, CH. H c c (1) () 根据顺、反构型标记法原则:(【)癫式构型;(Ⅱ)为反式构型 根据Z、E构型标记法原则:首先比较连接在同一双键碳上的两个基团:CH,一> H一,CI一>CH,一(“>"表示优先于)。(I)中CH,一与C一在双键异侧,为E构型; (Ⅱ)中CH,一与C1一在双键同侧,为2构型。 [例2】用系统命名法命名下列化合物,并指出下列四种名称中的错误。 CH,CH、 血()-59装42毫女-两理 da -13-除 CH,CH,CH, ①(E)2甲基3-乙基4-乙烯基3£庚烯②(E)-4-异丙基3-丙基1,3-己二烯 ③反5.甲基4-乙基3-丙基-1,3-己二烯④(2)-5甲基4乙基-3-丙基-己二烯1,3 解:该化合物含两个CC。首先,选择一条含两个CC的最长链作为母体称某 烯:其次,该化合物有两条含CC的等长链,与命名烷烃一样,应选择含取代基多 的那一条;再次,编号应使两个CC的位次数总和最小;最后,还要标记构型,该化合 物一定要用Z、E法标记。所以,该化合物的名称是:E5甲基4-乙基3-丙基1,3-己二 其它四种名称的储误是: ①该化合物虽有含七个碳原子的最长徒,但在这条链中只含一个C=C,不能作为 主链 ②不符合“有几条等长碳链时,应选择含取代基多的那一条”的原则 ③该化合物不能用顺、反法命名构型,因两个烯碳上没有相同的原子或原子团。另 外,乙、£和顺、反构型标记法是两种独立系统,两者没有内在联系。 ④构型不正确,书写也不正确,C一C的位次应写在某烯的前面 [例3]已知在过氧化物存在下,烯烃与多卤代烷能发生自由基反应。试用反应式 表示2甲基-1-己烯与四氯化碳在过氧化物存在下的反应机理。 Cil C-6-c CI CH(CH,CH(H,),H,CCh, CH, GH,0C4t人A R00R+2R0· R0.+C-Ca,一R0C+·CC 36含5a+4→c经台 CH,(CH2 ),C-CH +.CClCH,(CH,),C (CH,)CH,CCI,- -ca产物+, .c4 CH 3°较稳定 C-L-L-L -L=CHY +Cbc Cc小+Hwcl PDF created with pdfFactory trial version www.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com