
示出不同颜色。 2.酸碱指示剂的变色范围 酸碱指示剂的颜色变化与溶液的 pH 有关。指示剂的酸式 HIn 和碱式 In− 在水溶液中存 在如下的离解平衡: HIn H O H O In 2 3 + − + + ( ) ( ) ( ) ( ) , , , r e r e r e c H c In K HIn c HIn + − = 整理得 ( ) ( ) ( ) ( ) , , , r e r e r e K HIn c In c H c HIn − + = 式中 K HIn ( ) 为指示剂的离解常数,在一定温度下为常数,它由指示剂的本质决定, 指示剂溶液的颜色取决于比值 c In c HIn r e r e , , ( ) ( ) − 。由上述公式可以知道,氢离子浓度的 改变,必然引起 c In c HIn r e r e , , ( ) ( ) − 比值的变化,因而影响指示剂的颜色的改变。需要指 出的是,并非 c In c HIn r e r e , , ( ) ( ) − 比值的微小的改变都能使人观察到溶液颜色的变化。一 般来说,若两种形式的浓度相差,l0 倍以上,人眼才能观察到的就是浓度较大的叠种型体的 颜鱼因此指示剂颜色变化与溶液的 pH 有如下关系: 当 c In c HIn r e r e , , ( ) ( ) − ≤1/10 时,pH≤ pK HIn ( ) -l,应当观察到酸式色;当 c In c HIn r e r e , , ( ) ( ) − ≥10 时,pH≥ pK HIn ( ) +l,应当观察到碱式色; 而 1/10≤ c In c HIn r e r e , , ( ) ( ) − ≤10 时,pH= pK HIn ( ) ±l,应当观察到碱式色和 酸式色的混合色。在这个范围中,我们可以用肉眼观察到溶液的颜色由酸式色变为碱式色, 或由碱式色变为酸式色,称该范围为指示剂的理论变色范围。其 中,当比值 c In c HIn r e r e , , ( ) ( ) − =1,即 pH= pK HIn ( ) 时,在理论上讲,指示剂在 该点颜色变化最灵敏,故称其为理论变色点。 从理论上讲,指示剂的变色范围应当是两个 pH 单位,但实际上靠人眼观 察到的指示剂变色范围与理论值往往有区别。例如, ( ) 9.1 HIn pK 酚酞 = ,理论 计算变色范围为 8.1~10.1,而实际测得变色范围为 8.O~9.6。这是由于肉眼对各 种颜色的敏感程度不同以及指示剂两色之间的相互掩盖能力不同。在实际
示出不同颜色。 2.酸碱指示剂的变色范围 酸碱指示剂的颜色变化与溶液的 pH 有关。指示剂的酸式 HIn 和碱式 In− 在水溶液中存 在如下的离解平衡: HIn H O H O In 2 3 + − + + ( ) ( ) ( ) ( ) , , , r e r e r e c H c In K HIn c HIn + − = 整理得 ( ) ( ) ( ) ( ) , , , r e r e r e K HIn c In c H c HIn − + = 式中 K HIn ( ) 为指示剂的离解常数,在一定温度下为常数,它由指示剂的本质决定, 指示剂溶液的颜色取决于比值 c In c HIn r e r e , , ( ) ( ) − 。由上述公式可以知道,氢离子浓度的 改变,必然引起 c In c HIn r e r e , , ( ) ( ) − 比值的变化,因而影响指示剂的颜色的改变。需要指 出的是,并非 c In c HIn r e r e , , ( ) ( ) − 比值的微小的改变都能使人观察到溶液颜色的变化。一 般来说,若两种形式的浓度相差,l0 倍以上,人眼才能观察到的就是浓度较大的叠种型体的 颜鱼因此指示剂颜色变化与溶液的 pH 有如下关系: 当 c In c HIn r e r e , , ( ) ( ) − ≤1/10 时,pH≤ pK HIn ( ) -l,应当观察到酸式色;当 c In c HIn r e r e , , ( ) ( ) − ≥10 时,pH≥ pK HIn ( ) +l,应当观察到碱式色; 而 1/10≤ c In c HIn r e r e , , ( ) ( ) − ≤10 时,pH= pK HIn ( ) ±l,应当观察到碱式色和 酸式色的混合色。在这个范围中,我们可以用肉眼观察到溶液的颜色由酸式色变为碱式色, 或由碱式色变为酸式色,称该范围为指示剂的理论变色范围。其 中,当比值 c In c HIn r e r e , , ( ) ( ) − =1,即 pH= pK HIn ( ) 时,在理论上讲,指示剂在 该点颜色变化最灵敏,故称其为理论变色点。 从理论上讲,指示剂的变色范围应当是两个 pH 单位,但实际上靠人眼观 察到的指示剂变色范围与理论值往往有区别。例如, ( ) 9.1 HIn pK 酚酞 = ,理论 计算变色范围为 8.1~10.1,而实际测得变色范围为 8.O~9.6。这是由于肉眼对各 种颜色的敏感程度不同以及指示剂两色之间的相互掩盖能力不同。在实际
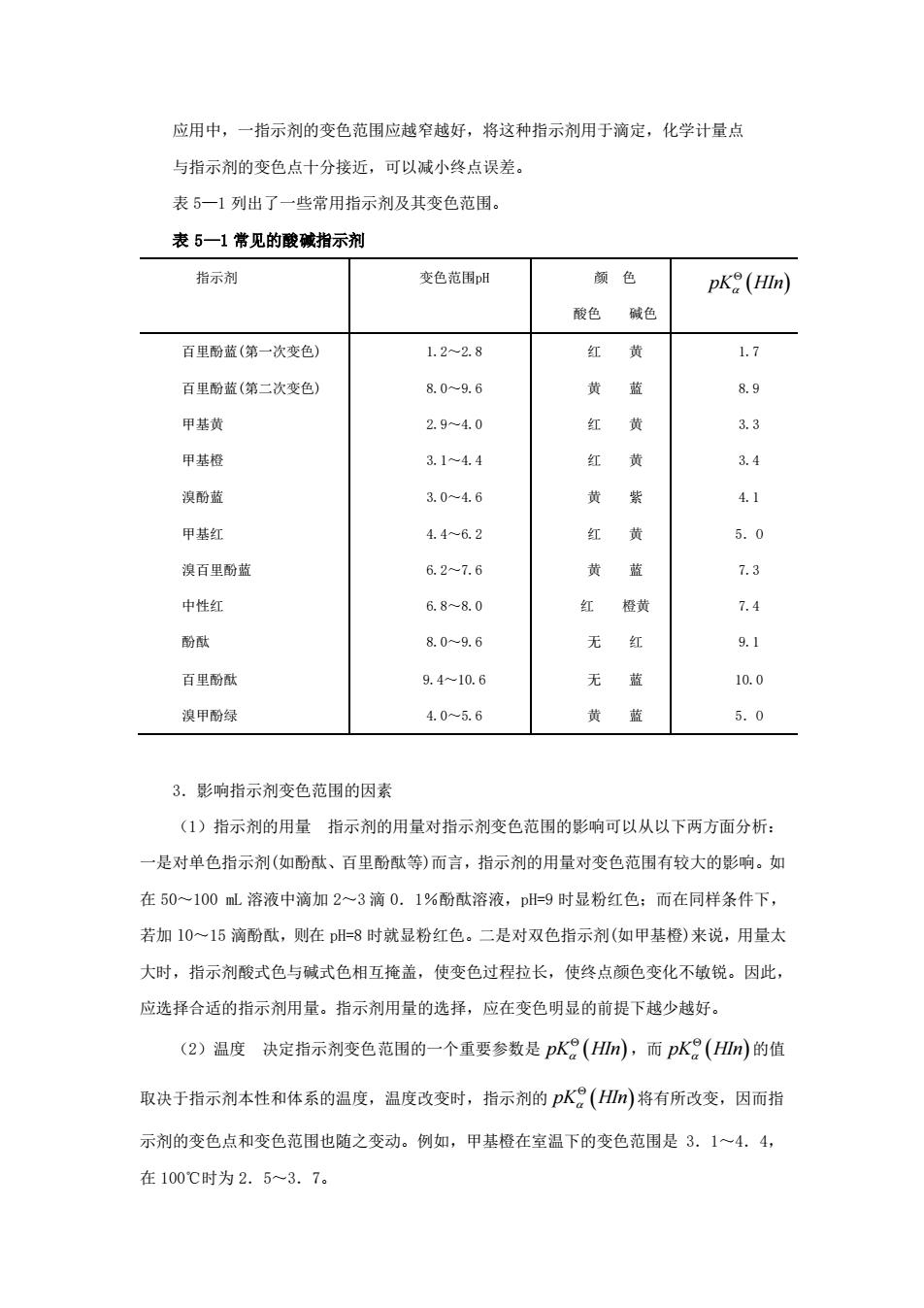
应用中,一指示剂的变色范围应越窄越好,将这种指示剂用于滴定,化学计量点 与指示剂的变色点十分接近,可以减小终点误差。 表 5—1 列出了一些常用指示剂及其变色范围。 表 5—1 常见的酸碱指示剂 指示剂 变色范围pH 颜 色 酸色 碱色 pK HIn ( ) 百里酚蓝(第一次变色) 百里酚蓝(第二次变色) 甲基黄 甲基橙 溴酚蓝 甲基红 溴百里酚蓝 中性红 酚酞 百里酚酞 溴甲酚绿 1.2~2.8 8.0~9.6 2.9~4.0 3.1~4.4 3.0~4.6 4.4~6.2 6.2~7.6 6.8~8.0 8.0~9.6 9.4~10.6 4.0~5.6 红 黄 黄 蓝 红 黄 红 黄 黄 紫 红 黄 黄 蓝 红 橙黄 无 红 无 蓝 黄 蓝 1.7 8.9 3.3 3.4 4.1 5.O 7.3 7.4 9.1 10.0 5.O 3.影响指示剂变色范围的因素 (1)指示剂的用量 指示剂的用量对指示剂变色范围的影响可以从以下两方面分析: 一是对单色指示剂(如酚酞、百里酚酞等)而言,指示剂的用量对变色范围有较大的影响。如 在 50~100 mL 溶液中滴加 2~3 滴 0.1%酚酞溶液,pH=9 时显粉红色;而在同样条件下, 若加 l0~15 滴酚酞,则在 pH=8 时就显粉红色。二是对双色指示剂(如甲基橙)来说,用量太 大时,指示剂酸式色与碱式色相互掩盖,使变色过程拉长,使终点颜色变化不敏锐。因此, 应选择合适的指示剂用量。指示剂用量的选择,应在变色明显的前提下越少越好。 (2)温度 决定指示剂变色范围的一个重要参数是 pK HIn ( ) ,而 pK HIn ( ) 的值 取决于指示剂本性和体系的温度,温度改变时,指示剂的 pK HIn ( ) 将有所改变,因而指 示剂的变色点和变色范围也随之变动。例如,甲基橙在室温下的变色范围是 3.1~4.4, 在 100℃时为 2.5~3.7
应用中,一指示剂的变色范围应越窄越好,将这种指示剂用于滴定,化学计量点 与指示剂的变色点十分接近,可以减小终点误差。 表 5—1 列出了一些常用指示剂及其变色范围。 表 5—1 常见的酸碱指示剂 指示剂 变色范围pH 颜 色 酸色 碱色 pK HIn ( ) 百里酚蓝(第一次变色) 百里酚蓝(第二次变色) 甲基黄 甲基橙 溴酚蓝 甲基红 溴百里酚蓝 中性红 酚酞 百里酚酞 溴甲酚绿 1.2~2.8 8.0~9.6 2.9~4.0 3.1~4.4 3.0~4.6 4.4~6.2 6.2~7.6 6.8~8.0 8.0~9.6 9.4~10.6 4.0~5.6 红 黄 黄 蓝 红 黄 红 黄 黄 紫 红 黄 黄 蓝 红 橙黄 无 红 无 蓝 黄 蓝 1.7 8.9 3.3 3.4 4.1 5.O 7.3 7.4 9.1 10.0 5.O 3.影响指示剂变色范围的因素 (1)指示剂的用量 指示剂的用量对指示剂变色范围的影响可以从以下两方面分析: 一是对单色指示剂(如酚酞、百里酚酞等)而言,指示剂的用量对变色范围有较大的影响。如 在 50~100 mL 溶液中滴加 2~3 滴 0.1%酚酞溶液,pH=9 时显粉红色;而在同样条件下, 若加 l0~15 滴酚酞,则在 pH=8 时就显粉红色。二是对双色指示剂(如甲基橙)来说,用量太 大时,指示剂酸式色与碱式色相互掩盖,使变色过程拉长,使终点颜色变化不敏锐。因此, 应选择合适的指示剂用量。指示剂用量的选择,应在变色明显的前提下越少越好。 (2)温度 决定指示剂变色范围的一个重要参数是 pK HIn ( ) ,而 pK HIn ( ) 的值 取决于指示剂本性和体系的温度,温度改变时,指示剂的 pK HIn ( ) 将有所改变,因而指 示剂的变色点和变色范围也随之变动。例如,甲基橙在室温下的变色范围是 3.1~4.4, 在 100℃时为 2.5~3.7

(3)滴定方向 由于人眼对于各种颜色的敏感程度不同,考虑到指示剂的实际变色情 况,一般还要注意滴定时的方向。例如酚酞由无色变到红色,颜色变化明显,易于辨别,宜 采用碱滴定酸;反之变色不明显,易造成滴定剂过量。同样甲基橙由黄色变到红色较红色变 到黄色更易辨别,这时宜用酸滴定碱。因此若考虑变色的敏锐性,还应注意滴定的方向。 (4)溶剂 不同的溶剂得失质子的能力不同,所以,同一指示剂在不同的溶剂中有不 同的 pK HIn ( ) ,即存在不同的变色范围。 此外,当溶液中存在胶体或大量的盐时,指示剂的变色范围也将发生变化。 4.混合指示剂 表 5—1 所列的都是单一指示剂,变色范围一般比较宽,有些指示剂颜色的变化也不很 明显。在一些酸碱滴定中,若使用这类指示剂则难以达到所要求准确度,这时可采用混合指 示剂。混合指示剂具有变色范围窄、变色敏锐等优点。 混合指示剂主要是利用颜色 的互补作用而形成的。混合指示剂通常有两种配制方法:一种是在某种指示剂中加入一种不 随溶液 H +浓度变化而改变颜色的“惰性染料”。例如: pH 甲基橙 靛蓝 混合后 ≤3.1 红色 + 蓝色 紫色 =4.1 橙色 + 蓝色 浅灰色 ≥4.4 黄色 + 蓝色 绿色 另一种方法是将两种或两种以上的指示剂混合配成。例如: 甲基红 溴甲酚绿 混合后 酸式色 红色 + 黄色 橙色 中间色 橙色 + 绿色 灰色 碱式色 黄色 + 蓝色 绿色 从以上两种混合指示剂的配制及酸式色与碱式色对比看出,混合指示剂变色更加明显 了,进而使变色范围更窄了。 常用的混合指示剂列于表中 混合指示剂的组成 变色点 pH 颜色 酸 备注 色 碱 色 1 份 0.1%甲基橙水溶液 4.1 紫 黄 pH4.1 灰色
(3)滴定方向 由于人眼对于各种颜色的敏感程度不同,考虑到指示剂的实际变色情 况,一般还要注意滴定时的方向。例如酚酞由无色变到红色,颜色变化明显,易于辨别,宜 采用碱滴定酸;反之变色不明显,易造成滴定剂过量。同样甲基橙由黄色变到红色较红色变 到黄色更易辨别,这时宜用酸滴定碱。因此若考虑变色的敏锐性,还应注意滴定的方向。 (4)溶剂 不同的溶剂得失质子的能力不同,所以,同一指示剂在不同的溶剂中有不 同的 pK HIn ( ) ,即存在不同的变色范围。 此外,当溶液中存在胶体或大量的盐时,指示剂的变色范围也将发生变化。 4.混合指示剂 表 5—1 所列的都是单一指示剂,变色范围一般比较宽,有些指示剂颜色的变化也不很 明显。在一些酸碱滴定中,若使用这类指示剂则难以达到所要求准确度,这时可采用混合指 示剂。混合指示剂具有变色范围窄、变色敏锐等优点。 混合指示剂主要是利用颜色 的互补作用而形成的。混合指示剂通常有两种配制方法:一种是在某种指示剂中加入一种不 随溶液 H +浓度变化而改变颜色的“惰性染料”。例如: pH 甲基橙 靛蓝 混合后 ≤3.1 红色 + 蓝色 紫色 =4.1 橙色 + 蓝色 浅灰色 ≥4.4 黄色 + 蓝色 绿色 另一种方法是将两种或两种以上的指示剂混合配成。例如: 甲基红 溴甲酚绿 混合后 酸式色 红色 + 黄色 橙色 中间色 橙色 + 绿色 灰色 碱式色 黄色 + 蓝色 绿色 从以上两种混合指示剂的配制及酸式色与碱式色对比看出,混合指示剂变色更加明显 了,进而使变色范围更窄了。 常用的混合指示剂列于表中 混合指示剂的组成 变色点 pH 颜色 酸 备注 色 碱 色 1 份 0.1%甲基橙水溶液 4.1 紫 黄 pH4.1 灰色

1 份 0.25%靛蓝二磺酸钠水溶液 绿 3 份 0.1%溴甲酚氯乙醇溶液 1 份 0.2%甲基红乙醇溶液 5.1 酒红 绿 pH5.1 灰色 1 份 0.1%溴甲酚绿钠盐水溶液 1 份 0.1%氯酚红钠盐水溶液 6.1 蓝绿 蓝紫 pH5.4 蓝绿 pH5.8 蓝 pH6.0 蓝带紫 pH6.2 蓝紫 1 份 0.1%中性红乙醇溶液 1 份 0.1%次甲基蓝乙醇溶液 7.0 篮紫 绿 pH7.0 蓝紫 1 份 0.1%甲酚红钠水溶液 3 份 0.1%百里酚蓝钠盐水溶液 8.3 黄 紫 pH8.2 玫瑰色 pH 紫色紫色 1 份 0.1%百里酚蓝 50%乙醇溶液 3 份 0.1%酚酞 50%乙醇溶液 9.0 黄 紫 从黄到绿再到紫 2 份 0.1%百里酚酞乙醇溶液 1 份 0.1%茜素黄乙醇溶液 10.2 黄 (2)酸碱滴定法的基本原理 (三)酸碱滴定法的基本原理 将一种酸逐滴加人到一种碱液中,或将一种碱逐滴加入到一种酸液中时,溶液的 pH 不 断变化。若以溶液的 pH 为纵坐标,加入溶液的体积 V(或滴定分数 T)为横坐标作图,所得到 的图称为酸碱滴定曲线。从滴定曲线上不仅可以了解到待测物质能否直接准确被滴定,同时 还可以了解如何正确选择指示剂。在酸碱滴定中,不同类型的酸碱滴定过程 pH 的变化规律 是各不相同的,下面分别予以讨论。 1.强酸强碱的滴定 滴定的基本反应为: H OH H O2 + − + 以 0.100 0 1 mol L− 。1NaOH 溶液滴定 20.00mL 0.1000 1 mol L− HCl 溶液为例,滴 定曲线可以采用“两点两线”法制作。“两点两线”即滴定前(点)、滴定开始至化学计量点 前(线)、化学计量点(点)和化学计量点后(线)四个阶段。 (1)滴定前即滴定曲线的起点,溶液的 pH 取决于 HCl 的起始浓度
1 份 0.25%靛蓝二磺酸钠水溶液 绿 3 份 0.1%溴甲酚氯乙醇溶液 1 份 0.2%甲基红乙醇溶液 5.1 酒红 绿 pH5.1 灰色 1 份 0.1%溴甲酚绿钠盐水溶液 1 份 0.1%氯酚红钠盐水溶液 6.1 蓝绿 蓝紫 pH5.4 蓝绿 pH5.8 蓝 pH6.0 蓝带紫 pH6.2 蓝紫 1 份 0.1%中性红乙醇溶液 1 份 0.1%次甲基蓝乙醇溶液 7.0 篮紫 绿 pH7.0 蓝紫 1 份 0.1%甲酚红钠水溶液 3 份 0.1%百里酚蓝钠盐水溶液 8.3 黄 紫 pH8.2 玫瑰色 pH 紫色紫色 1 份 0.1%百里酚蓝 50%乙醇溶液 3 份 0.1%酚酞 50%乙醇溶液 9.0 黄 紫 从黄到绿再到紫 2 份 0.1%百里酚酞乙醇溶液 1 份 0.1%茜素黄乙醇溶液 10.2 黄 (2)酸碱滴定法的基本原理 (三)酸碱滴定法的基本原理 将一种酸逐滴加人到一种碱液中,或将一种碱逐滴加入到一种酸液中时,溶液的 pH 不 断变化。若以溶液的 pH 为纵坐标,加入溶液的体积 V(或滴定分数 T)为横坐标作图,所得到 的图称为酸碱滴定曲线。从滴定曲线上不仅可以了解到待测物质能否直接准确被滴定,同时 还可以了解如何正确选择指示剂。在酸碱滴定中,不同类型的酸碱滴定过程 pH 的变化规律 是各不相同的,下面分别予以讨论。 1.强酸强碱的滴定 滴定的基本反应为: H OH H O2 + − + 以 0.100 0 1 mol L− 。1NaOH 溶液滴定 20.00mL 0.1000 1 mol L− HCl 溶液为例,滴 定曲线可以采用“两点两线”法制作。“两点两线”即滴定前(点)、滴定开始至化学计量点 前(线)、化学计量点(点)和化学计量点后(线)四个阶段。 (1)滴定前即滴定曲线的起点,溶液的 pH 取决于 HCl 的起始浓度

c H e ( ) + =0.100 0 1 mol L− ,pH=1.OO (2)滴定开始至化学计量点前 溶液的 pH 取决于剩余 HCl 的浓度。 c H e ( ) + =0.100 0 1 mol L− ×[V(HCl)-V (NaOH)]/[ V(HCl)+V(NaOH)] V(HCl)=20.00 mL,只要给出一个 V(NaOH)就可计算出一个对应的 c H e ( ) + 。例如,当 V(NaOH)=19.98 mL 时: c H e ( ) + =0 . 100 0 1 mol L− ×[20.00mL-19.98mL]/[ 20.00mL+19.98mL] =5.0× 5 10− 1 mol L− pH=4.30 (3)化学计量点时 化学计量点即两种物质按照化学反应完全反应的这一点,溶液应 为中性,此时,V(NaOH)=20.00 mL。 c H e ( ) + = c OH e ( ) − =1.0× 7 10− 1 mol L− ,pH=7.00 (4)化学计量点后 溶液的 pH 取决于过量的 NaOH 的浓度。 c H e ( ) + =0.100 0 1 mol L− ×[V(NaOH)-V (HCl)]/[ V(HCl)+V(NaOH)] V(HCl)=20.00 mL,只要给出一个 V(NaOH)就可计算出一个对应的 c OH e ( ) − ,进而计 算出 c H e ( ) + 。例如,当 V(NaOH)=20.02 mL 时: c H e ( ) + =0 . 100 0 1 mol L− ×[20.02mL-20.00mL]/[20.02mL+20.00mL] =5.0×10-5 1 mol L− pOH=4.30,pH=9.7 按照以上方法,给出多个 V(NaOH),就可计算出对应的 pH,结果列于 表 5—3 中。 表 5—3 0.100 0 1 mol L− NaOH 滴定 20.00 mL 0.100 0 1 mol L− HCl 时溶液 pH 的变化 滴入NaOH溶液的体积/mL 滴定分数T 溶液的pH
c H e ( ) + =0.100 0 1 mol L− ,pH=1.OO (2)滴定开始至化学计量点前 溶液的 pH 取决于剩余 HCl 的浓度。 c H e ( ) + =0.100 0 1 mol L− ×[V(HCl)-V (NaOH)]/[ V(HCl)+V(NaOH)] V(HCl)=20.00 mL,只要给出一个 V(NaOH)就可计算出一个对应的 c H e ( ) + 。例如,当 V(NaOH)=19.98 mL 时: c H e ( ) + =0 . 100 0 1 mol L− ×[20.00mL-19.98mL]/[ 20.00mL+19.98mL] =5.0× 5 10− 1 mol L− pH=4.30 (3)化学计量点时 化学计量点即两种物质按照化学反应完全反应的这一点,溶液应 为中性,此时,V(NaOH)=20.00 mL。 c H e ( ) + = c OH e ( ) − =1.0× 7 10− 1 mol L− ,pH=7.00 (4)化学计量点后 溶液的 pH 取决于过量的 NaOH 的浓度。 c H e ( ) + =0.100 0 1 mol L− ×[V(NaOH)-V (HCl)]/[ V(HCl)+V(NaOH)] V(HCl)=20.00 mL,只要给出一个 V(NaOH)就可计算出一个对应的 c OH e ( ) − ,进而计 算出 c H e ( ) + 。例如,当 V(NaOH)=20.02 mL 时: c H e ( ) + =0 . 100 0 1 mol L− ×[20.02mL-20.00mL]/[20.02mL+20.00mL] =5.0×10-5 1 mol L− pOH=4.30,pH=9.7 按照以上方法,给出多个 V(NaOH),就可计算出对应的 pH,结果列于 表 5—3 中。 表 5—3 0.100 0 1 mol L− NaOH 滴定 20.00 mL 0.100 0 1 mol L− HCl 时溶液 pH 的变化 滴入NaOH溶液的体积/mL 滴定分数T 溶液的pH