
0.00 18.00 19.80 19.98 20.00 20.02 20.20 22.00 40.00 0.000 0.900 0.990 0.999 1.000 1.001 1.010 1.100 2.000 1.00 2.28 3.30 4.30 7.00 9.70 10.70 11.68 12.52 表 5—3 中的第二列为滴定分数,一般用 T 表示。T 与所加滴定剂体积相同,是一个常 用以衡量滴定反应进行的程度的参数,是所加滴定剂与被滴定组分的物质的量之比。例如, 起点时 T=0.000,计量点时 T=1.000,滴定开始至化学计量点前 T<1,化学计量点后 T>1。 以滴定分数(或 NaOH 的加入体积)为横坐标,相对应的 pH 为纵坐 标,绘制 pH—T(V)酸碱滴定曲线, 如图 5—3 所示。 从表 5—3 和图 5—3 可以看 出,从滴定开始到 T=0.999(即 加入 l9.98mL NaOH 溶液)时, 溶液的 pH 由 1.00 到 4.30 只 改变 3.3 个 pH 单位,曲线变化 比较平坦;再滴人 0.04mLNaOH 溶液(约一滴)时,T 由 0.999 增 大为 1.001,加入的 NaOH 溶液 的体积由 19.98mL 增加到 20.02 mL,溶液的 pH 迅速由 4.30 增 大到 9.70,溶液呈碱性了,曲线 几乎与纵坐标平行,此后再滴入过量 NaOH 溶液所引起 pH 变化就较小。 由此可见,在化学计量点前后,从剩余 pH T 12 4 8 0.5 1.0 1.5 甲基橙 甲基红 酚酞 图 5—3 0.100 0 1 mol L− NaOH 滴定 20.O0mL 0.100 0 1 mol L− HCl 溶液(实线)和 0.100 0 1 mol L− HCl 滴定 20.00mL 0.100 0 1 mol L− NaOH 溶液(虚线) 的滴定曲线
0.00 18.00 19.80 19.98 20.00 20.02 20.20 22.00 40.00 0.000 0.900 0.990 0.999 1.000 1.001 1.010 1.100 2.000 1.00 2.28 3.30 4.30 7.00 9.70 10.70 11.68 12.52 表 5—3 中的第二列为滴定分数,一般用 T 表示。T 与所加滴定剂体积相同,是一个常 用以衡量滴定反应进行的程度的参数,是所加滴定剂与被滴定组分的物质的量之比。例如, 起点时 T=0.000,计量点时 T=1.000,滴定开始至化学计量点前 T<1,化学计量点后 T>1。 以滴定分数(或 NaOH 的加入体积)为横坐标,相对应的 pH 为纵坐 标,绘制 pH—T(V)酸碱滴定曲线, 如图 5—3 所示。 从表 5—3 和图 5—3 可以看 出,从滴定开始到 T=0.999(即 加入 l9.98mL NaOH 溶液)时, 溶液的 pH 由 1.00 到 4.30 只 改变 3.3 个 pH 单位,曲线变化 比较平坦;再滴人 0.04mLNaOH 溶液(约一滴)时,T 由 0.999 增 大为 1.001,加入的 NaOH 溶液 的体积由 19.98mL 增加到 20.02 mL,溶液的 pH 迅速由 4.30 增 大到 9.70,溶液呈碱性了,曲线 几乎与纵坐标平行,此后再滴入过量 NaOH 溶液所引起 pH 变化就较小。 由此可见,在化学计量点前后,从剩余 pH T 12 4 8 0.5 1.0 1.5 甲基橙 甲基红 酚酞 图 5—3 0.100 0 1 mol L− NaOH 滴定 20.O0mL 0.100 0 1 mol L− HCl 溶液(实线)和 0.100 0 1 mol L− HCl 滴定 20.00mL 0.100 0 1 mol L− NaOH 溶液(虚线) 的滴定曲线

HCl 0.02 mL 到过量 0.02 mL NaOH(即滴定分数从 0.999 至 1.001),只加人了约一 滴(0.04 mL)NaOH 溶液,pH 却从 4. 30 突变到 9.70,改变了 5.4 个 pH 单位,这种 pH 的 急剧变化称为滴定突跃。突跃所在的 pH 范围称为滴定突跃范围。滴定突跃范围的规定是以 误差为依据的,滴定若在 T=0.999 时终止,则引起-0.1%的相对误差为-0.1%,若在 T=1.001 时终止,则引起+0.1%的相对误差为+0.1%。也就是说,只要滴定的终点在突跃范围内, 则滴定的误差不超过±0.1%,符合滴定分析准确度的要求。 从滴定突跃范围的规定不难理解,它是选择指示剂的依据。显然,最理想的指示剂应该 恰好在化学计量点变色,但实际上,只要指示剂的变色点的 pH 处于滴定突跃范围内,引起 的滴定误差都丕超过±0.1%,就能够满足滴定分析法的准确度要求。通常选择指示剂的原 则是:指示剂的变色范围全部或部分蓬在滴定的突跃范围之内。 对于强酸滴定强碱,如 HCl 滴定 NaOH,情况相 似,但溶液 pH 的变化方 向相反,如图 5—3 中虚 线所示。滴定的突跃范 围是 9.70~4.30,酚 酞、甲基红均适用。如果 用甲基橙作指示剂,从黄 色滴定到橙色,将有+0.2%的误差。从以上讨论可以看出,碱滴定中的滴定突跃范围 的大小与酸碱溶液的浓度有关,如图 5—4 所示,酸碱溶液的浓度越大,突跃范围越大;酸 碱溶液的浓度越小,突跃范围也就越小。对于 0.010 00 1 mol L− NaOH 溶液滴定 0.010 00 1 mol L− HCl,突跃范围缩小为 5.30~8.70,甲基橙不再适用;若用 l.000 1 mol L− NaOH 溶液滴定 1.000 1 mol L− HCl,突跃范围将扩大为 3.30~10.70,在滴定分析中,溶液的 浓度不宜过大或过小,浓度过大时,终点误差增大,浓度过小时,滴定的突越范围小,难以 选择合适的指示剂。因此,在酸碱滴定中常用的酸碱溶液的浓度在 0.01~1 1 mol L− 之间。 2. 一元弱酸(碱)的滴定 (1)强碱滴定一元弱酸 基本反应为: OH HA A H O2 − − + + 图5—3不同浓度 NaOH 溶液滴定不同浓度 HCl 溶液 的滴定曲线 1 表示 1.00 1 mol L− 1 表示 0.10 1 mol L− 1 表示 0.01 1 mol L− pH T 1 2 4 8 0.5 1.0 1.5 甲基橙 甲基红 酚酞 1 2 3 3 2 1
HCl 0.02 mL 到过量 0.02 mL NaOH(即滴定分数从 0.999 至 1.001),只加人了约一 滴(0.04 mL)NaOH 溶液,pH 却从 4. 30 突变到 9.70,改变了 5.4 个 pH 单位,这种 pH 的 急剧变化称为滴定突跃。突跃所在的 pH 范围称为滴定突跃范围。滴定突跃范围的规定是以 误差为依据的,滴定若在 T=0.999 时终止,则引起-0.1%的相对误差为-0.1%,若在 T=1.001 时终止,则引起+0.1%的相对误差为+0.1%。也就是说,只要滴定的终点在突跃范围内, 则滴定的误差不超过±0.1%,符合滴定分析准确度的要求。 从滴定突跃范围的规定不难理解,它是选择指示剂的依据。显然,最理想的指示剂应该 恰好在化学计量点变色,但实际上,只要指示剂的变色点的 pH 处于滴定突跃范围内,引起 的滴定误差都丕超过±0.1%,就能够满足滴定分析法的准确度要求。通常选择指示剂的原 则是:指示剂的变色范围全部或部分蓬在滴定的突跃范围之内。 对于强酸滴定强碱,如 HCl 滴定 NaOH,情况相 似,但溶液 pH 的变化方 向相反,如图 5—3 中虚 线所示。滴定的突跃范 围是 9.70~4.30,酚 酞、甲基红均适用。如果 用甲基橙作指示剂,从黄 色滴定到橙色,将有+0.2%的误差。从以上讨论可以看出,碱滴定中的滴定突跃范围 的大小与酸碱溶液的浓度有关,如图 5—4 所示,酸碱溶液的浓度越大,突跃范围越大;酸 碱溶液的浓度越小,突跃范围也就越小。对于 0.010 00 1 mol L− NaOH 溶液滴定 0.010 00 1 mol L− HCl,突跃范围缩小为 5.30~8.70,甲基橙不再适用;若用 l.000 1 mol L− NaOH 溶液滴定 1.000 1 mol L− HCl,突跃范围将扩大为 3.30~10.70,在滴定分析中,溶液的 浓度不宜过大或过小,浓度过大时,终点误差增大,浓度过小时,滴定的突越范围小,难以 选择合适的指示剂。因此,在酸碱滴定中常用的酸碱溶液的浓度在 0.01~1 1 mol L− 之间。 2. 一元弱酸(碱)的滴定 (1)强碱滴定一元弱酸 基本反应为: OH HA A H O2 − − + + 图5—3不同浓度 NaOH 溶液滴定不同浓度 HCl 溶液 的滴定曲线 1 表示 1.00 1 mol L− 1 表示 0.10 1 mol L− 1 表示 0.01 1 mol L− pH T 1 2 4 8 0.5 1.0 1.5 甲基橙 甲基红 酚酞 1 2 3 3 2 1

现以 0.100 0 1 mol L− NaOH 溶液滴定 20.00mL0.100 0 1 mol L− HAc 为例,采用“两 点两线”法制作滴定曲线 ①滴定前。溶液的酸度由 Hac 决定,且 r a cK >20 KW , r a c K >500,则溶液的 pH 可以用最简式计算: c H r e, ( ) + = Ka cr = 5 1.8 10 0.1000 − =1.3× 5 10− pH=2.89 ②滴定开始至化学计量点前。溶液是剩余的 HAc 与生成的 Ac− 两者形成的酸碱共轭体 系,符合缓冲溶液的最简式计算条件,溶液的 pH 可按下式计算: pH= ( ) ( ) lg r r c HAc c Ac pKa − − 给定一个 V(NaOH),就可以确定 c HAc r ( ) 与 c Ac r ( ) − ,进而计算体系的 pH。例如,当 V(NaOH)=19.98mL 时: c HAc r ( ) =0.100 0× 20.00 19.98 20.00 19.98 − + =5.0× 5 10− c Ac r ( ) − =0.100 0× 19.98 20.00 19.98 + =5.0× 2 10− pH=4.75-lg 5 2 5.0 10 5.0 10 − − =7.74 , ③化学计量点时。HAc 已全部转化为 Ac− ,c Ac r ( ) − =0.100 0 20.00 40.00 =0.050 0,且 c Ac r ( ) − k Ac b ( ) − > 20KW ,c Ac k Ac r b ( ) ( ) − − >500,则溶液的 pH 可 以用最简式计算: c OH K Ac c Ac r e b r , ( ) ( ) ( ) − − − = , = 10 6 0.0500 5.6 10 5.29 10 − − = pOH=5.28,pH=8.72 ④化学计量点后。体系由反应生成的 NaAc 和过量的 NaOH 组成, Ac− 虽为弱碱,但在 过量的 NaOH 存在时抑制了其水解,故体系的酸度由过量的 NaOH 决定。例如,当加入 NaOH 溶液 20.02 时:
现以 0.100 0 1 mol L− NaOH 溶液滴定 20.00mL0.100 0 1 mol L− HAc 为例,采用“两 点两线”法制作滴定曲线 ①滴定前。溶液的酸度由 Hac 决定,且 r a cK >20 KW , r a c K >500,则溶液的 pH 可以用最简式计算: c H r e, ( ) + = Ka cr = 5 1.8 10 0.1000 − =1.3× 5 10− pH=2.89 ②滴定开始至化学计量点前。溶液是剩余的 HAc 与生成的 Ac− 两者形成的酸碱共轭体 系,符合缓冲溶液的最简式计算条件,溶液的 pH 可按下式计算: pH= ( ) ( ) lg r r c HAc c Ac pKa − − 给定一个 V(NaOH),就可以确定 c HAc r ( ) 与 c Ac r ( ) − ,进而计算体系的 pH。例如,当 V(NaOH)=19.98mL 时: c HAc r ( ) =0.100 0× 20.00 19.98 20.00 19.98 − + =5.0× 5 10− c Ac r ( ) − =0.100 0× 19.98 20.00 19.98 + =5.0× 2 10− pH=4.75-lg 5 2 5.0 10 5.0 10 − − =7.74 , ③化学计量点时。HAc 已全部转化为 Ac− ,c Ac r ( ) − =0.100 0 20.00 40.00 =0.050 0,且 c Ac r ( ) − k Ac b ( ) − > 20KW ,c Ac k Ac r b ( ) ( ) − − >500,则溶液的 pH 可 以用最简式计算: c OH K Ac c Ac r e b r , ( ) ( ) ( ) − − − = , = 10 6 0.0500 5.6 10 5.29 10 − − = pOH=5.28,pH=8.72 ④化学计量点后。体系由反应生成的 NaAc 和过量的 NaOH 组成, Ac− 虽为弱碱,但在 过量的 NaOH 存在时抑制了其水解,故体系的酸度由过量的 NaOH 决定。例如,当加入 NaOH 溶液 20.02 时:
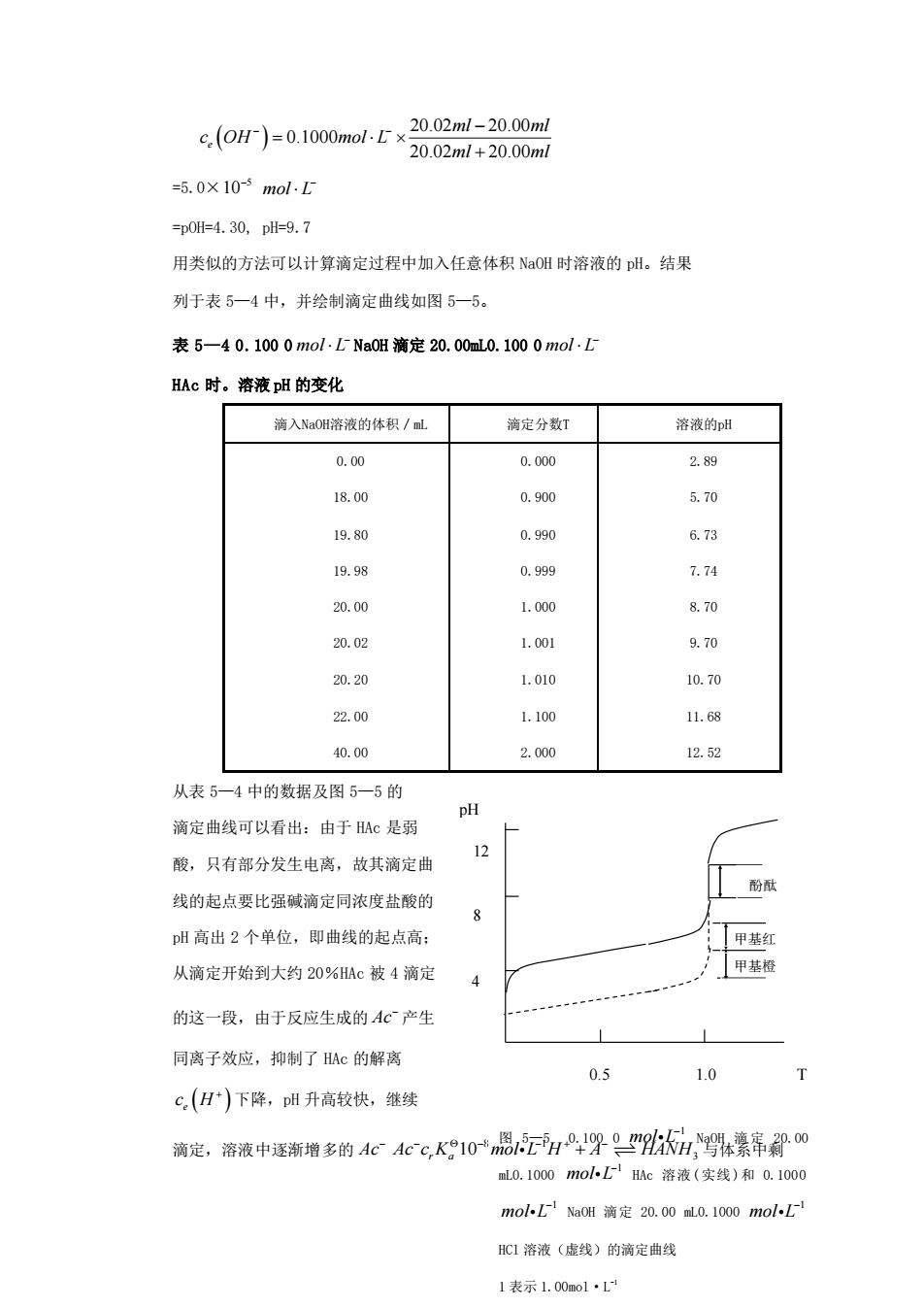
( ) 20.02 20.00 0.1000 20.02 20.00 e ml ml c OH mol L ml ml − − − = + =5.0× 5 10− mol L− =pOH=4.30, pH=9.7 用类似的方法可以计算滴定过程中加入任意体积 NaOH 时溶液的 pH。结果 列于表 5—4 中,并绘制滴定曲线如图 5—5。 表 5—4 0.100 0 mol L− NaOH 滴定 20.00mL0.100 0 mol L− HAc 时。溶液 pH 的变化 滴入NaOH溶液的体积/mL 滴定分数T 溶液的pH 0.00 18.00 19.80 19.98 20.00 20.02 20.20 22.00 40.00 0.000 0.900 0.990 0.999 1.000 1.001 1.010 1.100 2.000 2.89 5.70 6.73 7.74 8.70 9.70 10.70 11.68 12.52 从表 5—4 中的数据及图 5—5 的 滴定曲线可以看出:由于 HAc 是弱 酸,只有部分发生电离,故其滴定曲 线的起点要比强碱滴定同浓度盐酸的 pH 高出 2 个单位,即曲线的起点高; 从滴定开始到大约 20%HAc 被 4 滴定 的这一段,由于反应生成的 Ac− 产生 同离子效应,抑制了 HAc 的解离 c H e ( ) + 下降,pH 升高较快,继续 滴定,溶液中逐渐增多的 Ac− 8 1 3 10 Ac c K mol L H A HANH r a − − − + − + 与体系中剩 图 5—5 0.100 0 1 mol L− NaOH 滴 定 20.00 mL0.1000 1 mol L− HAc 溶液(实线)和 0.1000 1 mol L− NaOH 滴定 20.00 mL0.1000 1 mol L− HCl 溶液(虚线)的滴定曲线 1 表示 1.00mol·L-1 1 表示 0.10mol·L-1 pH T 12 4 8 0.5 1.0 甲基橙 甲基红 酚酞
( ) 20.02 20.00 0.1000 20.02 20.00 e ml ml c OH mol L ml ml − − − = + =5.0× 5 10− mol L− =pOH=4.30, pH=9.7 用类似的方法可以计算滴定过程中加入任意体积 NaOH 时溶液的 pH。结果 列于表 5—4 中,并绘制滴定曲线如图 5—5。 表 5—4 0.100 0 mol L− NaOH 滴定 20.00mL0.100 0 mol L− HAc 时。溶液 pH 的变化 滴入NaOH溶液的体积/mL 滴定分数T 溶液的pH 0.00 18.00 19.80 19.98 20.00 20.02 20.20 22.00 40.00 0.000 0.900 0.990 0.999 1.000 1.001 1.010 1.100 2.000 2.89 5.70 6.73 7.74 8.70 9.70 10.70 11.68 12.52 从表 5—4 中的数据及图 5—5 的 滴定曲线可以看出:由于 HAc 是弱 酸,只有部分发生电离,故其滴定曲 线的起点要比强碱滴定同浓度盐酸的 pH 高出 2 个单位,即曲线的起点高; 从滴定开始到大约 20%HAc 被 4 滴定 的这一段,由于反应生成的 Ac− 产生 同离子效应,抑制了 HAc 的解离 c H e ( ) + 下降,pH 升高较快,继续 滴定,溶液中逐渐增多的 Ac− 8 1 3 10 Ac c K mol L H A HANH r a − − − + − + 与体系中剩 图 5—5 0.100 0 1 mol L− NaOH 滴 定 20.00 mL0.1000 1 mol L− HAc 溶液(实线)和 0.1000 1 mol L− NaOH 滴定 20.00 mL0.1000 1 mol L− HCl 溶液(虚线)的滴定曲线 1 表示 1.00mol·L-1 1 表示 0.10mol·L-1 pH T 12 4 8 0.5 1.0 甲基橙 甲基红 酚酞
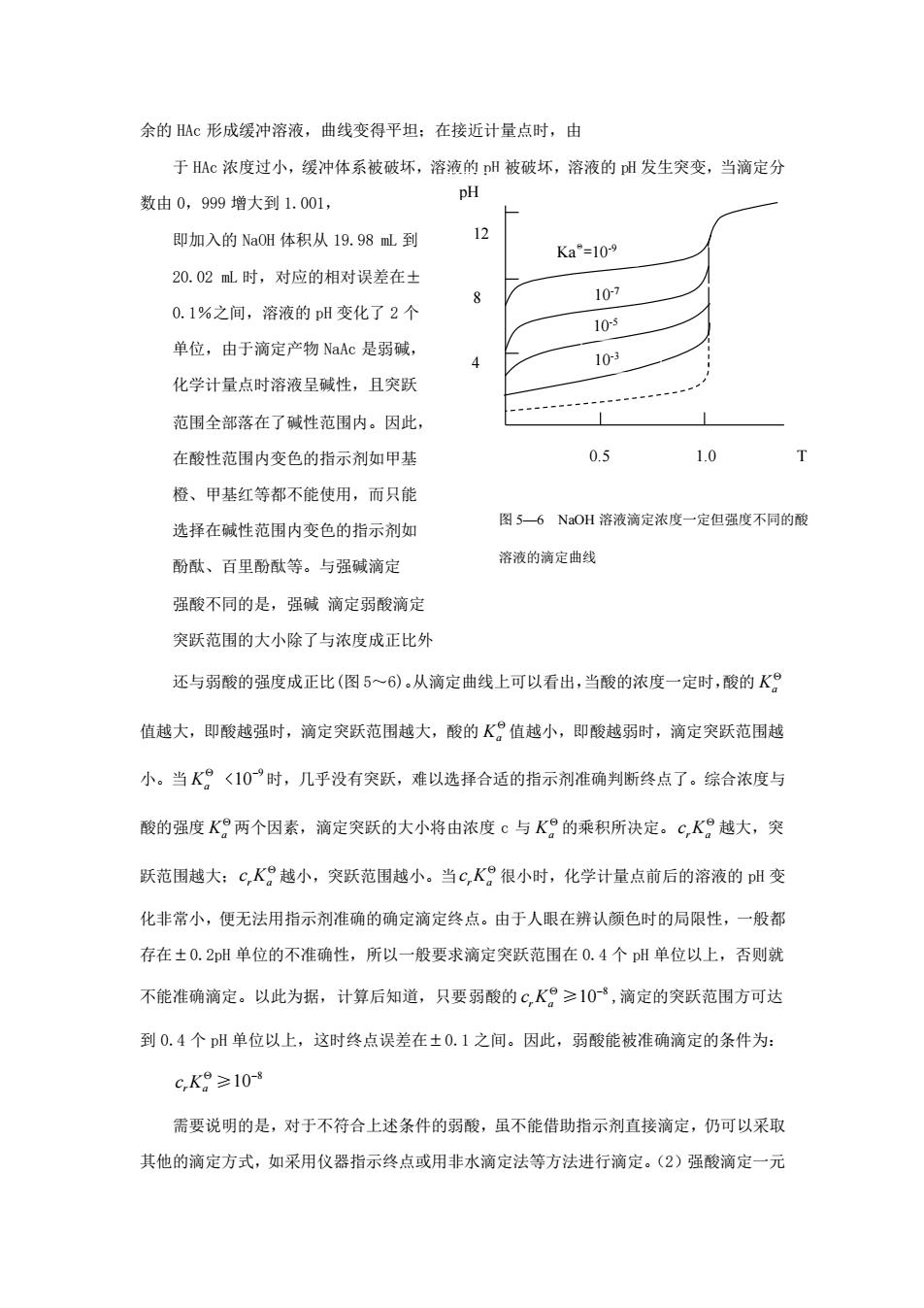
余的 HAc 形成缓冲溶液,曲线变得平坦;在接近计量点时,由 于 HAc 浓度过小,缓冲体系被破坏,溶液的 pH 被破坏,溶液的 pH 发生突变,当滴定分 数由 0,999 增大到 1.001, 即加入的 NaOH 体积从 19.98 mL 到 20.02 mL 时,对应的相对误差在± 0.1%之间,溶液的 pH 变化了 2 个 单位,由于滴定产物 NaAc 是弱碱, 化学计量点时溶液呈碱性,且突跃 范围全部落在了碱性范围内。因此, 在酸性范围内变色的指示剂如甲基 橙、甲基红等都不能使用,而只能 选择在碱性范围内变色的指示剂如 酚酞、百里酚酞等。与强碱滴定 强酸不同的是,强碱 滴定弱酸滴定 突跃范围的大小除了与浓度成正比外 还与弱酸的强度成正比(图 5~6)。从滴定曲线上可以看出,当酸的浓度一定时,酸的 K a 值越大,即酸越强时,滴定突跃范围越大,酸的 K a 值越小,即酸越弱时,滴定突跃范围越 小。当 K a < 9 10− 时,几乎没有突跃,难以选择合适的指示剂准确判断终点了。综合浓度与 酸的强度 K a 两个因素,滴定突跃的大小将由浓度 c 与 K a 的乘积所决定。 r a cK 越大,突 跃范围越大; r a cK 越小,突跃范围越小。当 r a cK 很小时,化学计量点前后的溶液的 pH 变 化非常小,便无法用指示剂准确的确定滴定终点。由于人眼在辨认颜色时的局限性,一般都 存在 0.2pH 单位的不准确性,所以一般要求滴定突跃范围在 0.4 个 pH 单位以上,否则就 不能准确滴定。以此为据,计算后知道,只要弱酸的 r a cK ≥ 8 10− ,滴定的突跃范围方可达 到 0.4 个 pH 单位以上,这时终点误差在 0.1 之间。因此,弱酸能被准确滴定的条件为: r a cK ≥ 8 10− 需要说明的是,对于不符合上述条件的弱酸,虽不能借助指示剂直接滴定,仍可以采取 其他的滴定方式,如采用仪器指示终点或用非水滴定法等方法进行滴定。(2)强酸滴定一元 图 5—6 NaOH 溶液滴定浓度一定但强度不同的酸 溶液的滴定曲线 10-7 10-5 pH T 12 4 8 0.5 1.0 10-3 KaΘ =10-9
余的 HAc 形成缓冲溶液,曲线变得平坦;在接近计量点时,由 于 HAc 浓度过小,缓冲体系被破坏,溶液的 pH 被破坏,溶液的 pH 发生突变,当滴定分 数由 0,999 增大到 1.001, 即加入的 NaOH 体积从 19.98 mL 到 20.02 mL 时,对应的相对误差在± 0.1%之间,溶液的 pH 变化了 2 个 单位,由于滴定产物 NaAc 是弱碱, 化学计量点时溶液呈碱性,且突跃 范围全部落在了碱性范围内。因此, 在酸性范围内变色的指示剂如甲基 橙、甲基红等都不能使用,而只能 选择在碱性范围内变色的指示剂如 酚酞、百里酚酞等。与强碱滴定 强酸不同的是,强碱 滴定弱酸滴定 突跃范围的大小除了与浓度成正比外 还与弱酸的强度成正比(图 5~6)。从滴定曲线上可以看出,当酸的浓度一定时,酸的 K a 值越大,即酸越强时,滴定突跃范围越大,酸的 K a 值越小,即酸越弱时,滴定突跃范围越 小。当 K a < 9 10− 时,几乎没有突跃,难以选择合适的指示剂准确判断终点了。综合浓度与 酸的强度 K a 两个因素,滴定突跃的大小将由浓度 c 与 K a 的乘积所决定。 r a cK 越大,突 跃范围越大; r a cK 越小,突跃范围越小。当 r a cK 很小时,化学计量点前后的溶液的 pH 变 化非常小,便无法用指示剂准确的确定滴定终点。由于人眼在辨认颜色时的局限性,一般都 存在 0.2pH 单位的不准确性,所以一般要求滴定突跃范围在 0.4 个 pH 单位以上,否则就 不能准确滴定。以此为据,计算后知道,只要弱酸的 r a cK ≥ 8 10− ,滴定的突跃范围方可达 到 0.4 个 pH 单位以上,这时终点误差在 0.1 之间。因此,弱酸能被准确滴定的条件为: r a cK ≥ 8 10− 需要说明的是,对于不符合上述条件的弱酸,虽不能借助指示剂直接滴定,仍可以采取 其他的滴定方式,如采用仪器指示终点或用非水滴定法等方法进行滴定。(2)强酸滴定一元 图 5—6 NaOH 溶液滴定浓度一定但强度不同的酸 溶液的滴定曲线 10-7 10-5 pH T 12 4 8 0.5 1.0 10-3 KaΘ =10-9