
由图可以看出,HCl、NaOH、AgNO,等强电解质的摩尔电 导率随的降低而增加,且当一→0时,A趋于定值。科尔劳乌斯 总结了大量实验事实得出:在很稀的溶液中,强电解质的摩尔 电导率与其浓度的平方根成直线关系。用公式表示为 Λm=Am-AVC (6-1-6) 式中:A为常数,Am°是当c→0时的摩尔电导率,称为无限 稀释摩尔电导率,或称为极限摩尔电导率。 CH,COOH等弱电解质当浓度很小时,其摩尔电导率随的 降低增加很快。这是因为弱电解质的浓度降低离解度增加,导 电的离子增加,使摩尔电导率迅速增加。Am与不成直线关系。 因此弱电解质的无限稀释摩尔电导率不能通过作图外推得到, 而要由下面的离子独立运动定律得到
由图可以看出,HCl、NaOH、AgNO3等强电解质的摩尔电 导率随的降低而增加,且当→0时,Λm趋于定值。科尔劳乌斯 总结了大量实验事实得出:在很稀的溶液中,强电解质的摩尔 电导率与其浓度的平方根成直线关系。用公式表示为 A c Λ m = Λ m − ∞ (6-1-6) 式中:A 为常数,Λm∞ 是当 c →0 时的摩尔电导率 ,称为无限 稀释摩尔电导率,或称为极限摩尔电导率。 CH3COOH等弱电解质当浓度很小时,其摩尔电导率随的 降低增加很快。这是因为弱电解质的浓度降低离解度增加,导 电的离子增加,使摩尔电导率迅速增加。Λm与不成直线关系。 因此弱电解质的无限稀释摩尔电导率不能通过作图外推得到, 而要由下面的离子独立运动定律得到
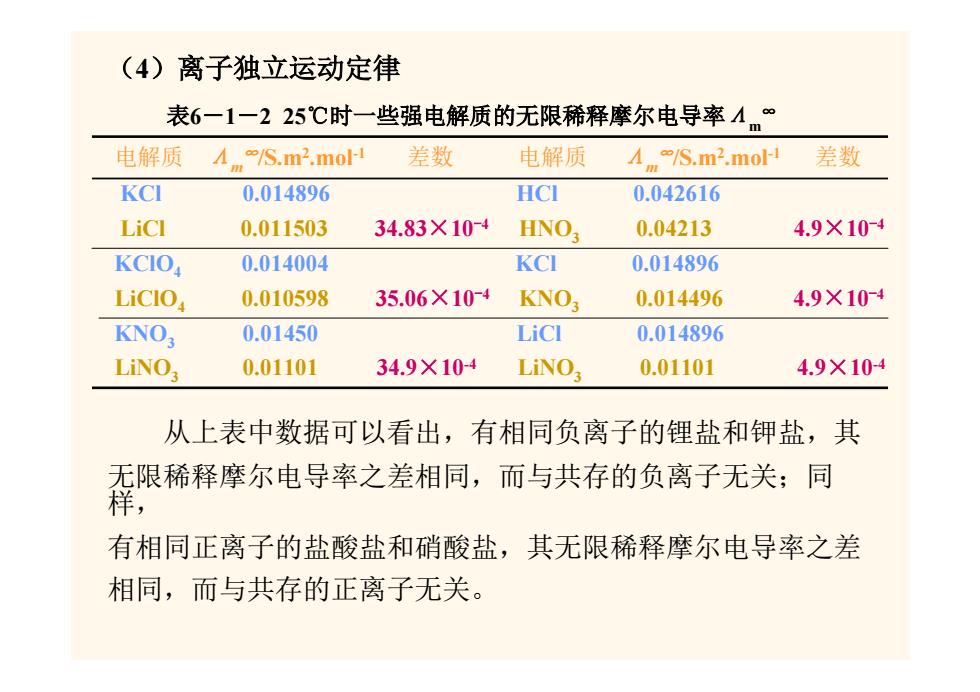
(4)离子独立运动定律 表6一1一225℃时一些强电解质的无限稀释摩尔电导率4 m 电解质 /S.m2.mol- 差数 电解质 /S.m2.mol-i 差数 KCI 0.014896 HCI 0.042616 LiCI 0.011503 34.83×10-4 HNO3 0.04213 4.9×10-4 KCIO 0.014004 KCI 0.014896 LiCIO 0.010598 35.06×10-4 KNO3 0.014496 4.9×10-4 KNO; 0.01450 LiCI 0.014896 LiNO; 0.01101 34.9×10-4 LiNO3 0.01101 4.9×104 从上表中数据可以看出,有相同负离子的锂盐和钾盐,其 无限稀释摩尔电导率之差相同,而与共存的负离子无关;同 有相同正离子的盐酸盐和硝酸盐,其无限稀释摩尔电导率之差 相同,而与共存的正离子无关
(4)离子独立运动定律 表6-1-2 25℃时一些强电解质的无限稀释摩尔电导率Λm∞ 电解质 Λm∞/S.m2.mol-1 差数 电解质 Λm∞/S.m2.mol-1 差数 KCl 0.014896 HCl 0.042616 LiCl 0.011503 34.83×10-4 HNO3 0.04213 4.9×10-4 KClO4 0.014004 KCl 0.014896 LiClO4 0.010598 35.06×10-4 KNO3 0.014496 4.9×10-4 KNO3 0.01450 LiCl 0.014896 LiNO3 0.01101 34.9×10-4 LiNO3 0.01101 4.9×10-4 从上表中数据可以看出,有相同负离子的锂盐和钾盐,其 无限稀释摩尔电导率之差相同,而与共存的负离子无关;同 样, 有相同正离子的盐酸盐和硝酸盐,其无限稀释摩尔电导率之差 相同,而与共存的正离子无关

离子独立移动定律:在无限稀释的溶液中,每一种离子的运 动是独立的,不受共存离子的影响。由此可以得出,在无限稀 释时,电解质的摩尔电导率为正、负离子的摩尔电导率之和,即 4m°=V+Am,+°+yAm,- (6-1-7) Am,+°和Am,分别为正、负离子的无限稀释摩尔电导率。 表6-1-3列出了25℃时水溶液中一些离子的无限稀释摩尔电导 率。有了离子的无限稀释摩尔电导率,则可按上式计算弱电解质 的无限稀释摩尔电导率,也可以直接用强电解质的无限稀释摩尔 电导率来计算弱电解质的无限稀释摩尔电导率。例如: Am°(HOAc)=Am(H+)+Am°(OAc) =Am(H+)+Am°(OAc)+Am°(C1-)+ -Am°(C)+Am°(Na+)-Am°(Nat) =Am°(HCI)+Am°(NaOAc)-Am”(NaCI)
离子独立移动定律:在无限稀释的溶液中,每一种离子的运 动是独立的,不受共存离子的影响。由此可以得出,在无限稀 释时,电解质的摩尔电导率为正、负离子的摩尔电导率之和,即 Λ m ∞ = ν + Λ m , + ∞ + ν - Λ m , - ∞ (6 - 1 - 7 ) Λm,+ ∞ 和 Λm,- ∞分别为正、负离子的无限稀释摩尔电导率。 表 6 -1 - 3列出了25℃时水溶液中一些离子的无限稀释摩尔电导 率。有了离子的无限稀释摩尔电导率,则可按上式计算弱电解质 的无限稀释摩尔电导率,也可以直接用强电解质的无限稀释摩尔 电导率来计算弱电解质的无限稀释摩尔电导率。例如: Λm ∞ (HOAc ) = Λm ∞ ( H +)+ Λm ∞ (OAc - ) = Λm ∞ ( H +)+ Λm ∞ ( OAc - )+ Λm ∞ (C1- ) + - Λm ∞ (Cl -)+ Λm ∞ (Na +)- Λm ∞ (Na + ) = Λm ∞ (HCl)+ Λm ∞ (NaOAc )- Λm ∞ (NaCl )

2)离子迁移数 (1)离子迁移数 电解质溶液导电是由正、负离子共同完成的,不同的离子运动 速度不同,传导的电量多少也不同,为此引入迁移数,离子B的 迁移数用符号表示,定义如下 tB=2B/O (6-1-8) 式中Q为离子B传导的电量,Q为通过溶液的总电量,即溶液中 各离子传导的电量之和,显然有 ∑gB=1 (6-1-9) 若溶液中只有一种正离子和一种负离子,则有 t三 (6-1- 1+O 0.+Q 10)
2)离子迁移数 (1)离子迁移数 电解质溶液导电是由正、负离子共同完成的,不同的离子运动 速度不同,传导的电量多少也不同,为此引入迁移数,离子B的 迁移数用符号 tB 表示,定义如下 tB = Q B /Q (6 - 1 - 8) 式中QB为离子B传导的电量,Q为通过溶液的总电量,即溶液中 各离子传导的电量之和,显然有 ΣB tB = 1 (6 - 1 - 9) 若溶液中只有一种正离子和一种负离子,则有 + − + + + = Q Q Q t + − − − + = Q Q Q t (6 - 1 - 10)
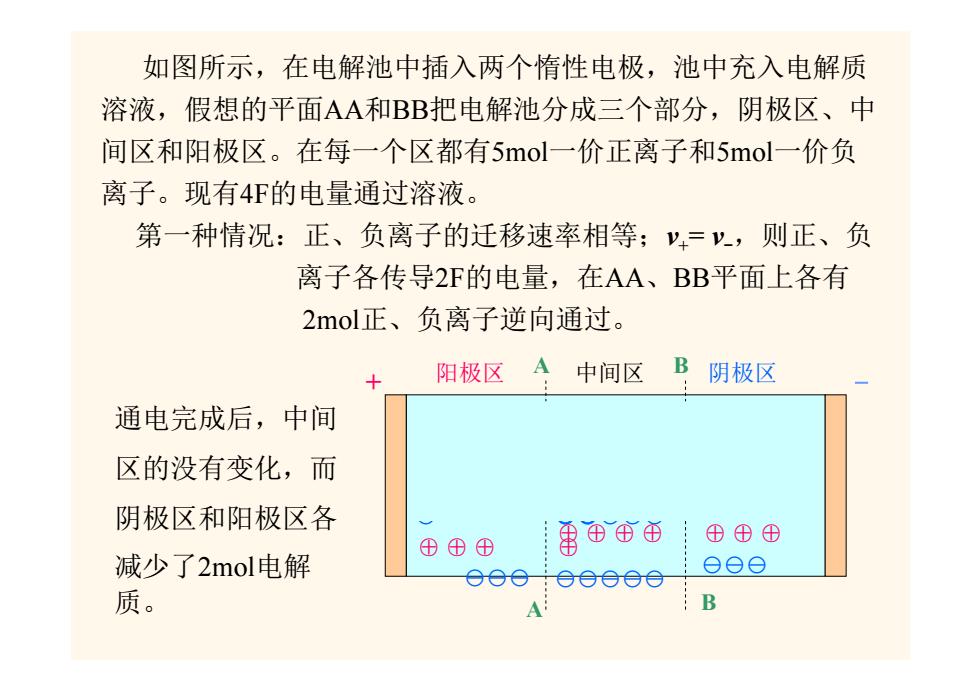
如图所示,在电解池中插入两个惰性电极,池中充入电解质 溶液,假想的平面AA和BB把电解池分成三个部分,阴极区、中 间区和阳极区。在每一个区都有5mol一价正离子和5mol一价负 离子。现有4F的电量通过溶液。 第一种情况:正、负离子的迁移速率相等;y,=,则正、负 离子各传导2F的电量,在AA、BB平面上各有 2mol正、负离子逆向通过。 阳极区 中间区 B 阴极区 通电完成后,中间 区的没有变化,而 阴极区和阳极区各 ⊕⊕⊕ 雷⊕$西 ⊕⊕⊕ 减少了2mol电解 eoe eeeee eee 质。 A B
如图所示,在电解池中插入两个惰性电极,池中充入电解质 溶液,假想的平面AA 和BB把电解池分成三个部分,阴极区、中 间区和阳极区。在每一个区都有5mol一价正离子和5mol一价负 离子。现有4F的电量通过溶液。 ⊕⊕⊕⊕ ⊕ ⊖⊖⊖⊖⊖ ⊕⊕⊕⊕ ⊕ ⊖⊖⊖⊖⊖ ⊕⊕⊕⊕ ⊕ ⊕⊕⊕ ⊕ ⊖⊖⊖⊖⊖ ⊕ ⊖ ⊕⊕⊕ ⊕ ⊕ ⊖⊖⊖⊖⊖ ⊕ ⊖⊖⊖⊖⊖ ⊕⊕⊕ ⊖⊖⊖ ⊕⊕⊕⊕ ⊕ ⊖⊖⊖⊖⊖ ⊕⊕⊕ ⊖⊖⊖ + - 阳极区 中间区 阴极区 第一种情况:正、负离子的迁移速率相等; v += v -,则正、负 离子各传导2F的电量,在AA 、BB平面上各有 2mol正、负离子逆向通过。 A A B B 通电完成后,中间 区的没有变化,而 阴极区和阳极区各 减少了2mol电解 质