
(2)电导、电导率和摩尔电导率的测定 电导是电阻的倒数,所以测定电导就是测定电阻。因直流 电通过电解质溶液时,在两极将发生电极反应,使溶液的浓度 发生变化,并会在两极析出产物而改变两电极的性质,所以测 定电导时必须使用交流电源。电导的测定是在电导池中进行, 引人电导池常数K,定义如下: Keell 1/A (6-1-4) 将上式代入到电导的计算式,得 K=G.Kcell=Kcell /R (6-1-5) 若K己知,则测出溶液的电阻后,即可按上式计算溶液的电 导率。 K©的测定可用一己知电导率的溶液,例如各种不同浓度的 KCI溶液,装入电导池中,测定其电阻,按式(6-1-5)计算 出电导池常数
(2)电导、电导率和摩尔电导率的测定 电导是电阻的倒数,所以测定电导就是测定电阻。因直流 电通过电解质溶液时,在两极将发生电极反应,使溶液的浓度 发生变化,并会在两极析出产物而改变两电极的性质,所以测 定电导时必须使用交流电源。电导的测定是在电导池中进行, 引人电导池常数Kcell,定义如下: Kcell = l / A (6 -1-4) 将上式代入到电导的计算式,得 κ= G . Kcell = Kcell / R (6-1-5) 若Kcell 已知,则测出溶液的电阻后,即可按上式计算溶液的电 导率。 Kcell 的测定可用一已知电导率的溶液,例如各种不同浓度的 KCl溶液,装入电导池中,测定其电阻,按式(6 -1- 5)计算 出电导池常数

表6-1-125℃时KC1水溶液的电导率 c/(mol.dm-3) 1 0.1 0.01 0.001 0.0001 x/(S.m-1) 11.19 1.289 0.1413 0.01416 0.001489 同一电导池测定待测溶液的电阻,因电导池常数己知,所以 可按是(6-1-5)计算待测溶液的电导率。电导率求出后,根 据式(6-1-3)可计算摩尔电导率。 例6-225℃时,在一电导池中装入0.01mol.dm-3KCI溶液测得 电阻为1502,若用同一电导池装入0.01mol.dm-3HC1溶液 测得电阻为51.42。试计算: 1)电导池常数; 2)0.01mol.dm-3HCl溶液的电导率; 3)0.01mol.dm-3HCl溶液的摩尔电导率
表6-1-1 25℃时KCl水溶液的电导率 同一电导池测定待测溶液的电阻,因电导池常数已知,所以 可按是(6-1 - 5)计算待测溶液的电导率。电导率求出后,根 据式(6 - 1 - 3)可计算摩尔电导率。 例6 – 2 25℃时,在一电导池中装入0.01mol.dm-3KCl溶液测得 电阻为150Ω,若用同一电导池装入0.01mol.dm-3HCl溶液 测得电阻为51.4Ω。试计算: 1)电导池常数; 2)0.01mol.dm-3HCl溶液的电导率; 3)0.01mol.dm-3HCl溶液的摩尔电导率。 c /(mol.dm-3) 1 0.1 0.01 0.001 0.0001 κ/(S.m-1) 11.19 1.289 0.1413 0.01416 0.001489

例6-225℃时,在一电导池中装入0.01mol.dm-3KC1溶液测得 电阻为1502,若用同一电导池装入0.01mol.dm3HCI溶液测 得电阻为51.42。试计算: 1)电导池常数; 2)0.01mol.dm-3HC溶液的电导率; 3)0.01mol.dm-3HCl溶液的摩尔电导率。 解:查表得0.01mol.dm3KCl溶液的电导率为0.1413S.m-l。 Keell=x(KCI)/G(KCI)=(KCI)XR(KCI) =0.1413×150m-1=21.95m1 K(HCI)=KcellXG (HCI)=Kcell/R (HCI) =21.59m1/51.42=0.4124S.m1 Am=k/c=0.4124S.m-1/0.01mol.dm-3×1000 =0.04124S.m2.mol-1
例6 – 2 25℃时,在一电导池中装入0.01mol.dm-3KCl溶液测得 电阻为150Ω,若用同一电导池装入0.01mol.dm-3HCl溶液测 得电阻为51.4Ω。试计算: 1)电导池常数; 2)0.01mol.dm-3HCl溶液的电导率; 3)0.01mol.dm-3HCl溶液的摩尔电导率。 解:查表得 0.01mol.dm-3 KCl溶液的电导率为0.1413S.m-1。 Kcell = κ( KCl ) /G ( KCl ) =κ(KCl)×R (KCl) = 0.1413×150m-1 = 21.95m-1 κ(HCl) = Kcell×G(HCl)= Kcell / R(HCl) = 21.59 m-1 /51.4 Ω = 0.4124 S.m-1 Λ m = κ / c = 0.4124 S.m-1 / 0.01mol.dm-3 ×1000 = 0.04124S.m2.mol-1
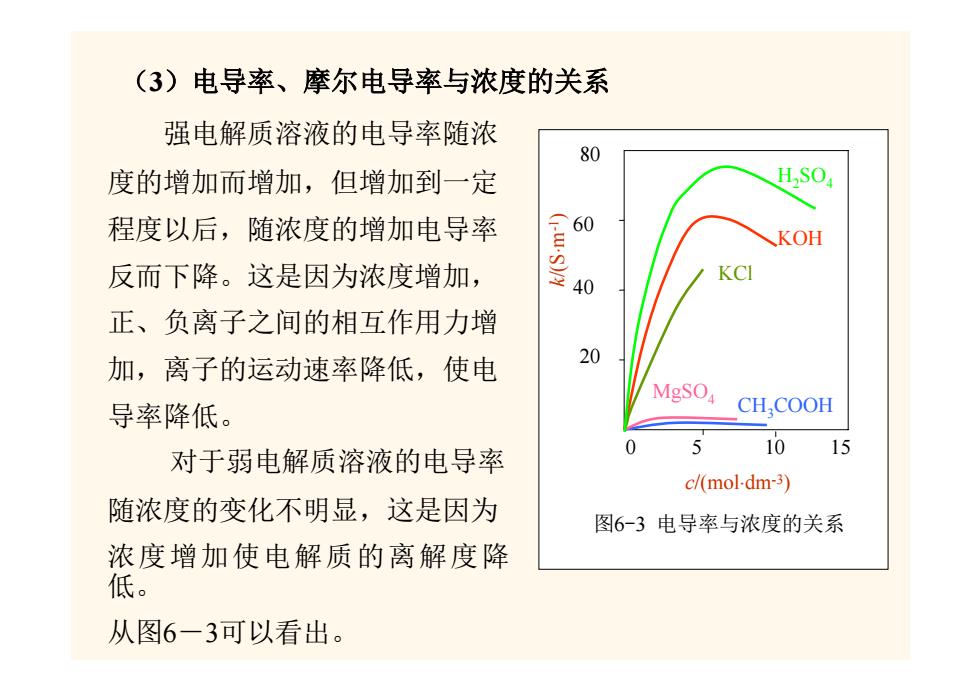
(3)电导率、摩尔电导率与浓度的关系 强电解质溶液的电导率随浓 80 度的增加而增加,但增加到一定 程度以后,随浓度的增加电导率 KOH 反而下降。这是因为浓度增加, KCI 正、负离子之间的相互作用力增 加,离子的运动速率降低,使电 20 MgSO 导率降低。 CH,COOH 10 对于弱电解质溶液的电导率 15 c/(mol-dm-3) 随浓度的变化不明显,这是因为 图6-3电导率与浓度的关系 浓度增加使电解质的离解度降 低。 从图6一3可以看出
(3)电导率、摩尔电导率与浓度的关系 k/(S ⋅ m-1 ) H2SO4 KOH KCl MgSO4 CH3COOH 0 15 5 10 c/(mol⋅dm-3) 20 40 60 80 图6-3 电导率与浓度的关系 强电解质溶液的电导率随浓 度的增加而增加,但增加到一定 程度以后,随浓度的增加电导率 反而下降。这是因为浓度增加, 正、负离子之间的相互作用力增 加,离子的运动速率降低,使电 导率降低。 对于弱电解质溶液的电导率 随浓度的变化不明显,这是因为 浓度增加使电解质的离解度降 低。 从图6-3可以看出
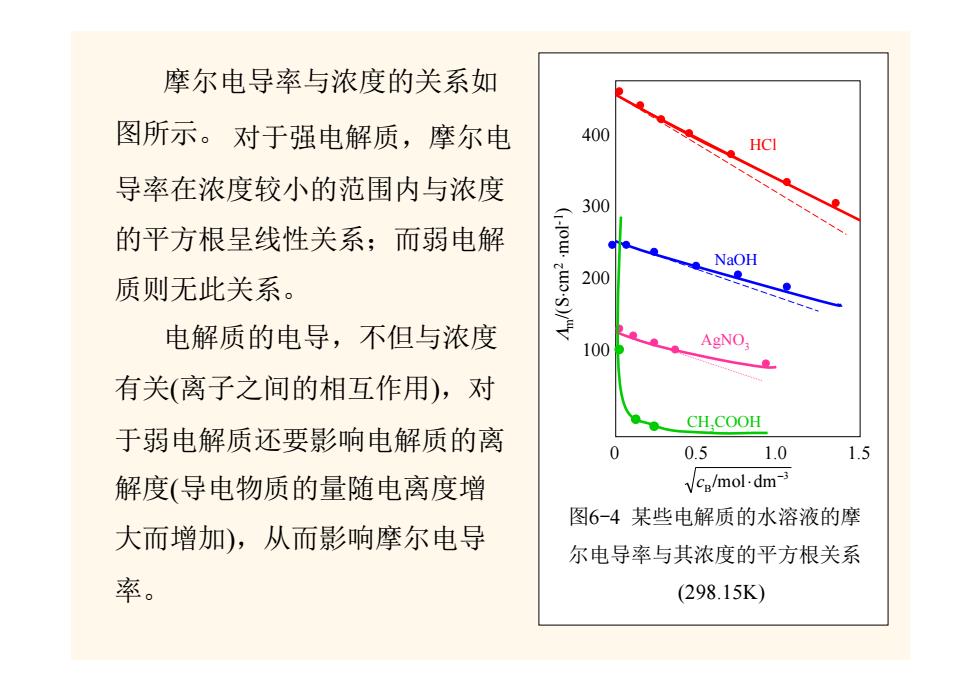
摩尔电导率与浓度的关系如 图所示。对于强电解质,摩尔电 400 HCI 导率在浓度较小的范围内与浓度 300 的平方根呈线性关系;而弱电解 NaOH 质则无此关系。 200 0 电解质的电导,不但与浓度 100 AgNO; 有关(离子之间的相互作用),对 CH.COOH 于弱电解质还要影响电解质的离 0.5 1.0 1.5 解度(导电物质的量随电离度增 Vca/mol.dm-3 图6-4某些电解质的水溶液的摩 大而增加),从而影响摩尔电导 尔电导率与其浓度的平方根关系 率。 (298.15K)
图6-4 某些电解质的水溶液的摩 尔电导率与其浓度的平方根关系 (298.15K) 400 300 200 100 3 B/mol dm− c ⋅ Λm/(S ⋅cm 2 ⋅mol-1 ) HCl NaOH AgNO3 CH3COOH 0 0.5 1.0 1.5 摩尔电导率与浓度的关系如 图所示。 对于强电解质,摩尔电 导率在浓度较小的范围内与浓度 的平方根呈线性关系;而弱电解 质则无此关系。 电解质的电导,不但与浓度 有关(离子之间的相互作用),对 于弱电解质还要影响电解质的离 解度(导电物质的量随电离度增 大而增加),从而影响摩尔电导 率