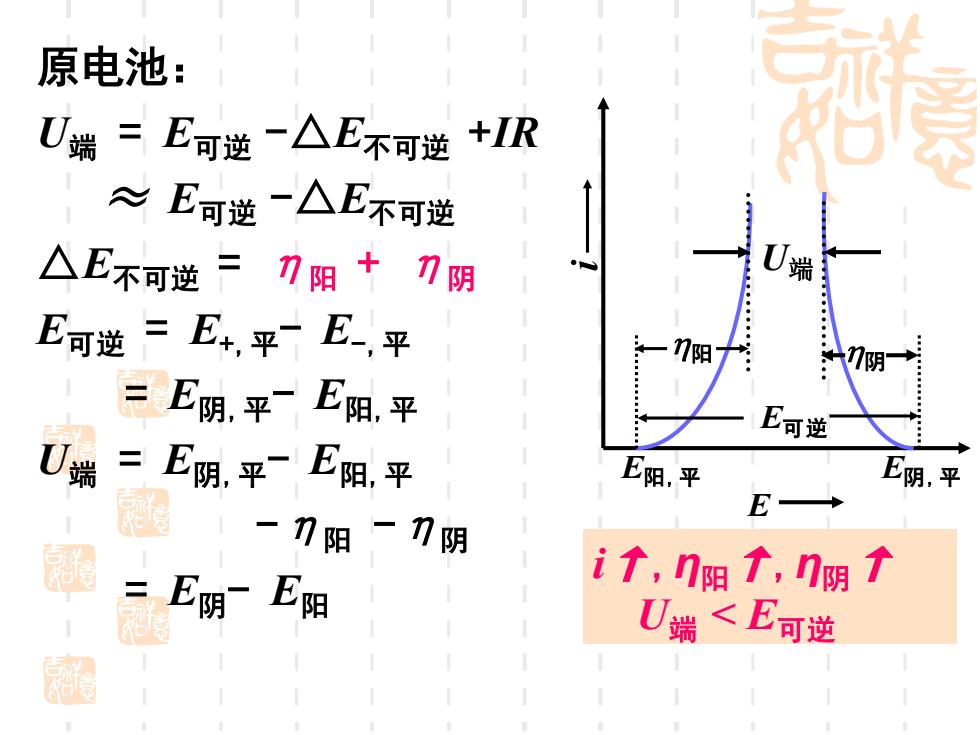
原电池: U端=E可逆一△E不可逆+IR ≈E可逆一△E不可逆 △E不可逆=刀阳+刀阴 端 E可逆=E+,平一E平 阳 7阴 =E阴,平E阳.平 E可逆 U端 =E阴平E阳平 E阳,平 E阴,平 E→ -刀阳-刀阴 思 =E阴E阳 i↑,门阳↑,n阴 U端<E可逆 园
原电池: U端 = E可逆 -△E不可逆 +IR ≈ E可逆 -△E不可逆 △E不可逆 = η阳 + η阴 E可逆 = E+,平- E-,平 = E阴,平- E阳,平 U端 = E阴,平- E阳,平 -η阳 -η阴 = E阴- E阳 i E E阳,平 E阴,平 U端 E可逆 阳 阴 i↑,η阳↑,η阴↑ U端 < E可逆
有极化存在 电解池:消耗更多电功 原电池:输出更少电功 超 图 极化耗更多能量
有极化存在 电解池:消耗更多电功 原电池:输出更少电功 极化耗更多能量

五.极化的种类 1.电阻极化 克服导体电阻需要消耗电能 刀电阻=IR→I十,刀才 R三R极板+R电解液 氧化膜,吸附层等 电阻极化的消除方法:降低电阻 如:鲁金毛细管 导电性好的电极材料 圈
1.电阻极化 克服导体电阻需要消耗电能 η电阻= IR → I↑,η↑ R = R极板 + R电解液 氧化膜,吸附层等 电阻极化的消除方法:降低电阻 如:鲁金毛细管 导电性好的电极材料 五.极化的种类
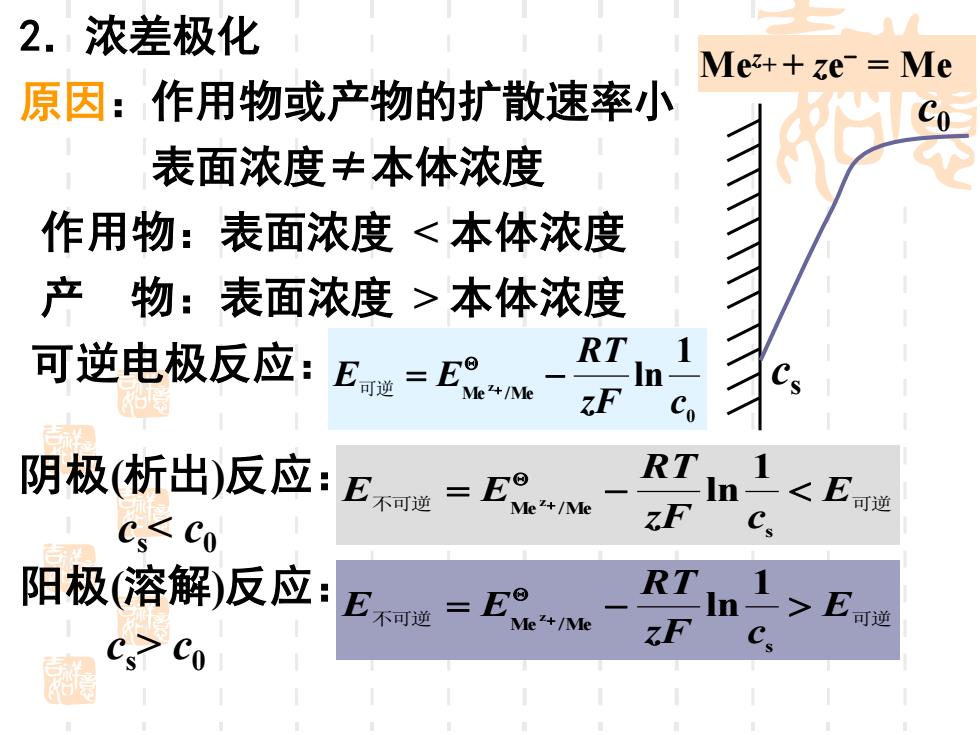
2.浓差极化 Mez++ze=Me 原因:作用物或产物的扩散速率小 表面浓度丰本体浓度 作用物:表面浓度<本体浓度 产物:表面浓度>本体浓度 可逆电极反应:En=以 RT ln Co 阴极(析出)反应:E造=E RTIn】<E可 Cs<Co zF 阳极(溶解)反应: E不=E RT In1>Ene cs co C
2.浓差极化 原因:作用物或产物的扩散速率小 表面浓度≠本体浓度 作用物:表面浓度 < 本体浓度 产 物:表面浓度 > 本体浓度 可逆电极反应: 阴极(析出)反应: cs < c0 阳极(溶解)反应: cs > c0 cs c0 Mez+ + ze - = Me 不可逆 E可逆 zF c RT E = E − + s Me /Me 1 z ln 0 Me /Me 1 z ln zF c RT E = E − 可逆 + 不可逆 E可逆 zF c RT E = E − + s Me /Me 1 z ln

RT 门依老E可一E不河 c 门脓差的大小取决于扩散层两侧的浓度差大小 搅拌可以降低门浓差 3。电化学极化(活化极化) (电)化学反应需要活化能→ 消耗电能获取 →产生电化学极化→门电化学反应或门电化 电极反应表观超电势为三者之和: 阳喝 园 =门电阻+门浓差+门电化
η浓差的大小取决于扩散层两侧的浓度差大小 搅拌可以降低η浓差 | | | ln | s 0 c c zF RT 浓差 = E可逆 − E不可逆 = 3.电化学极化(活化极化) (电)化学反应需要活化能 → 消耗电能获取 →产生电化学极化→η电化学反应或η电化 电极反应表观超电势为三者之和: η=η电阻 +η浓差 +η电化