
U-Emat=IR,I=0时,U=Emax 理论分解电压 实际分解电压一U分>Emx→极化 二、析出电势与溶解电势 电极反应析出单质物质的有: 阴极—析出金属、H2.阳极—析出02、C2 析出电势 实际在电极上能显著析出单质物 质的最小电极电势。 阳极反应使阳极金属溶解为金属离子对应的 溶解电势 实际在电极上能显著使阳极溶解 的最小电势
U-Emax =IR,I = 0时,U =Emax——理论分解电压 实际分解电压——U分> Emax →极化 二、析出电势与溶解电势 电极反应析出单质物质的有: 阴极——析出金属、H2, 阳极——析出O2、Cl2 析出电势 —— 实际在电极上能显著析出单质物 质的最小电极电势。 阳极反应使阳极金属溶解为金属离子对应的 溶解电势 —— 实际在电极上能显著使阳极溶解 的最小电势

理论上,析出电势(或溶解电势)=可逆电极电势 实际上,析出电势(或溶解电势)≠可逆电极电势 这种现象一极化→实际电势≠可逆电势 析出电势或溶解电势都与电极反应本性、电极反 应的作用物、产物浓度(分压)、温度、电极金 属导体材料性质、电极极化的难易程度有关。 利用E析出或E溶解不同,可控制复杂电化学体系中 先析出或先溶解的物质,以达到分离的目的
理论上,析出电势(或溶解电势) = 可逆电极电势 实际上,析出电势(或溶解电势) ≠ 可逆电极电势 这种现象 —— 极化 →实际电势≠可逆电势 析出电势或溶解电势都与电极反应本性、电极反 应的作用物、产物浓度(分压)、温度、电极金 属导体材料性质、电极极化的难易程度有关。 利用E析出或E溶解不同,可控制复杂电化学体系中, 先析出或先溶解的物质,以达到分离的目的

三、超电势与极化曲线 在一定的电流密度下,实际电极电势与可逆电极 电势差值的绝对值一超电势: 门=|E电极(实际)一E电极(何逆|>0 刀个,电极极化程度个 刀正值 实验表明: 阳极极化使阳极实际电势比平衡电势更正 阴极极化使阴极实际电势比平衡电势更负
三、超电势与极化曲线 在一定的电流密度下,实际电极电势与可逆电极 电势差值的绝对值 —— 超电势: η= | E电极(实际) - E电极(可逆) | > 0 η↑,电极极化程度↑ η正值 实验表明: 阳极极化使阳极实际电势比平衡电势更正 阴极极化使阴极实际电势比平衡电势更负
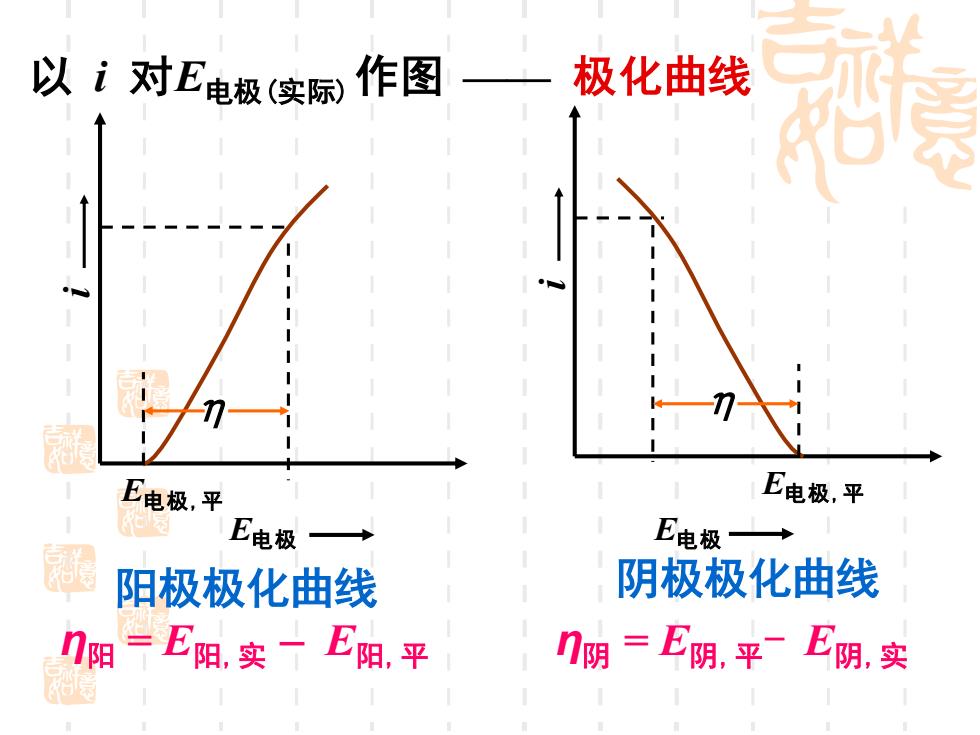
以i对E电极实际) 作图—一极化曲线 E电极,平 E电极,平 E电极 E电极→ 阳极极化曲线 阴极极化曲线 η阳 =E阳.实一E阳,平 门阴=E阴,平E阴,实
以 i 对E电极(实际)作图 —— 极化曲线 阳极极化曲线 阴极极化曲线 E电极,平 η i E电极 E电极,平 η i E电极 η阳 = E阳,实 – E阳,平 η阴 = E阴,平- E阴,实
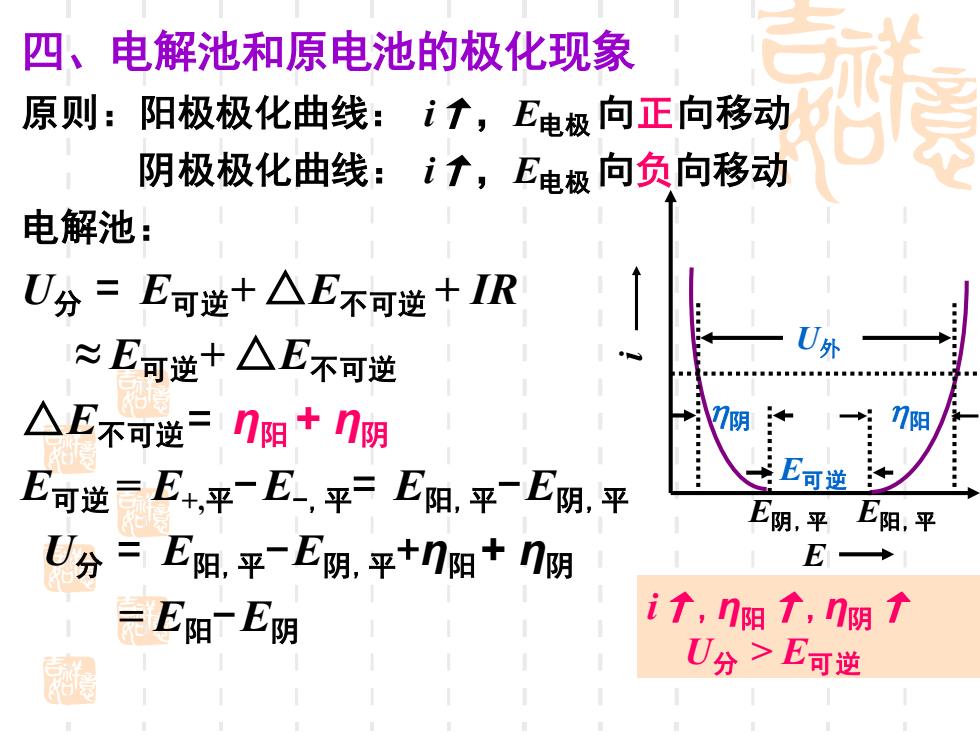
四、电解池和原电池的极化现象 原则:阳极极化曲线:i↑,E电极向正向移动 阴极极化曲线:i↑,E电极向负向移动 电解池: U分=E可逆+△E不可逆+IR ≈E可逆十△E不可逆 U外 △E不阿逆=几阳+几阴 : 7阴 阳 E可逆=E+,平E,平=E阳,平E阴,平 E可 E阴,平 E阳,平 U分=E阳,平-E阴,平+门阳+门阴 E- =E阳一E阴 i↑,门阳f,I阴t 超 U分>E可逆
四、电解池和原电池的极化现象 原则:阳极极化曲线: i↑,E电极 向正向移动 阴极极化曲线: i↑,E电极 向负向移动 电解池: U分 = E可逆+ △E不可逆 + IR ≈ E可逆+ △E不可逆 △E不可逆 = η阳 + η阴 E可逆 = E+,平-E-,平= E阳,平-E阴,平 U分 = E阳,平-E阴,平+η阳 + η阴 = E阳-E阴 E E可逆 U外 阴 阳 E阴,平 E阳,平 i i↑,η阳↑,η阴↑ U分 > E可逆