
MnSO4+2NaOH-Mn(OH)2+Na2SO4 2Mn(OH)2+O2 -MnO(OH)2 MnO(OH)2+Mn(OH)2 -MnMnO3+2H2O MnMnO3+3H2SO4+2KI-2MnSO4+I2+3H2O+K2SO4 I2+2Na2S2O3 -2NaI+NaS4O6 受样品颜色和还原性的影响 ◇化学法 一分子的溶氧-一分子的碘- 两分子的硫代硫酸钠
MnSO4+2NaOH-Mn(OH)2+Na2SO4 2Mn(OH)2+O2 -MnO(OH)2 MnO(OH)2+Mn(OH)2 -MnMnO3+2H2O MnMnO3+3H2SO4+2KI-2MnSO4+I2+3H2O+K2SO4 I2+2Na2S2O3 -2NaI+NaS4O6 受样品颜色和还原性的影响 ◇化学法 一分子的溶氧-一分子的碘- 两分子的硫代硫酸钠

溶解氧在一定的条件下,被还原成H2O2 酸性时:O2+2H++2e-H2O2 中性或碱性时:O2+2H2O+2e-H2O2+OH- 在待测样液中,加入一个固定电压(0.8V),在阴极处 发生上述反应,使待测液主体与阴极表面附近的液体存 在溶氧浓度差,通过测定电流的大小,求出液体的溶氧 浓度。CL=(i·L)/(2F·DL·A) 式中:i;电流(A); F:法拉第常数;A:阴极表面的表面积; CL : 待测液的溶氧浓度(mol/m3 ), L: 液膜厚度(m) DL—氧在液相中的分子扩散系数,m2 /s;. 反映的准确性受溶液的其它 氧化还原物质的影响 ◇极谱法
溶解氧在一定的条件下,被还原成H2O2 酸性时:O2+2H++2e-H2O2 中性或碱性时:O2+2H2O+2e-H2O2+OH- 在待测样液中,加入一个固定电压(0.8V),在阴极处 发生上述反应,使待测液主体与阴极表面附近的液体存 在溶氧浓度差,通过测定电流的大小,求出液体的溶氧 浓度。CL=(i·L)/(2F·DL·A) 式中:i;电流(A); F:法拉第常数;A:阴极表面的表面积; CL : 待测液的溶氧浓度(mol/m3 ), L: 液膜厚度(m) DL—氧在液相中的分子扩散系数,m2 /s;. 反映的准确性受溶液的其它 氧化还原物质的影响 ◇极谱法
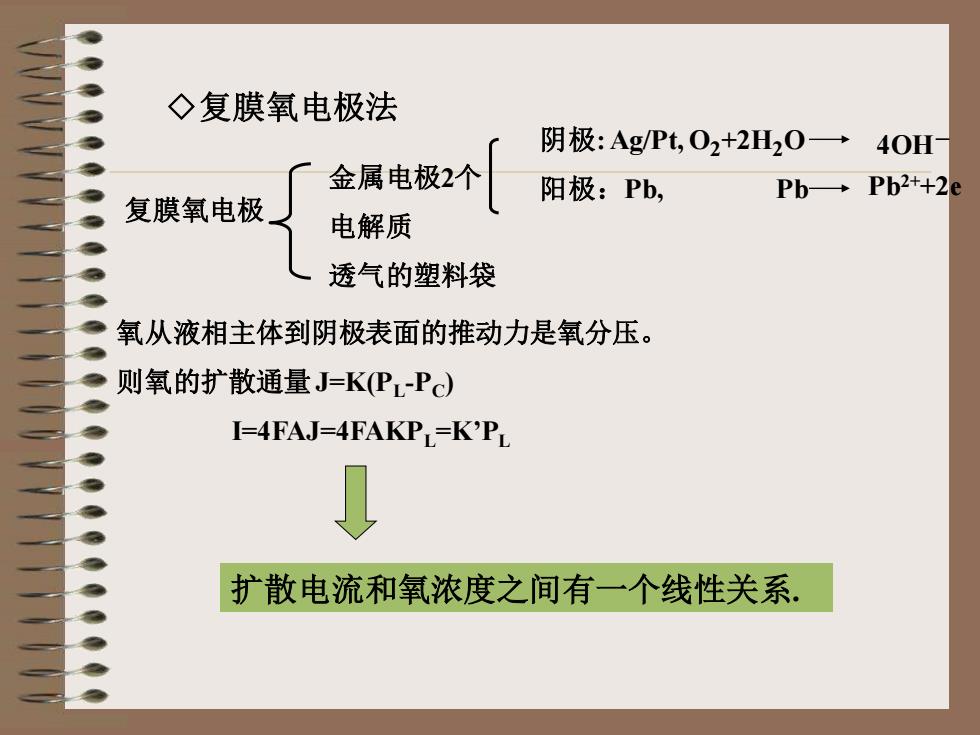
◇复膜氧电极法 复膜氧电极 金属电极2个 电解质 透气的塑料袋 阴极: Ag/Pt, O2+2H2O 阳极:Pb, Pb 4OH- Pb2++2e 氧从液相主体到阴极表面的推动力是氧分压。 则氧的扩散通量J=K(PL-PC) I=4FAJ=4FAKPL=K’PL 扩散电流和氧浓度之间有一个线性关系
◇复膜氧电极法 复膜氧电极 金属电极2个 电解质 透气的塑料袋 阴极: Ag/Pt, O2+2H2O 阳极:Pb, Pb 4OH- Pb2++2e 氧从液相主体到阴极表面的推动力是氧分压。 则氧的扩散通量J=K(PL-PC) I=4FAJ=4FAKPL=K’PL 扩散电流和氧浓度之间有一个线性关系

◇压力法 恒温密闭容器中,有体积为VL的液体。通入气体压力为P1 ,体积 为VG的气体至平衡时为P2。 即有(P1 -P2 )VG=n RT n=SVL , S= (P1 -P2 )VG/RTVL, S: 氧的溶解度(mol/m3 ); R: 气体常数,T: 绝对温度
◇压力法 恒温密闭容器中,有体积为VL的液体。通入气体压力为P1 ,体积 为VG的气体至平衡时为P2。 即有(P1 -P2 )VG=n RT n=SVL , S= (P1 -P2 )VG/RTVL, S: 氧的溶解度(mol/m3 ); R: 气体常数,T: 绝对温度
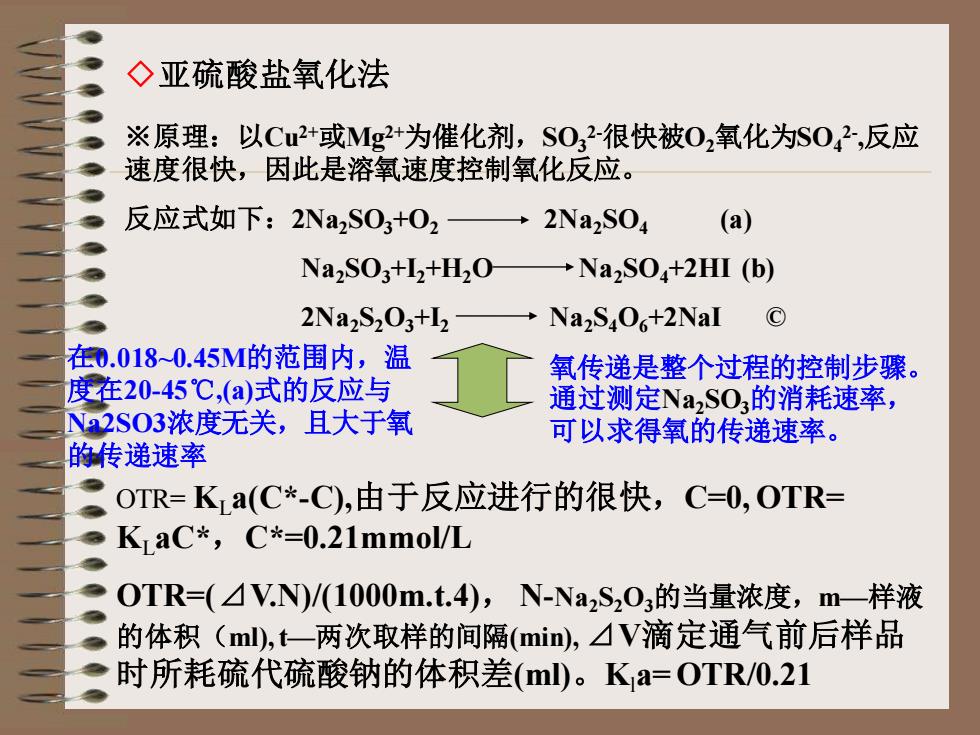
◇亚硫酸盐氧化法 ※原理:以Cu2+或Mg2+为催化剂,SO3 2-很快被O2氧化为SO4 2- ,反应 速度很快,因此是溶氧速度控制氧化反应。 反应式如下:2Na2SO3+O2 2Na2SO4 (a) Na2SO3+I2+H2O Na2SO4+2HI (b) 2Na2S2O3+I2 Na2S4O6+2NaI © OTR= KLa(C*-C),由于反应进行的很快,C=0, OTR= KLaC*,C*=0.21mmol/L OTR=(⊿V.N)/(1000m.t.4), N-Na2S2O3的当量浓度,m—样液 的体积(ml), t—两次取样的间隔(min), ⊿V滴定通气前后样品 时所耗硫代硫酸钠的体积差(ml)。Kla= OTR/0.21 在0.018~0.45M的范围内,温 度在20-45℃,(a)式的反应与 Na2SO3浓度无关,且大于氧 的传递速率 氧传递是整个过程的控制步骤。 通过测定Na2SO3的消耗速率, 可以求得氧的传递速率
◇亚硫酸盐氧化法 ※原理:以Cu2+或Mg2+为催化剂,SO3 2-很快被O2氧化为SO4 2- ,反应 速度很快,因此是溶氧速度控制氧化反应。 反应式如下:2Na2SO3+O2 2Na2SO4 (a) Na2SO3+I2+H2O Na2SO4+2HI (b) 2Na2S2O3+I2 Na2S4O6+2NaI © OTR= KLa(C*-C),由于反应进行的很快,C=0, OTR= KLaC*,C*=0.21mmol/L OTR=(⊿V.N)/(1000m.t.4), N-Na2S2O3的当量浓度,m—样液 的体积(ml), t—两次取样的间隔(min), ⊿V滴定通气前后样品 时所耗硫代硫酸钠的体积差(ml)。Kla= OTR/0.21 在0.018~0.45M的范围内,温 度在20-45℃,(a)式的反应与 Na2SO3浓度无关,且大于氧 的传递速率 氧传递是整个过程的控制步骤。 通过测定Na2SO3的消耗速率, 可以求得氧的传递速率