
氧的饱和浓度单位:mmol O2/L, mg O2/L, ppm 或大气压 气体和溶液接触一定时间后,气体分子在气-液二相中的 浓度,就会达到动态平衡,此时溶解到溶液中的气体分子 数等于逸出溶液的气体分子数。若外界条件不变,气体在 溶液中的浓度就不再随时间而变化,此浓度为饱和浓度或 平衡浓度 2、饱和浓度
氧的饱和浓度单位:mmol O2/L, mg O2/L, ppm 或大气压 气体和溶液接触一定时间后,气体分子在气-液二相中的 浓度,就会达到动态平衡,此时溶解到溶液中的气体分子 数等于逸出溶液的气体分子数。若外界条件不变,气体在 溶液中的浓度就不再随时间而变化,此浓度为饱和浓度或 平衡浓度 2、饱和浓度

3、影响饱和浓度值的因素 1)温度 随着温度升高,气体分 子运动加快,使饱和浓 度下降。 在1个大气压及不同温度 下纯氧在水中的溶解度(mmol/L) 温度 (ºC) 溶解度 0 2.18 10 1.70 15 1.54 20 1.38 25 1.26 30 1.16 35 1.09 40 1.03
3、影响饱和浓度值的因素 1)温度 随着温度升高,气体分 子运动加快,使饱和浓 度下降。 在1个大气压及不同温度 下纯氧在水中的溶解度(mmol/L) 温度 (ºC) 溶解度 0 2.18 10 1.70 15 1.54 20 1.38 25 1.26 30 1.16 35 1.09 40 1.03

当纯水与一个大气压的空气相平衡时,温度对氧 饱和浓度的影响也可用下列经验公式来计算(适用 浓度为4~33ºC) C* = 14.68/ (31.6 + t) C* -与1个大气压空气相平衡的水中氧的饱和浓度,mol/m3 t-溶液的温度,ºC
当纯水与一个大气压的空气相平衡时,温度对氧 饱和浓度的影响也可用下列经验公式来计算(适用 浓度为4~33ºC) C* = 14.68/ (31.6 + t) C* -与1个大气压空气相平衡的水中氧的饱和浓度,mol/m3 t-溶液的温度,ºC
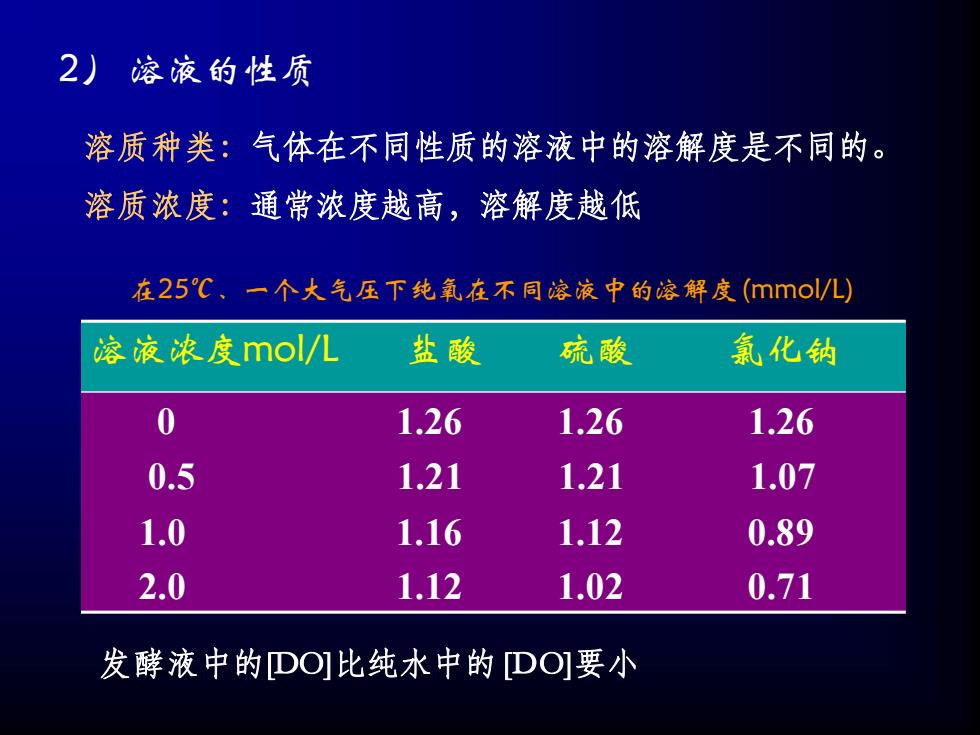
2) 溶液的性质 溶质种类:气体在不同性质的溶液中的溶解度是不同的。 溶质浓度:通常浓度越高,溶解度越低 溶液浓度mol/L 盐酸 硫酸 氯化钠 0 1.26 1.26 1.26 0.5 1.21 1.21 1.07 1.0 1.16 1.12 0.89 2.0 1.12 1.02 0.71 在25℃、一个大气压下纯氧在不同溶液中的溶解度(mmol/L) 发酵液中的[DO]比纯水中的[DO]要小
2) 溶液的性质 溶质种类:气体在不同性质的溶液中的溶解度是不同的。 溶质浓度:通常浓度越高,溶解度越低 溶液浓度mol/L 盐酸 硫酸 氯化钠 0 1.26 1.26 1.26 0.5 1.21 1.21 1.07 1.0 1.16 1.12 0.89 2.0 1.12 1.02 0.71 在25℃、一个大气压下纯氧在不同溶液中的溶解度(mmol/L) 发酵液中的[DO]比纯水中的[DO]要小

在系统总分压小于5个大气压的情况下,氧的溶解度与总 压和其他气体的分压无关,只与氧分压成直线相关,可用 Henry定律表示: C* = PO2/H 3)氧分压 C* — 与气相PO2达平衡时溶液中的氧浓度,mmolO2/L PO2 — 氧分压, Pa H — Henry常数(与溶液性质、温度等有关),Pa·L/mmolO2 气相中氧浓度增加,溶液中溶氧浓度亦随之增加,必 要时可向发酵液中通入纯氧以提高溶氧
在系统总分压小于5个大气压的情况下,氧的溶解度与总 压和其他气体的分压无关,只与氧分压成直线相关,可用 Henry定律表示: C* = PO2/H 3)氧分压 C* — 与气相PO2达平衡时溶液中的氧浓度,mmolO2/L PO2 — 氧分压, Pa H — Henry常数(与溶液性质、温度等有关),Pa·L/mmolO2 气相中氧浓度增加,溶液中溶氧浓度亦随之增加,必 要时可向发酵液中通入纯氧以提高溶氧