
四、 食品中酸的来源: ① 原料带入 ②加工过程中人为加入 ③生产中有意让原料产酸 各种添加剂带入 ⑤生产加工不当,贮藏、运输中污染
四、 食品中酸的来源: ⑤ 生产加工不当,贮藏、运输中污染 ① 原料带入 ② 加工过程中人为加入 ③ 生产中有意让原料产酸 ④ 各种添加剂带入

第二节「 酸度的测定 一、总酸渡的测定(滴定法) (一)原理 用标准碱液滴定食品中的酸,中和生成盐,用酚酞做 指示剂。当滴定终点(pH=8.2,指示剂显红色)时,根 据耗用的标准碱液的体积,计算出总酸的含量。 RCOOH+NaoH-RCOONa+H20
第二节 酸度的测定 一、总酸度的测定(滴定法) (一)原理 用标准碱液滴定食品中的酸,中和生成盐,用酚酞做 指示剂。当滴定终点 (pH=8.2,指示剂显红色)时,根 据耗用的标准碱液的体积,计算出总酸的含量。 RCOOH+NaOH→RCOONa+H2O
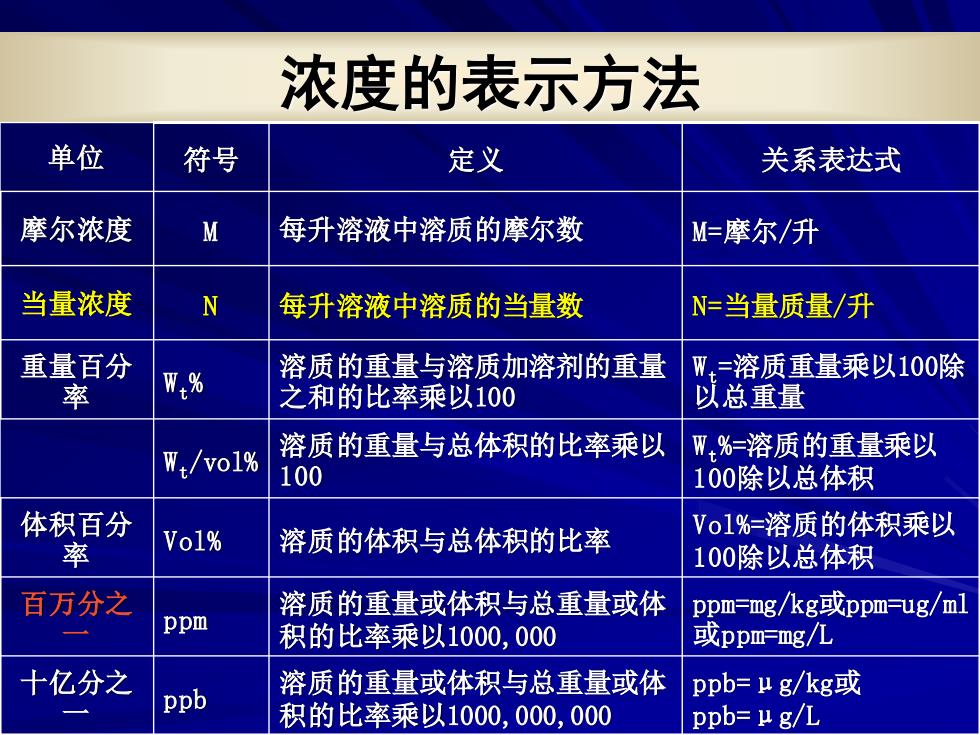
浓度的表示方法 单位 符号 定义 关系表达式 摩尔浓度 M 每升溶液中溶质的摩尔数 M=摩尔/升 当量浓度 N 每升溶液中溶质的当量数 N=当量质量/升 重量百分 率 W% 溶质的重量与溶质加溶剂的重量 W=溶质重量乘以100除 之和的比率乘以100 以总重量 W:/vo1% 溶质的重量与总体积的比率乘以 W%=溶质的重量乘以 100 100除以总体积 体积百分 率 Vo1% 溶质的体积与总体积的比率 Vo1%=溶质的体积乘以 100除以总体积 百万分之 溶质的重量或体积与总重量或体 ppm=mg/kg或ppm-ug/ml ppm 积的比率乘以1000,000 或ppm=g/L 十亿分之 溶质的重量或体积与总重量或体 ppb ppb=μg/kg或 积的比率乘以1000,000,000 ppb=μg/L
浓度的表示方法 单位 符号 定义 关系表达式 摩尔浓度 M 每升溶液中溶质的摩尔数 M=摩尔/升 当量浓度 N 每升溶液中溶质的当量数 N=当量质量/升 重量百分 率 Wt % 溶质的重量与溶质加溶剂的重量 之和的比率乘以100 Wt =溶质重量乘以100除 以总重量 Wt /vol% 溶质的重量与总体积的比率乘以 100 Wt %=溶质的重量乘以 100除以总体积 体积百分 率 Vol% 溶质的体积与总体积的比率 Vol%=溶质的体积乘以 100除以总体积 百万分之 一 ppm 溶质的重量或体积与总重量或体 积的比率乘以1000,000 ppm=mg/kg或ppm=ug/ml 或ppm=mg/L 十亿分之 一 ppb 溶质的重量或体积与总重量或体 积的比率乘以1000,000,000 ppb=μg/kg或 ppb=μg/L

下列是一些摩尔与当量等价换算的例子: 酸碱反应: 1 M H2SO=2 N H2SO 此式中每摩尔酸相当于2当量H 1 M NaOH 1 N NaOH 此式中每摩尔碱相当于1当量OH 1MCH,COOH=1N乙酸此式中每摩尔酸相当于1当量H 1MH2C4HO5=2N苹果酸 此式中每摩尔酸相当于2当量H 氧化-还原反应: HSO3+12 H2O=SO2-+2+3H+ 1MI2=2N碘此式中每摩尔碘相当于2当量碘离子
下列是一些摩尔与当量等价换算的例子: 酸碱反应: 1 M H2SO4 = 2 N H2SO4 此式中每摩尔酸相当于2当量H+ 1 M NaOH = 1 N NaOH 此式中每摩尔碱相当于1当量OH- 1 M CH3COOH = 1 N乙酸 此式中每摩尔酸相当于1当量H+ 1 M H2C4H4O5 =2N苹果酸 此式中每摩尔酸相当于2当量H+ 氧化-还原反应: HSO3 - + I 2 + H2O = SO4 2- + 2I - + 3H+ 1 M I 2= 2 N碘 此式中每摩尔碘相当于2当量碘离子
(二)、样品的处理与制备 固体样品 含二氧化碳的 饮料、酒类 调味品及不含 二氧化碳饮料、 固体饮料 酒类
(二)、样品的处理与制备 固体样品 含二氧化碳的 饮料、酒类 调味品及不含 二氧化碳饮料、 酒类 固体饮料