
第六章可见紫外分光光度法 一、 分光光度法的基本概念 ,二、可见紫外分光光度计 ·三、分光光度法的基本定律 。四、分子结构与电子光谱 。五、定量分析 。六、在农药分析中的应用
第六章 可见紫外分光光度法 ❖ 一、分光光度法的基本概念 ❖ 二、可见紫外分光光度计 ❖ 三、分光光度法的基本定律 ❖ 四、分子结构与电子光谱 ❖ 五、定 量 分 析 ❖ 六、在农药分析中的应用

一、分光光度法的基本概念 分光光度法是根据物质对光具有选择性的吸收特征而建立起来的 一种分析方法,通常又称吸收光谱法。吸收光谱是可见光谱、紫外光 谱和红外光谱的统称。 吸收光谱是由物质吸收光能而产生。光具有波粒二重性,它既是 电磁波又是辐射能。 (一)光的波动性 光作为电磁波,具有波动性的特征,可用波长(入)、频率() 及波数(σ)来表示。三者的关系可用以下表示。 =9 C 式中:入—波长 C 光速 V 频率 波数,为每厘米长度中波的数目,即波长的倒数,单位为 1/cm
一、分光光度法的基本概念 分光光度法是根据物质对光具有选择性的吸收特征而建立起来的 一种分析方法,通常又称吸收光谱法。吸收光谱是可见光谱、紫外光 谱和红外光谱的统称。 吸收光谱是由物质吸收光能而产生。光具有波粒二重性,它既是 电磁波又是辐射能。 (一)光的波动性 光作为电磁波,具有波动性的特征,可用波长(λ)、频率(v) 及波数(σ)来表示。三者的关系可用以下表示。 式中:λ——波长 c——光速 v——频率 σ——波数,为每厘米长度中波的数目,即波长的倒数,单位为 1/cm。 c v = c v = 1 =

(二)光的微粒性一普朗克公式 光作为辐射能又具有微粒性的特征。所谓微粒性,即指光是由光 量子(或光子)的一种粒子组成。光辐射的能量是一份一份的。单个 光量子的能量与波长的关系可用普朗克(plank)公式表示 E=hv=h C=hc 式中:E一能量; h- 普朗克常量 从公式可见,光量子的波长与其能量成反比,波长愈长,能量愈小。 (三)可见紫外、 红外光区的划分 根据电磁波具有波粒二重性的特点,可把自然界存在的各种电磁 波按波长顺序排列成谱,称为电磁波谱,如表6-1所示
(二)光的微粒性——普朗克公式 光作为辐射能又具有微粒性的特征。所谓微粒性,即指光是由光 量子(或光子)的一种粒子组成。光辐射的能量是一份一份的。单个 光量子的能量与波长的关系可用普朗克(plank)公式表示 式中:E——能量; h——普朗克常量 从公式可见,光量子的波长与其能量成反比,波长愈长,能量愈小。 (三)可见紫外、红外光区的划分 根据电磁波具有波粒二重性的特点,可把自然界存在的各种电磁 波按波长顺序排列成谱,称为电磁波谱,如表6-1所示。 c 1 E hv h hc = = =
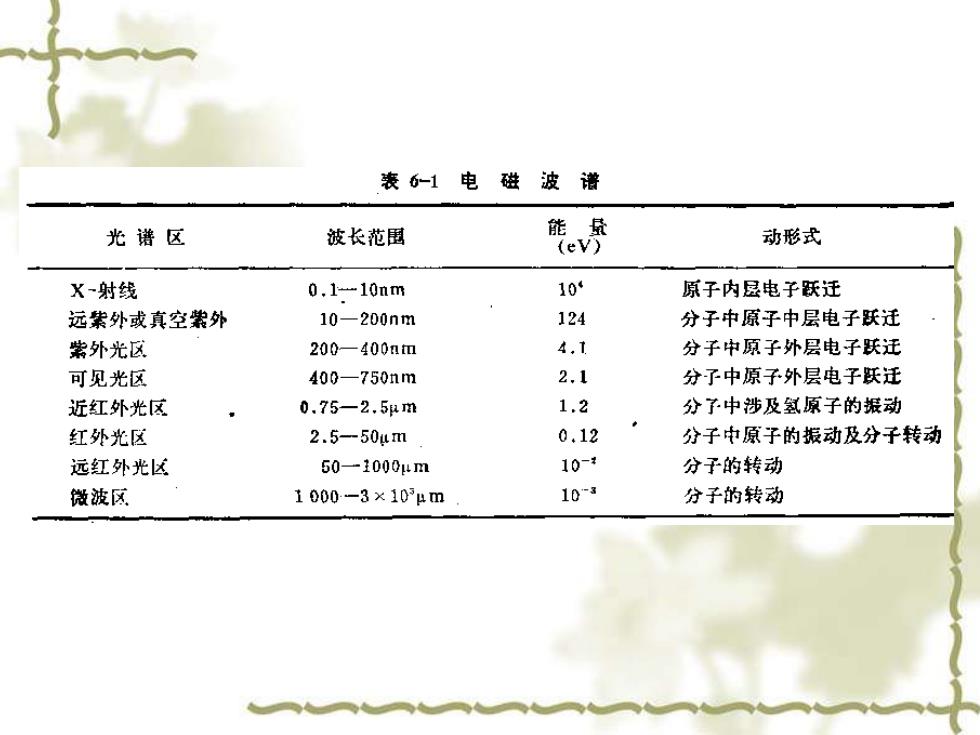
表6-1电磁波谱 光谱区 波长范围 能最 (ev) 动形式 X-射线 0.1-10nm 10 原子内县电子跃迁 远紫外或真空紫外 10-200nm 124 分子中原子中层电子跃迁 紫外光区 200一400atm 4,1 分子中原子外层电子跃迁 可见光区 400-750nm 2.1 分了中原子外层电子跃迁 近红外光区 0.75一2.5m 1.2 分予中涉及氢原子的振动 红外光区 2.5-50um 0.12 分子中原子的振动及分子转动 远红外光区 50一1000μm 10-¥ 分子的转动 微波区 1000-3×10μm 10-3 分子的转动

可将电磁波波长划分为若干波段区域,如X射线区、远 紫外区、可见光区和红外光区等,从表6一1可以看出各区 的波长一次上升,而其能量测依次下降,各波段能量不同, 引起物质运动的形式亦不同。物质吸收紫外光和可见光则 引起分子中价电子的跃迁;物质吸收红外光则引起分子振 动,因此可见紫外光谱又称为电子光谱,红外光谱又称为 分子振动光谱。 本章讨论可见及紫外分光光度法,由于可见紫外吸收 光谱是由电子跃迁产生的,因此波长为100一800nm的光 线才有足够的能量引起电子跃迁。在这个范围内又可分为 三个区域,100一200nm为远紫外区;200一400nm为近 紫外区;400一800nm为可见光区域
可将电磁波波长划分为若干波段区域,如X射线区、远 紫外区、可见光区和红外光区等,从表6-1可以看出各区 的波长一次上升,而其能量则依次下降,各波段能量不同, 引起物质运动的形式亦不同。物质吸收紫外光和可见光则 引起分子中价电子的跃迁;物质吸收红外光则引起分子振 动,因此可见紫外光谱又称为电子光谱,红外光谱又称为 分子振动光谱。 本章讨论可见及紫外分光光度法,由于可见紫外吸收 光谱是由电子跃迁产生的,因此波长为100-800nm的光 线才有足够的能量引起电子跃迁。在这个范围内又可分为 三个区域,100-200nm为远紫外区;200-400nm为近 紫外区;400-800nm为可见光区域