
第十八章细胞骨架 学习目标 通过本章的学习,你应该能够: 掌握细胞骨架的概念,微管、微丝和中间纤维的化学组成、结构、分布、组装与 功能。 熟悉微管、微丝和中间纤维结合蛋白质的类型及作用,细胞骨架参与形成的 此亚细胞结构的物成和作用 了解细胞骨架与疾病的关系。 细胞骨架(cytoskeleton)是指广泛存在于真核细胞中的三维蛋白纤维网络系统。细胞骨架的概念最 早由Nikolaj Koltzoff于1928年提出,研究发展到今天,有狭义与广义之分。狭义的细胞骨架仅指细胞质 骨架,包括微管、微丝和中间纤维。广义的细胞骨架还包括细胞核骨架(核基质)、细胞膜骨架及细胞外 基质,形成贯穿于细胞核、细胞质和细胞外的一体化网络结构。 细胞骨架是一种高度动态的结构体系。在不同的细胞功能状态、分裂时相及分化状态中,细胞骨架 不断发生组装与去组装,其形态分布、蛋白质组成都有差异和变化。细胞骨架不仅在细胞内发挥重要的 机械支撑与空间组织作用,还参与几乎所有形式的细胞运动及胞内膜泡运输等生命活动。 对细胞骨架的研究是近代细胞生物学中最活跃的领域之一。 本章主要介绍细胞质骨架的三种蛋白纤维及相关的生理功能,并简单介绍细胞骨架异常与人类疾 病的关系。 第一节微管 除人与哺乳类动物成熟的红细胞等极少数特化细胞外,微管(microtubule,MT)普遍存在于真核细 胞中,是由微管蛋白和微管相关蛋白组成的中空管状结构。微管主要分布在细胞核周围,在胞质中呈网 状或束状分布,对低温、高压和秋水仙素敏感。微管作为膜泡运输的导轨和确定膜性细胞器的位置,还 能与其他蛋白共同组成中心体、基体、鞭毛、纤毛、纺锤体等亚细胞结构,与细胞形态的维持、细胞运动和 细胞分裂等功能有关。 一、微管的形态结构和化学组成 (一)微管的形态结构 运用免疫荧光染色标记培养的成纤维细胞,在光学显微镜下可观察到在细胞核周围向外呈放射状 分布的微管(图18-1)。电镜下,微管为不分支的中空管状结构,其外径平均为25m,内径约为15m,管 4g9
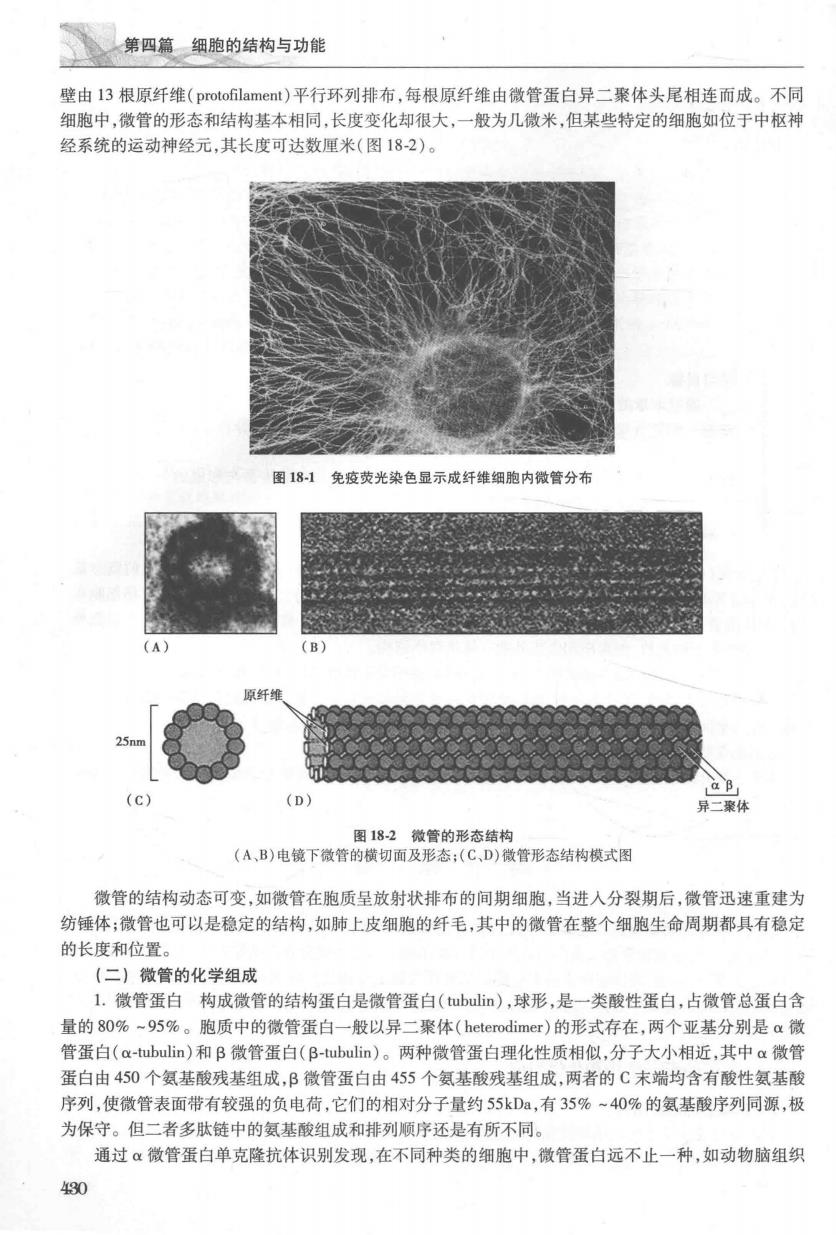
第四篇细胞的结构与功能 壁由13根原纤维(protofilament)平行环列排布,每根原纤维由微管蛋白异二聚体头尾相连而成。不同 细胞中,徽管的形态和结构基本相同,长度变化却很大,一般为几微米,但某些特定的细胞如位于中枢神 经系统的运动神经元,其长度可达数厘米(图18-2)。 图181免疫荧光染色显示成纤维细胞内微管分布 (c) a B (D) 形态:(C,D)微管形态结构模式图 微管的结构动态可变,如微管在胞质呈放射状排布的间期细胞,当进人分裂期后,微管迅速重建为 纺锤体;微管也可以是稳定的结构,如肺上皮细胞的纤毛,其中的微管在整个细胞生命周期都具有稳定 的长度和位置。 (二)微管的化学组成 1.微管蛋白构成微管的结构蛋白是微管蛋白(tubulir),球形,是一类酸性蛋白,占微管总蛋白含 量的80%~95%。胞质中的微管蛋白一般以异二聚体(heterodimer)的形式存在,两个亚基分别是a微 管蛋白(a-tubulin)和B微管蛋白(B-tubulin)。两种微管蛋白理化性质相似,分子大小相近,其中a微管 蛋白由450个氨基酸残基组成,B微管蛋白由455个氨基酸残基组成,两者的C末端均含有酸性氨基酸 序列,使微管表面带有较强的负电荷,它们的相对分子量约55kDa,有35%~40%的氨基酸序列同源,极 为保守。但二者多肽链中的氨基酸组成和排列顺序还是有所不同。 通过α微管蛋白单克隆抗体识别发现,在不同种类的细胞中,微管蛋白远不止一种,如动物脑组织 430
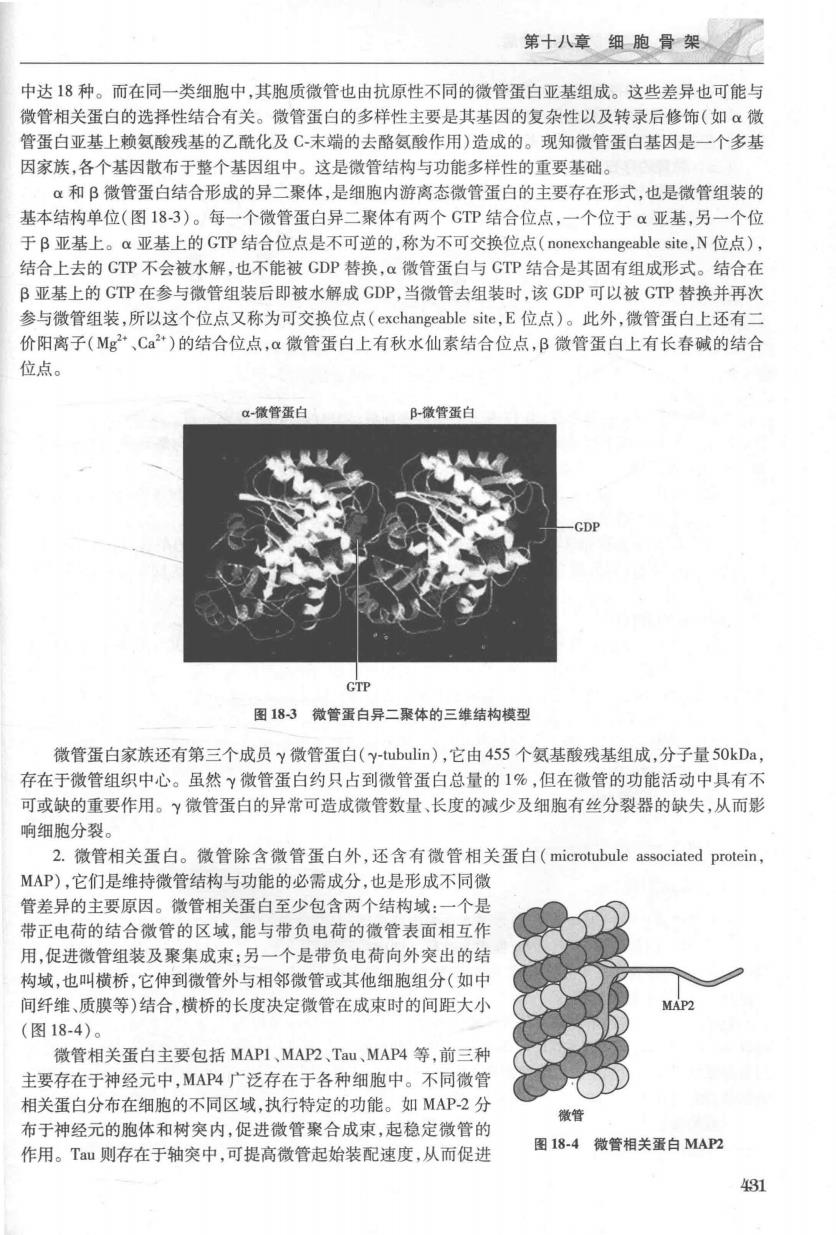
第十八章细胞骨架、 中达18种。而在同一类细胞中,其胞质微管也由抗原性不同的微管蛋白亚基组成。这些差异也可能与 微管相关蛋白的选择性结合有关。微管蛋白的多样性主要是其基因的复杂性以及转录后修饰(如α微 管蛋白亚基上赖氨酸残基的乙酰化及C末端的去酪氨酸作用)造成的。现知微管蛋白基因是一个多基 因家族,各个基因散布于整个基因组中。这是微管结构与功能多样性的重要基础。 a和B微管蛋白结合形成的异二聚体,是细胞内游离态微管蛋白的主要存在形式,也是微管组装的 基本结构单位(图183)。每一个微管蛋白异二聚体有两个GTP结合位点,一个位于α亚基,另一个位 于B亚基上。a亚基上的GTP结合位点是不可逆的,称为不可交换位点(nonexchangeable site,N位点), 结合上去的GTP不会被水解,也不能被GDP替换,微管蛋白与GTP结合是其固有组成形式。结合在 B亚基上的GTP在参与微管组装后即被水解成GDP,当微管去组装时,该GDP可以被GTP替换并再资 参与微管组装.所以这个位点又称为可交换位点(exchangeable site.E位点)。此外,微管蛋白上环有 价阳离子(Mg“,Ca2“)的结合位点,a微管蛋白上有秋水仙素结合位点,B微管蛋白上有长春碱的结合 位点。 a-微管蛋白 微管蛋白 图183微管蛋白异二聚体的三维结构模型 微管蛋白家族还有第三个成员y微管蛋白(y-tubulin),它由455个氨基酸残基组成,分子量50kDa, 存在于微管组织中心。虽然微管蛋白约只占到微管蛋白总量的1%,但在微管的功能活动中具有不 可或缺的重要作用。γ微管蛋白的异常可造成微管数量、长度的减少及细胞有丝分裂器的缺失,从而影 响细胞分裂。 2.微管相关蛋白。微管除含微管蛋白外,还含有微管相关蛋白(microtubule associated protein MAP),它们是维持微管结构与功能的必需成分,也是形成不同微 管差异的主要原因。微管相关蛋白至少句含两个结构战:一个 带正电荷的结合微管的区域,能与带负电荷的微管表面相互作 用,促进微管组装及聚集成束:另一个是带负电荷向外突出的结 物域.也叫描桥,它伸到微管外与相邻微管或其他细胞组分(如由 间纤维、质膜等)结合,横桥的长度决定微管在成束时的间距大小 (图18-4)。 微管相关蛋白主要包括MAPI、MAP2、Tau、MAP4等,前三种 主要存在于神经元中,MAP4广泛存在于各种细胞中。不同微管 相关蛋白分布在细胞的不同区域.执行特定的功能。如MAP2分 微管 布于神经元的胞体和树突内,促进微管聚合成束,起稳定微管的 作用。Tu则存在于轴突中,可提高微管起始装配速度,从而促进 图18-4微管相关蛋白MAP2

第四篇细胞的结构与功能 微管组装及聚合,维持微管的稳定性 还有一类微管相关蛋白是马达蛋白(motor protein),含微管结合区域和ATPase活性区域(即马达结 构域),包括动力蛋白、驱动蛋白等,主要参与细胞内膜泡转运、染色体运动等。 (三)微管的存在类型 微管在细胞内存在有单管、二联管和三联管三种类型(图185),各自执行不同的功能 0.d A B ●● 单管 二联管 三联管 图185微管的三种存在类型 大部分细胞质微管是单管,由13根原纤维环围而成,常单独存在或成束分布。单管在低温、C“和 秋水仙素等因素作用下容易解聚,并随细胞生理功能状态的改变,处于不断聚合与解聚的动态变化中, 属于不稳定微管,如纺锤体微管 二联管构成纤毛和鞭毛的周围小管。二联管由A管和B管组成,其中A管与单管结构相同,B管 有3根原纤维与A管共有 三联管见于中心粒和纤毛、鞭毛的基体,由A、B、C三管组成,A管是完整的单管结构,B管和A 管、C管和B管间分别共用3根原纤维。二联管和三联管对于低温、C·和秋水仙素等的作用是稳 定的 (四)微管的极性 微管蛋白异二聚体在微管头尾相连接,因此对每一根原纤维,它们在微管的某一端都是α微管蛋 白,而在另一端都是B微管蛋白,这使得微管中所有的原纤维的两端都是不对称的,是有方向性的,从而 使整根微管在结构上呈现极性状态。结构上的不对称也导致微管组装时微管蛋白异二聚体在两端聚合 速度的差异,人们通常将组装较快的一端称为正极或(+)极(plus end),此处微管蛋白异二聚体的聚合 速度大于解聚速度,微管在这一端得以不断延长,其最外端是B微管蛋白,指向质膜的方向。而另一端 称为负极或(-)极(minus end),它最外端是a微管蛋白,在细胞中定位于微管组织中心里。一般认为 微管两极聚合速度的差异本质是两端反应的临界浓度(critical concentration)不同。所谓临界浓度是指 微管蛋白异二聚体达到组装的最低浓度。微管正极的临界浓度显然低于负极的。由于微管在结构和生 长上均具极性,故由微管构成的细胞器也具有一定的极性 二、微管的组装 有关微管的组装过程及机制,虽然还有许多尚待探明的问题,但大量的研究表明,它是一个受多种 因素影响、具有高度时空顺序性的自我组装过程。细胞质微管是一种动态变化的结构,根据细胞的生理 功能需要,通过微管蛋白聚合或解聚,引起微管的组装和去组装以达成某种平衡 (一)微管的组装过程 最早对微管组装的研究来自体外实验。1972年,R.Weisenberg证明提纯的微管蛋白在微酸性环境 (pH=6.9)及适宜的温度(>20℃),存在GTP、Mg2和去除Ca2“的条件下能自发的组装成微管。还发现 只要降低或提高反应温度就可以使微管去组装和重组装。若在反应系统中添加微管碎片能够加速微管 的组装,加入的微管碎片起到“种子”的作用。 一般将微管体外组装分为三个时期:成核期、聚合期和稳定期。①成核期(nucleation phase),先由 一些微管蛋白异二聚体聚合成片状或环状的核心,接着在核心两端和侧面增加异二聚体使之延伸、扩展 432

第十八章细胞骨架 成13根原纤维,随即合拢成一段微管。由于该期是微管聚合的开始,速度缓慢,是微管组装的限速阶 段,也叫延迟期(lag phase):②聚合期(polymerization phase)或延长期(elongation),在此阶段,高浓度的 微管蛋白异二聚体快速添加到微管末端,使微管得以生长、延长:③稳定期(stead山y state phase),也叫平 衡期(equilibrium phase),随着游离微管蛋白浓度的下降,微管的组装与去组装速度相等,微管长度趋于 相对稳定 当游离的微管蛋白异二聚体浓度介于正、负两极的临界浓度之间时,微管在正极组装延长,在负极 解聚缩短,若延长和缩短速度相等,微管净长度保持不变,这种动态行为称为踏车现象(treadmilling)。 (二)微管组织中心 微管在体内的组装要复杂得多,除遵循体外组装的条件外,还受到细胞内各种因素的影响和调节。 微管体外组装的限速步骤是成核期,但在活细胞内成核过程非常迅速,并且成核位置也是固定的 实验证明,这个成核位置就是细胞中的微管组织中心(microtubule organizing center,MTOC)。MTOC是 细胞内微管起始组装的特定区域,包括中心体、鞭毛和纤毛的基体等。所有微管组织中心都具有y微管 蛋白,这种球蛋白的含量很低,也是保守蛋白质,与其结合蛋白一起构成γ微管蛋白环形复合物(Y tubuliny ring complex,Y-TuRC),作为模板启动微管定点聚合,还决定微管的数量、位置及极性。MTOC 是微管组装的特异性核心形成位点,又叫成核位点。 研究表明,中心体(centrosome)是动物细胞中主要的微管组织中心,位于间期细胞的细胞核附近,由 对相互垂直的中心粒(centriole)构成,周围是一些无定形、高电子密度的物质,叫做中心粒外周物质 (pericentriolar material,PCM)。中心粒直径0.2mm,长0.4mm,由9组三联微管围成一个圆筒状结构,即 “9×3+0”的结构(图18-6)。中心粒不直接参与微管蛋白的核化,具有召集和稳定PCM的作用。在 PCM表面,有许多环状的YTRC,像一个个基座,微管蛋白异二聚体按照一定的方向添加到这个环上, 然后微管开始生长和延长。Y微管蛋白只与α微管蛋白结合,结果生长的微管负极被Y-TuRC封闭,微 管的游离端则为正极(图187),也意味着细胞内多数微管只能在正极发生组装与去组装。 图18-6中心粒结构模式图及电镜图 433