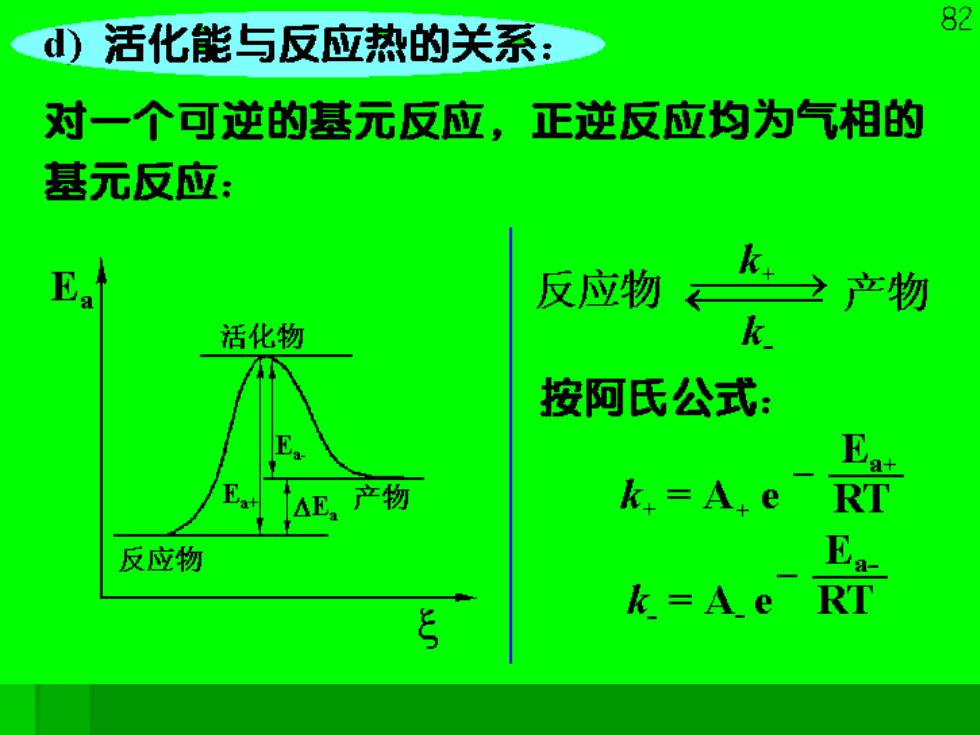
82 d)活化能与反应热的关系: 对一个可逆的基元反应,正逆反应均为气相的 基元反应: 反应物 K产物 活化物 k 按阿氏公式: 产物 k.=A.e RT 反应物 k=A.e

对于正反应,吸收E+的活化能变成活化分子, 反应生成产物,放出E的能量: 对于逆反应,吸收E。的能量成为活化物后, 生成“反应物?放出Ea+的能量。 由反应物-→产物,放出能量为△Ea。 △Ea=Ea+-Ea 由于活化能多数为正值,所以△E,的符号要看 正逆反应活化能的大小及反应进行的方向来确 定。这里的Ea,Ea+,Ea,E,的下标a表示 活化能,并无体系状态的意义,也就是没有考 虑等容或等压条件

84 下面对△E,的状态条件加以讨论: 基元气相反应: A+B c+D 对于气相反应,以P表示反应物浓度,则有 Tpt=kpt PAPB kpt =Apte RT E. Tp.kp-PcPD2 kp .=Ap.e RT 当反应达平衡时, r=r. 即Kp+PAPB=Kp-PCPD;

PePD 85 PAPB -Kp=K8 K8, 以1atm.为标准的平衡常数, m=k、()(2) Vant-Hoff公式: 把以上K代入, 2)。(产),-

86 阿氏微分式: (2),()。-禁-是 比较之后得: Ep+-Ep.-A,I -Qp 为等压平衡常数与反应热 Q,的关系,此时 △Ea=Qp=A,H