
常用酶类测定第十四章第一节氧化还原酶类氧化还原酶能够催化氢氧原子或电子从一种底物转移到另一种底物上,它包括一大类酶如脱氢酶、氧化酶、过氧化物酶以及加单氧酶等。目前临床诊断中常用的氧化还原酶主要有乳酸脱氢酶及其同工酶、葡萄糖-6-磷酸脱氢酶、铜蓝蛋白、单胺氧化酶和超氧化物歧化酶等。实验92连续监测法测定乳酸脱氢酶总活性(L-P反应法)乳酸脱氢酶(lactatedehydrogenase,LD)是糖酵解和糖异生的一个重要酶,含有锌离子,广泛分布于人和动物组织、植物和微生物中,能可逆地催化乳酸(L)和丙酮酸(P)之间的氧化还原反应。乳酸+NAD+→丙酮酸+NADH+H+其中LP为正向反应,P→为逆向反应。正反两向反应的最适pH不同,其中正向反应最适pH为8.8~9.8,偏碱,能使平衡偏向生成丙酮酸的方向。其优点是乳酸和NAD+稳定性好,且NAD*纯品易得、价格较低,过量乳酸对LD活性的抑制较小,反应线性较好。缺点是需要较高的底物浓度,反应速度较慢。逆向反应的最适pH为7.4~7.8,与生理性pH相同。其显著的优点在于NADH用量少仅为正向反应的3%左右,而反应速度比前者约快3倍,灵敏度高。但丙酮酸于NADH的稳定性较差,过量的丙酮酸对LD活性的抑制作用较大。LD活性测定时正向反应和逆向反应都可以运用,但1996年中华医学会检验学会酶学组专家推荐选择正向反应。LD催化下述反应:【原理】L-乳酸+NAD*L>丙酮酸+NADH+H*在反应过程中,乳酸氧化生成丙酮酸,同时使NAD+还原为NADH。NADH在340nm处有吸收峰,因此反应会引起340nm吸光度的增高,并且吸光度增加的速率与样本中LD活性呈正比的关系。【试剂与器材】
1 第十四章 常用酶类测定 第一节 氧化还原酶类 氧化还原酶能够催化氢氧原子或电子从一种底物转移到另一种底物上,它包括一大类酶 如脱氢酶、氧化酶、过氧化物酶以及加单氧酶等。目前临床诊断中常用的氧化还原酶主要有 乳酸脱氢酶及其同工酶、葡萄糖-6-磷酸脱氢酶、铜蓝蛋白、单胺氧化酶和超氧化物歧化酶等。 实验 92 连续监测法测定乳酸脱氢酶总活性(L-P 反应法) 乳酸脱氢酶(lactate dehydrogenase,LD)是糖酵解和糖异生的一个重要酶,含有锌离子, 广泛分布于人和动物组织、植物和微生物中,能可逆地催化乳酸(L)和丙酮酸(P)之间的氧化还 原反应。 乳酸+NAD+ 丙酮酸+NADH+H+ 其中 L→P 为正向反应,P→为逆向反应。正反两向反应的最适 pH 不同,其中正向反应 最适 pH 为 8.8~9.8,偏碱,能使平衡偏向生成丙酮酸的方向。其优点是乳酸和 NAD+稳定性 好,且 NAD+纯品易得、价格较低,过量乳酸对 LD 活性的抑制较小,反应线性较好。缺点是 需要较高的底物浓度,反应速度较慢。 逆向反应的最适 pH 为 7.4~7.8,与生理性 pH 相同。其显著的优点在于 NADH 用量少, 仅为正向反应的 3%左右,而反应速度比前者约快 3 倍,灵敏度高。但丙酮酸于 NADH 的稳 定性较差,过量的丙酮酸对 LD 活性的抑制作用较大。 LD 活性测定时正向反应和逆向反应都可以运用,但 1996 年中华医学会检验学会酶学组 专家推荐选择正向反应。 【原理】 LD 催化下述反应: + + L− + NAD ⎯⎯→ + NADH + H 乳酸 LD 丙酮酸 在反应过程中,乳酸氧化生成丙酮酸,同时使 NAD+还原为 NADH。NADH 在 340nm 处 有吸收峰,因此反应会引起 340nm 吸光度的增高,并且吸光度增加的速率与样本中 LD 活性 呈正比的关系。 【试剂与器材】

1.Tris-乳酸锂缓冲液(含Tris52.5mmol/L,乳酸锂52.5mmol/L)称取Tris6.34g,乳酸锂5.04g,溶于约800ml蒸馏水中,置37℃水浴箱,使温度达到平衡后,在pH计下用1mol/L的HCI(约加入45ml)调节pH至8.9,再加入蒸馏水至1000ml,冰箱保存。2.底物应用液(含Tris52.5mmol/L,乳酸锂52.5mmol/L,NAD+6mmol/L,临用前现配)1mlTris-乳酸锂缓冲液加4.2mgNAD+的浓度比例配制。3.仪器以半自动生化分析仪为例。【操作步骤】1.血清稀释度血清50ul,加37℃预温的底物应用液1.0ml,立即吸入自动分析仪,此时血清稀释倍数为21。2.主要参数:系数337630s孵育时间连续检测时间60s波长340nm吸样量0.5ml温度37℃【计算】LD (U/L)=Mmin××0=4Amm ×3376式中,△A/min:平均每分钟吸光度增加值;6220:340nm处NADH的微摩尔吸光系数;1.05:比色液体总体积(ml);0.05:血清用量(ml)。【参考范围】成人109~245U/L。【临床意义】LD活性增高主要见于心肌梗死、肺梗塞、病毒性肝炎、肝硬化、肾脏疾病、某些恶性肿瘤、白血病、以及非恶性疾病如传染性单核细胞增多症、贫血、肌营养不良、胰腺炎等,一些肿瘤转移所致的胸腹水中LD活性往往有升高。目前临床测定LD活性常用于心肌梗死、肝病和恶性肿瘤的辅助诊断。LD活性降低目前没有发现重要的临床意义。【注意事项】1.不同的LD同工酶对温度的敏感性是不同的,组织提取液若放于一20℃过夜,LD4和LDs会丧失全部的活性。血清标本应存放于室温下,一般2~3d不会出现活性的丢失。如2
2 1.Tris-乳酸锂缓冲液(含 Tris 52.5mmol/L,乳酸锂 52.5mmol/L) 称取 Tris 6.34g,乳酸 锂 5.04g,溶于约 800ml 蒸馏水中,置 37℃水浴箱,使温度达到平衡后,在 pH 计下用 1mol/L 的 HCl(约加入 45ml)调节 pH 至 8.9,再加入蒸馏水至 1 000ml,冰箱保存。 2. 底物应用液(含 Tris 52.5mmol/L,乳酸锂 52.5mmol/L,NAD+ 6mmol/L,临用前现配) 1ml Tris-乳酸锂缓冲液加 4.2mg NAD+的浓度比例配制。 3.仪器以半自动生化分析仪为例。 【操作步骤】 1.血清稀释度 血清 50μl,加 37℃预温的底物应用液 1.0ml,立即吸入自动分析仪, 此时血清稀释倍数为 21。 2.主要参数: 系数 3 376 孵育时间 30s 连续检测时间 60s 波长 340nm 吸样量 0.5ml 温度 37℃ 【计算】 0.05 1.05 6220 106 min LD(U / L)= A 3376 min = ΔA 式中,△A/min:平均每分钟吸光度增加值;6220:340nm 处 NADH 的微摩尔吸光系数; 1.05:比色液体总体积(ml);0.05:血清用量(ml)。 【参考范围】 成人 109~245 U/L。 【临床意义】 LD 活性增高主要见于心肌梗死、肺梗塞、病毒性肝炎、肝硬化、肾脏 疾病、某些恶性肿瘤、白血病、以及非恶性疾病如传染性单核细胞增多症、贫血、肌营养不 良、胰腺炎等,一些肿瘤转移所致的胸腹水中 LD 活性往往有升高。目前临床测定 LD 活性 常用于心肌梗死、肝病和恶性肿瘤的辅助诊断。 LD 活性降低目前没有发现重要的临床意义。 【注意事项】 1.不同的 LD 同工酶对温度的敏感性是不同的,组织提取液若放于-20℃过夜,LD4 和 LD5 会丧失全部的活性。血清标本应存放于室温下,一般 2~3d 不会出现活性的丢失。如

果血清标本需要存放较长时间,应加入10mg/ml的NAD+或3.1mg/ml的谷胱甘肽后于4℃保存。2.LD活性测定也可用抗凝血浆,但不同抗凝剂对LD测定的影响不同:草酸盐抗凝剂、EDTA能抑制LD活性,而肝素的影响不大,3.由于红细胞、血小板中含有大量的LDH,故严禁使用溶血标本。在采用血浆作为标本时必须用3000r/min离心15min以除去血小板。4.LD活性能被疏基试剂所抑制,硼酸、丙二酸、草酸、以及EDTA都是竞争性抑制剂。【评价】1.LD广泛存在于人体各组织的细胞浆中,以肝、心肌、肾、骨骼肌、胰腺和肺含量最多。各组织、器官中酶活性是血清酶活性的1000倍,因此各种组织病变时可以释放LD入血,导致血清中酶活性的升高,特异性较差。2.本实验是根据正向反应(L-P)建立的连续监测法,其优点在于:乳酸盐与NAD+底物溶液的稳定性较好,冰冻放置可稳定6个月以上。且两溶液的浓度对测定方法的影响最小,NAD较少被产物抑制。反应的线性范围较宽(726U/L),重复性较好,精密度较高(LD为65U/L时日间CV%为5.8%,LD为149U/L时日间CV为3.2%),特异性高(血清中存在的非LD的其它NAD+类氧化还原酶的内源性底物很少,加上样本被高度稀释,故这些酶的干扰作用可忽略不计)。实验93比色法测定乳酸脱氢酶总活性【原理】以NAD+为受氢体,乳酸脱氢酶(LD)催化L-乳酸脱氢,生成丙酮酸。丙酮酸与2,4-二硝基苯肼反应生成丙酮酸二硝基苯腺,后者在碱性的溶液中呈棕红色。其颜色的深浅与丙酮酸的浓度呈正比,由测得的丙酮酸含量计算出酶的活性。【试剂】1.底物缓冲液(pH8.8,含0.3mol/L乳酸锂)称取二乙醇胺2.1g,乳酸锂2.9g,加蒸馏水约80ml,用1mol/LHCI调节pH至8.8,加蒸馏水至100ml。2.11.3mmol/LNAD+溶液称取NAD+15mg(若含量为70%,则取21.4mg),溶于2ml蒸馏水中,4℃可保存至少2周。3.1mmol/L2,4-二硝基苯肼溶液取2,4-二硝基苯肼198mg,加10mol/L盐酸100ml,待溶解后加蒸馏水至IL。于棕色瓶中室温放置
3 果血清标本需要存放较长时间,应加入 10mg/ml 的 NAD+或 3.1mg/ml 的谷胱甘肽后于 4℃保 存。 2.LD 活性测定也可用抗凝血浆,但不同抗凝剂对 LD 测定的影响不同:草酸盐抗凝剂、 EDTA 能抑制 LD 活性,而肝素的影响不大。 3.由于红细胞、血小板中含有大量的 LDH,故严禁使用溶血标本。在采用血浆作为标 本时必须用 3 000r/min 离心 15min 以除去血小板。 4.LD 活性能被巯基试剂所抑制,硼酸、丙二酸、草酸、以及 EDTA 都是竞争性抑制 剂。 【评价】 1.LD 广泛存在于人体各组织的细胞浆中,以肝、心肌、肾、骨骼肌、胰腺和肺含量 最多。各组织、器官中酶活性是血清酶活性的 1 000 倍,因此各种组织病变时可以释放 LD 入 血,导致血清中酶活性的升高,特异性较差。 2.本实验是根据正向反应(L-P)建立的连续监测法,其优点在于:乳酸盐与 NAD+底物 溶液的稳定性较好,冰冻放置可稳定 6 个月以上。且两溶液的浓度对测定方法的影响最小, NAD 较少被产物抑制。反应的线性范围较宽(726U/L),重复性较好,精密度较高(LD 为 65U/L 时日间 CV%为 5.8%,LD 为 149U/L 时日间 CV 为 3.2%),特异性高(血清中存在的非 LD 的 其它 NAD+类氧化还原酶的内源性底物很少,加上样本被高度稀释,故这些酶的干扰作用可 忽略不计)。 实验 93 比色法测定乳酸脱氢酶总活性 【原理】 以 NAD+为受氢体,乳酸脱氢酶(LD)催化 L-乳酸脱氢,生成丙酮酸。丙酮酸 与 2,4-二硝基苯肼反应生成丙酮酸二硝基苯腙,后者在碱性的溶液中呈棕红色。其颜色的深 浅与丙酮酸的浓度呈正比,由测得的丙酮酸含量计算出酶的活性。 【试剂】 1.底物缓冲液(pH 8.8 ,含 0.3mol/L 乳酸锂) 称取二乙醇胺 2.1 g,乳酸锂 2.9 g,加蒸 馏水约 80ml,用 1mol/L HCl 调节 pH 至 8.8,加蒸馏水至 100ml。 2.11.3mmol/L NAD+溶液 称取 NAD+ 15mg(若含量为 70%,则取 21.4mg),溶于 2ml 蒸 馏水中,4℃可保存至少 2 周。 3.1mmol/L 2,4-二硝基苯肼溶液 取 2,4-二硝基苯肼 198mg,加 10mol/L 盐酸 100ml, 待溶解后加蒸馏水至 1L。于棕色瓶中室温放置
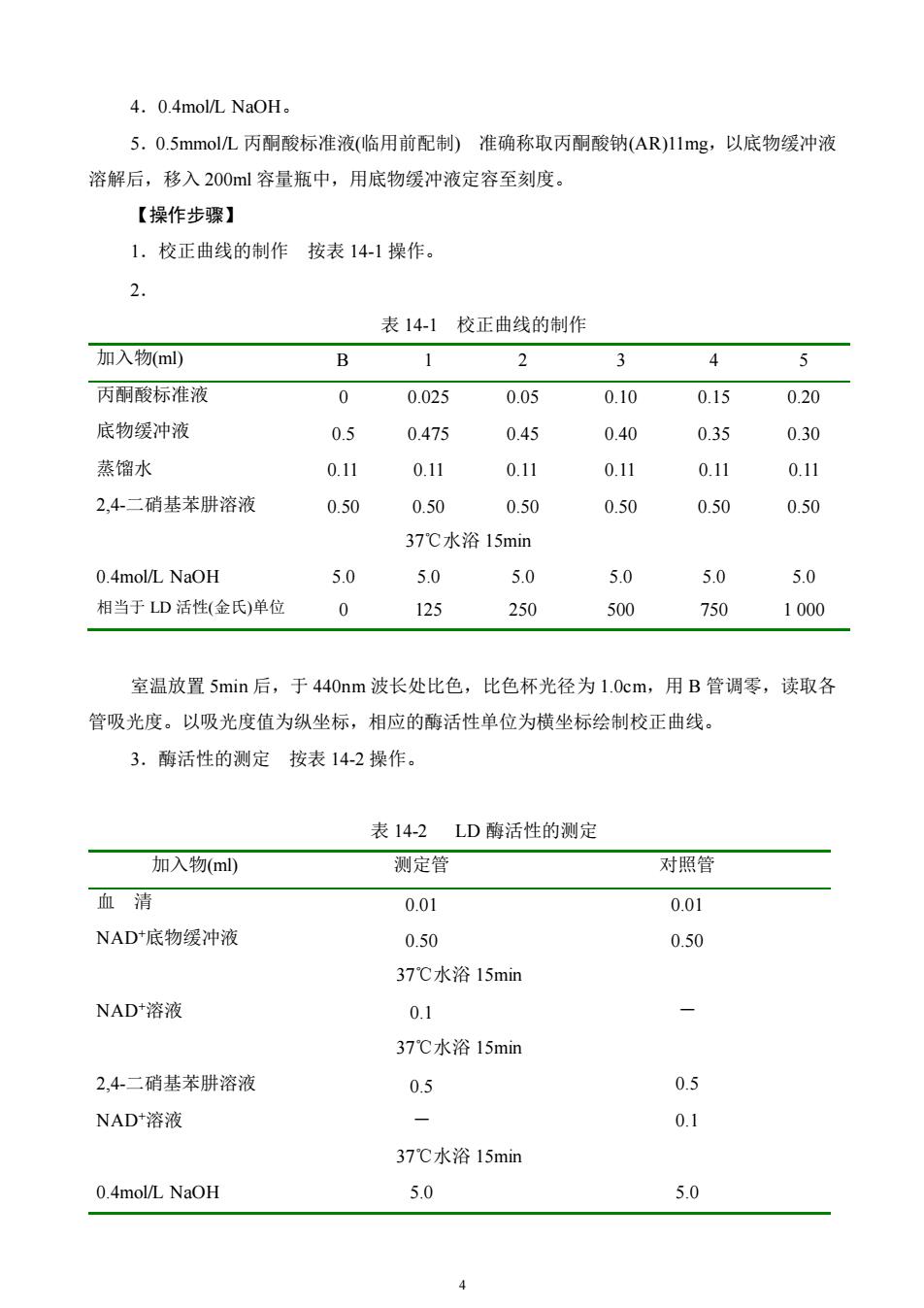
4. 0.4mol/L NaOH。5.0.5mmol/L丙酮酸标准液(临用前配制)准确称取丙酮酸钠(AR)11mg,以底物缓冲液溶解后,移入200ml容量瓶中,用底物缓冲液定容至刻度。【操作步骤】1.校正曲线的制作按表14-1操作。2.表14-1校正曲线的制作加入物(ml)B23451丙酮酸标准液0.0250.050.100.150.200底物缓冲液0.50.4750.450.400.350.30蒸馏水0.110.110.110.11 0.110.112,4-二硝基苯肼溶液0.500.500.500.500.500.5037℃水浴15min0.4mol/L NaOH 5.05.05.05.05.05.01252505007501 000相当于LD活性(金氏)单位0室温放置5min后,于440nm波长处比色,比色杯光径为1.0cm,用B管调零,读取各管吸光度。以吸光度值为纵坐标,相应的酶活性单位为横坐标绘制校正曲线。3.酶活性的测定按表14-2操作。表14-2LD 酶活性的测定加入物(ml)测定管对照管血清0.010.01NAD+底物缓冲液0.500.5037℃水浴15minNAD+溶液0.1-37℃水浴15min2,4二硝基苯肼溶液0.50.5-0.1 NAD+溶液37℃水浴15min5.00.4mol/L NaOH5.04
4 4.0.4mol/L NaOH。 5.0.5mmol/L 丙酮酸标准液(临用前配制) 准确称取丙酮酸钠(AR)11mg,以底物缓冲液 溶解后,移入 200ml 容量瓶中,用底物缓冲液定容至刻度。 【操作步骤】 1.校正曲线的制作 按表 14-1 操作。 2. 表 14-1 校正曲线的制作 加入物(ml) B 1 2 3 4 5 丙酮酸标准液 0 0.025 0.05 0.10 0.15 0.20 底物缓冲液 0.5 0.475 0.45 0.40 0.35 0.30 蒸馏水 0.11 0.11 0.11 0.11 0.11 0.11 2,4-二硝基苯肼溶液 0.50 0.50 0.50 0.50 0.50 0.50 37℃水浴 15min 0.4mol/L NaOH 5.0 5.0 5.0 5.0 5.0 5.0 相当于 LD 活性(金氏)单位 0 125 250 500 750 1 000 室温放置 5min 后,于 440nm 波长处比色,比色杯光径为 1.0cm,用 B 管调零,读取各 管吸光度。以吸光度值为纵坐标,相应的酶活性单位为横坐标绘制校正曲线。 3.酶活性的测定 按表 14-2 操作。 表 14-2 LD 酶活性的测定 加入物(ml) 测定管 对照管 血 清 0.01 0.01 NAD+底物缓冲液 0.50 0.50 37℃水浴 15min NAD+溶液 0.1 - 37℃水浴 15min 2,4-二硝基苯肼溶液 0.5 0.5 NAD+溶液 - 0.1 37℃水浴 15min 0.4mol/L NaOH 5.0 5.0

混匀,室温放置5min后,于440nm波长处比色,比色杯光径为1.0cm,用蒸馏水调零读取各管吸光度。以测定管与对照管吸光度之差值查校正曲线,得酶活性。单位定义以100ml血清,37℃,作用底物15min,产生1umol丙酮酸为一个金氏单位【参考范围】190~437金氏单位【注意事项】1.乳酸锂、乳酸钾、乳酸钠都可以作为LD的底物,但后两种为水溶液,若保存不当容易产生酮酸类物质从而抑制酶促反应,且含量不够准确,目前少用。而乳酸锂为固体,稳定、易称量。2.除用二乙醇胺缓冲液外,还可用Tris或焦磷酸缓冲液。而甘氨酸对LD有抑制作用故不采用甘氨酸缓冲液。3.标本严禁溶血,也不采用草酸盐、EDTA抗凝血浆。由于LD4、LDs对冷不稳定,不应存于冰箱中,血清标本室温可存放2~3d。4.比色应在5~15min内完成,否则吸光度值会降低。【评价】LD活性测定多采用乳酸生成丙酮酸的反应方向,但反应开始的转化速率是不成线性的。反应速率与温度有关,温度越高,速度越快。以2,4-二硝基苯肼作为底物测定酶活性所得结果不精确。实验94琼脂糖电泳法测定乳酸脱氢酶同工酶LD广泛存在于人体各组织的细胞浆中,总活性的测定缺乏组织器官特异性,临床应用有限。而其同工酶的测定具有器官特异性和更高的灵敏度。因此目前除总活性测定外,还结合LD同工酶的测定来提高LD测定的临床应用价值。LD在体内共有5种同工酶形式,每个酶分子由不同数量的H和M亚基共4条多肽链构成,各组织所含的主要同工酶有差异。血清LD同工酶可用多种方法进行分离测定,包括:①电泳法;②免疫化学法;③层析法;④热稳定和抑制法。电泳法分离LD同工酶使用的支持介质包括琼脂糖凝胶和醋酸纤维薄膜、聚丙烯酰胺凝胶等。琼脂糖凝胶电泳法灵敏度高易于定量分析,由阳极至阴极分别为:LDI、LD2、LD3、LD4和LDs。电泳结束后可用光密度计扫描、比色法和荧光法测定每种同工酶的相对含量。【原理】LD各同工酶的一级结构和等电点不同,在一定的电泳条件下,使其在支持介质上分离。然后利用酶的催化反应进行显色:以乳酸钠作为底物,LD催化乳酸脱氢生成丙
5 混匀,室温放置 5min 后,于 440nm 波长处比色,比色杯光径为 1.0cm,用蒸馏水调零, 读取各管吸光度。以测定管与对照管吸光度之差值查校正曲线,得酶活性。 单位定义 以 100ml 血清,37℃,作用底物 15min,产生 1μmol 丙酮酸为一个金氏单位。 【参考范围】 190~437 金氏单位 【注意事项】 1.乳酸锂、乳酸钾、乳酸钠都可以作为 LD 的底物,但后两种为水溶液,若保存不当容 易产生酮酸类物质从而抑制酶促反应,且含量不够准确,目前少用。而乳酸锂为固体,稳定、 易称量。 2.除用二乙醇胺缓冲液外,还可用 Tris 或焦磷酸缓冲液。而甘氨酸对 LD 有抑制作用, 故不采用甘氨酸缓冲液。 3.标本严禁溶血,也不采用草酸盐、EDTA 抗凝血浆。由于 LD4、LD5 对冷不稳定,不 应贮存于冰箱中,血清标本室温可存放 2~3d。 4.比色应在 5~15min 内完成,否则吸光度值会降低。 【评价】 LD 活性测定多采用乳酸生成丙酮酸的反应方向,但反应开始的转化速率是 不成线性的。反应速率与温度有关,温度越高,速度越快。以 2,4-二硝基苯肼作为底物测定 酶活性所得结果不精确。 实验 94 琼脂糖电泳法测定乳酸脱氢酶同工酶 LD 广泛存在于人体各组织的细胞浆中,总活性的测定缺乏组织器官特异性,临床应用 有限。而其同工酶的测定具有器官特异性和更高的灵敏度。因此目前除总活性测定外,还结 合 LD 同工酶的测定来提高 LD 测定的临床应用价值。 LD 在体内共有 5 种同工酶形式,每个酶分子由不同数量的 H 和 M 亚基共 4 条多肽链构 成,各组织所含的主要同工酶有差异。血清 LD 同工酶可用多种方法进行分离测定,包括: ①电泳法;②免疫化学法;③层析法;④热稳定和抑制法。电泳法分离 LD 同工酶使用的支 持介质包括琼脂糖凝胶和醋酸纤维薄膜、聚丙烯酰胺凝胶等。琼脂糖凝胶电泳法灵敏度高, 易于定量分析,由阳极至阴极分别为:LD1、LD2、LD3、LD4 和 LD5。电泳结束后可用光密 度计扫描、比色法和荧光法测定每种同工酶的相对含量。 【原理】 LD 各同工酶的一级结构和等电点不同,在一定的电泳条件下,使其在支持 介质上分离。然后利用酶的催化反应进行显色:以乳酸钠作为底物,LD 催化乳酸脱氢生成丙