
第四章酶学基本知识实验体液中酶活性的测定是临床生化检验的重要组成部分,因此,了解和掌握有关酶活性测定的相关原理、方法、原则及其影响因素是十分必要的。对医学检验专业的学生而言,需要在学习了基本酶学知识与理论的基础上,通过一系列的酶动力学实验,掌握选择酶活性测定的最优条件和建立酶活性的测定方法。酶促反应动力学是研究酶促反应速度及其影响因素的科学,这些影响因素包括温度、pH酶浓度、底物浓度和抑制剂、激活剂等。实验14分离纯化小麦胚芽中酸性磷酸酶要准确了解酶的生物学性质,必须首先将酶提取、纯化出来,然后才能研究纯酶的物理化学性质,以及进一步研究它的分子结构等。这样就必须把混合溶液中的非酶蛋白、其他酶蛋白和大分子化合物予以清除。酶是具有催化活性的蛋白质,一般情况下分离纯化蛋白质的技术都可用于酶蛋白的分离,但分离条件较温和,多采用盐析、透析、电泳、层析及离心等技术,不损伤酶蛋白的高级结构,避免采用高温、过酸、过碱等实验条件。【原理】酸性磷酸酶(acid phosphatase,ACP)在自然界中广泛分布于植物种子、霉菌、以及动物肝脏和前列腺中。植物种子中的ACP在发芽时含量最丰富,随芽胚的生长ACP含量会下降。本实验选用新鲜小麦胚芽作为原料来分离和纯化ACP,具有来源方便、酶含量高等优点。ACP能溶解于稀缓冲液和水中;溶于35%饱和度的硫酸铵溶液中,在57%饱和度的硫酸铵溶液中可沉淀析出;在中性及高温条件下不稳定,在70℃时相对稳定;pH小于6.5时稳定性增加,枸橡酸和乙酸可增加ACP酶溶液的稳定性;Mg2+、Mr2+为ACP激活剂,而Pi、Cu2+、Hg2+、Ag2+、Zn2+、Pb2+、NaF、酒石酸盐、草酸盐和甲醛等是ACP的抑制剂。从小麦胚芽中提取酸性磷酸酶的流程图见图4-1。【试剂】1.饱和(NH4)SO4溶液(pH5.5,4℃)按(NH4)SO476.7g加100ml蒸馏水的比例配制。2.1mol/LMnCl2溶液。3.0.25mol/LEDTA钠盐溶液(pH5.7)
1 第四章 酶学基本知识实验 体液中酶活性的测定是临床生化检验的重要组成部分,因此,了解和掌握有关酶活性测 定的相关原理、方法、原则及其影响因素是十分必要的。对医学检验专业的学生而言,需要 在学习了基本酶学知识与理论的基础上,通过一系列的酶动力学实验,掌握选择酶活性测定 的最优条件和建立酶活性的测定方法。 酶促反应动力学是研究酶促反应速度及其影响因素的科学,这些影响因素包括温度、pH、 酶浓度、底物浓度和抑制剂、激活剂等。 实验 14 分离纯化小麦胚芽中酸性磷酸酶 要准确了解酶的生物学性质,必须首先将酶提取、纯化出来,然后才能研究纯酶的物理 化学性质,以及进一步研究它的分子结构等。这样就必须把混合溶液中的非酶蛋白、其他酶 蛋白和大分子化合物予以清除。 酶是具有催化活性的蛋白质,一般情况下分离纯化蛋白质的技术都可用于酶蛋白的分 离,但分离条件较温和,多采用盐析、透析、电泳、层析及离心等技术,不损伤酶蛋白的高 级结构,避免采用高温、过酸、过碱等实验条件。 【原理】 酸性磷酸酶(acid phosphatase,ACP)在自然界中广泛分布于植物种子、霉菌、 以及动物肝脏和前列腺中。植物种子中的 ACP 在发芽时含量最丰富,随芽胚的生长 ACP 含 量会下降。本实验选用新鲜小麦胚芽作为原料来分离和纯化 ACP,具有来源方便、酶含量高 等优点。 ACP 能溶解于稀缓冲液和水中;溶于 35%饱和度的硫酸铵溶液中,在 57%饱和度的硫酸 铵溶液中可沉淀析出;在中性及高温条件下不稳定,在 70℃时相对稳定;pH 小于 6.5 时稳定 性增加,枸橼酸和乙酸可增加 ACP 酶溶液的稳定性;Mg2+、Mn2+为 ACP 激活剂,而 Pi、Cu2+、 Hg2+、Ag2+、Zn2+、Pb2+、NaF、酒石酸盐、草酸盐和甲醛等是 ACP 的抑制剂。从小麦胚芽中 提取酸性磷酸酶的流程图见图 4-1。 【试剂】 1.饱和(NH4)2SO4 溶液(pH 5.5,4℃) 按(NH4)2SO4 76.7 g 加 100ml 蒸馏水的比例配制。 2.1 mol/L MnCl2 溶液。 3.0.25 mol/L EDTA 钠盐溶液(pH 5.7)

4.甲醇:-30℃预冷。5.新鲜麦芽100g。【操作步骤】1.小麦胚芽的准备选取新鲜、饱满的小麦粒,冷水洗涤后,用冷水浸泡2~4d(天热时需每天换水)使麦粒发胀。将发胀的麦粒放在沥水的塑料筐中,上面覆盖湿的双层纱布,置于通风处,每天浇水2~3次以保持麦粒有一定的湿度。一般情况下,发胀的麦粒在室温20℃经3~7d就可以发出胚芽。在此过程中应注意通风透气,防止麦粒发霉。2.取新鲜小麦胚芽100g加200ml冷蒸馏水在高速、间断条件下捣碎3~5min,得到麦芽匀浆,用2~4层纱布过滤,尽量将液体挤出,弃去纱布上固体物。3.滤液倒入离心管,以4000r/min离心10min。4.弃去沉淀。取上清液记录体积,为上清液1,留10ml于4℃冰箱保存,待作蛋白质和酶活性测定,剩余液体倒入烧杯中。5.向每100ml上清液I中加入2ml的1mol/LMnCl2溶液,并缓慢搅拌混匀。搅拌切勿过快,以免酶蛋白变性并产生大量泡沫6.倒入离心管,以4000r/min离心10min。7.去除沉淀。记录上清液体积,为上清液II,留10ml于4℃冰箱保存,待作蛋白质和酶活性测定,剩余液体倒入烧杯中。8.以54ml饱和(NH4)2SO4/100ml上清液II的比例缓慢加入饱和(NH4)2SO4溶液,在5~10min内加完,轻轻搅拌混匀,使(NH4)2SO4浓度达到35%。加完后继续搅拌10min。9.倒入离心管,以4000r/min离心10min。10.弃去沉淀,取上清液记录体积,为上清液I,留10ml于4℃冰箱保存,待作蛋白质和酶活性测定,剩余液体倒入烧杯中。11.将上述液体在70℃恒温水箱中水浴至62℃2min,迅速用冰水浴冷却至6~8℃12.倒入离心管,以4000r/min离心10min,弃去沉淀。13.以51ml饱和(NH4)2SO4/100ml上清液的比例缓慢加入饱和(NH4)2SO4溶液,轻轻搅拌混匀,使(NH4)2SO4浓度达到57%。14.倒入离心管,以4000r/min离心10min,弃去上清液。15.沉淀用相当于1/3上清液IⅡI体积的蒸馏水溶解、洗涤,以4000r/min离心10min后,弃去沉淀,成为上清液IV,留10ml待作蛋白质和酶活性测定,剩余液体倒入烧杯中。16.剩余的上清液IV按每ml加入0.09ml0.25mol/LEDTA和0.1ml饱和硫酸铵溶液,在缓慢搅拌的条件下,按每ml上清液加2.0ml的比例加入甲醇(一30℃预冷),使蛋白质析出。2
2 4.甲醇:-30℃预冷。 5.新鲜麦芽 100 g。 【操作步骤】 1.小麦胚芽的准备 选取新鲜、饱满的小麦粒,冷水洗涤后,用冷水浸泡 2~4d(天热时 需每天换水)使麦粒发胀。将发胀的麦粒放在沥水的塑料筐中,上面覆盖湿的双层纱布,置于 通风处,每天浇水 2~3 次以保持麦粒有一定的湿度。一般情况下,发胀的麦粒在室温 20℃ 经 3~7d 就可以发出胚芽。在此过程中应注意通风透气,防止麦粒发霉。 2.取新鲜小麦胚芽 100g 加 200ml 冷蒸馏水在高速、间断条件下捣碎 3~5min,得到麦芽 匀浆,用 2~4 层纱布过滤,尽量将液体挤出,弃去纱布上固体物。 3.滤液倒入离心管,以 4 000 r/min 离心 10min 。 4.弃去沉淀。取上清液记录体积,为上清液Ⅰ,留 10ml 于 4℃冰箱保存,待作蛋白质和 酶活性测定,剩余液体倒入烧杯中。 5.向每 100ml 上清液Ⅰ中加入 2ml 的 1 mol/L MnCl2 溶液,并缓慢搅拌混匀。搅拌切勿 过快,以免酶蛋白变性并产生大量泡沫。 6.倒入离心管,以 4 000r/min 离心 10min。 7.去除沉淀。记录上清液体积,为上清液Ⅱ,留 10ml 于 4℃冰箱保存,待作蛋白质和酶 活性测定,剩余液体倒入烧杯中。 8.以 54ml 饱和(NH4)2SO4/100ml 上清液Ⅱ的比例缓慢加入饱和(NH4)2SO4 溶液,在 5~ 10min 内加完,轻轻搅拌混匀,使(NH4)2SO4 浓度达到 35%。加完后继续搅拌 10min。 9.倒入离心管,以 4 000 r/min 离心 10min。 10.弃去沉淀,取上清液记录体积,为上清液Ⅲ,留 10ml 于 4℃冰箱保存,待作蛋白质 和酶活性测定,剩余液体倒入烧杯中。 11.将上述液体在 70℃恒温水箱中水浴至 62℃ 2min,迅速用冰水浴冷却至 6~8℃。 12.倒入离心管,以 4 000 r/min 离心 10min,弃去沉淀。 13.以 51ml 饱和(NH4)2SO4/100ml 上清液的比例缓慢加入饱和(NH4)2SO4 溶液,轻轻搅拌 混匀,使(NH4)2SO4 浓度达到 57%。 14.倒入离心管,以 4 000 r/min 离心 10min,弃去上清液。 15.沉淀用相当于 1/3 上清液Ⅲ体积的蒸馏水溶解、洗涤,以 4 000 r/min 离心 10min 后, 弃去沉淀,成为上清液Ⅳ,留 10ml 待作蛋白质和酶活性测定,剩余液体倒入烧杯中。 16.剩余的上清液Ⅳ按每 ml 加入 0.09ml 0.25mol/L EDTA 和 0.1ml 饱和硫酸铵溶液,在 缓慢搅拌的条件下,按每 ml 上清液加 2.0ml 的比例加入甲醇(-30℃预冷),使蛋白质析出
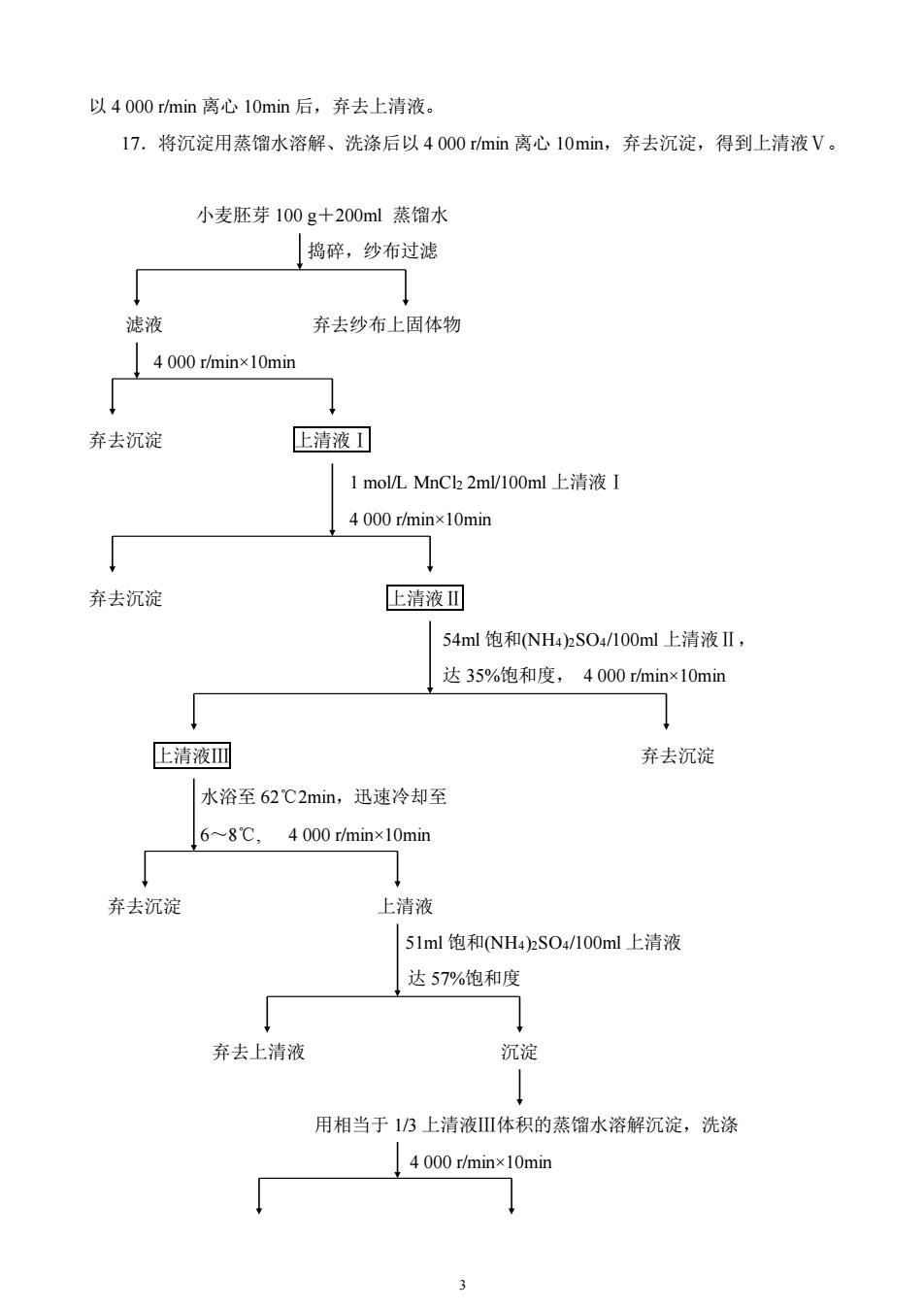
以4000r/min离心10min后,弃去上清液。17.将沉淀用蒸馏水溶解、洗涤后以4000r/min离心10min,弃去沉淀,得到上清液V。小麦胚芽100g+200ml蒸馏水[揭碎,纱布过滤滤液弃去纱布上固体物1 4 000 /minx10minE清液弃去沉淀1mol/LMnClz2ml/100ml上清液I4 000r/minx10min→弃去沉淀E清液54ml饱和(NH4)2SO4/100ml上清液II,达35%饱和度,4000r/min×10min+?上清液弃去沉淀水浴至62℃2min,迅速冷却至6~8℃,4000 r/min×10minI弃去沉淀上清液51ml饱和(NH4)SO4/100ml上清液达57%饱和度弃去上清液沉淀用相当于1/3上清液I体积的蒸馏水溶解沉淀,洗涤4 000 /minx10min↓+
3 以 4 000 r/min 离心 10min 后,弃去上清液。 17.将沉淀用蒸馏水溶解、洗涤后以 4 000 r/min 离心 10min,弃去沉淀,得到上清液Ⅴ。 小麦胚芽 100 g+200ml 蒸馏水 捣碎,纱布过滤 滤液 弃去纱布上固体物 4 000 r/min×10min 弃去沉淀 上清液Ⅰ 1 mol/L MnCl2 2ml/100ml 上清液Ⅰ 4 000 r/min×10min 弃去沉淀 上清液Ⅱ 54ml 饱和(NH4)2SO4/100ml 上清液Ⅱ, 达 35%饱和度, 4 000 r/min×10min 上清液Ⅲ 弃去沉淀 水浴至 62℃2min,迅速冷却至 6~8℃, 4 000 r/min×10min 弃去沉淀 上清液 51ml 饱和(NH4)2SO4/100ml 上清液 达 57%饱和度 弃去上清液 沉淀 用相当于 1/3 上清液Ⅲ体积的蒸馏水溶解沉淀,洗涤 4 000 r/min×10min
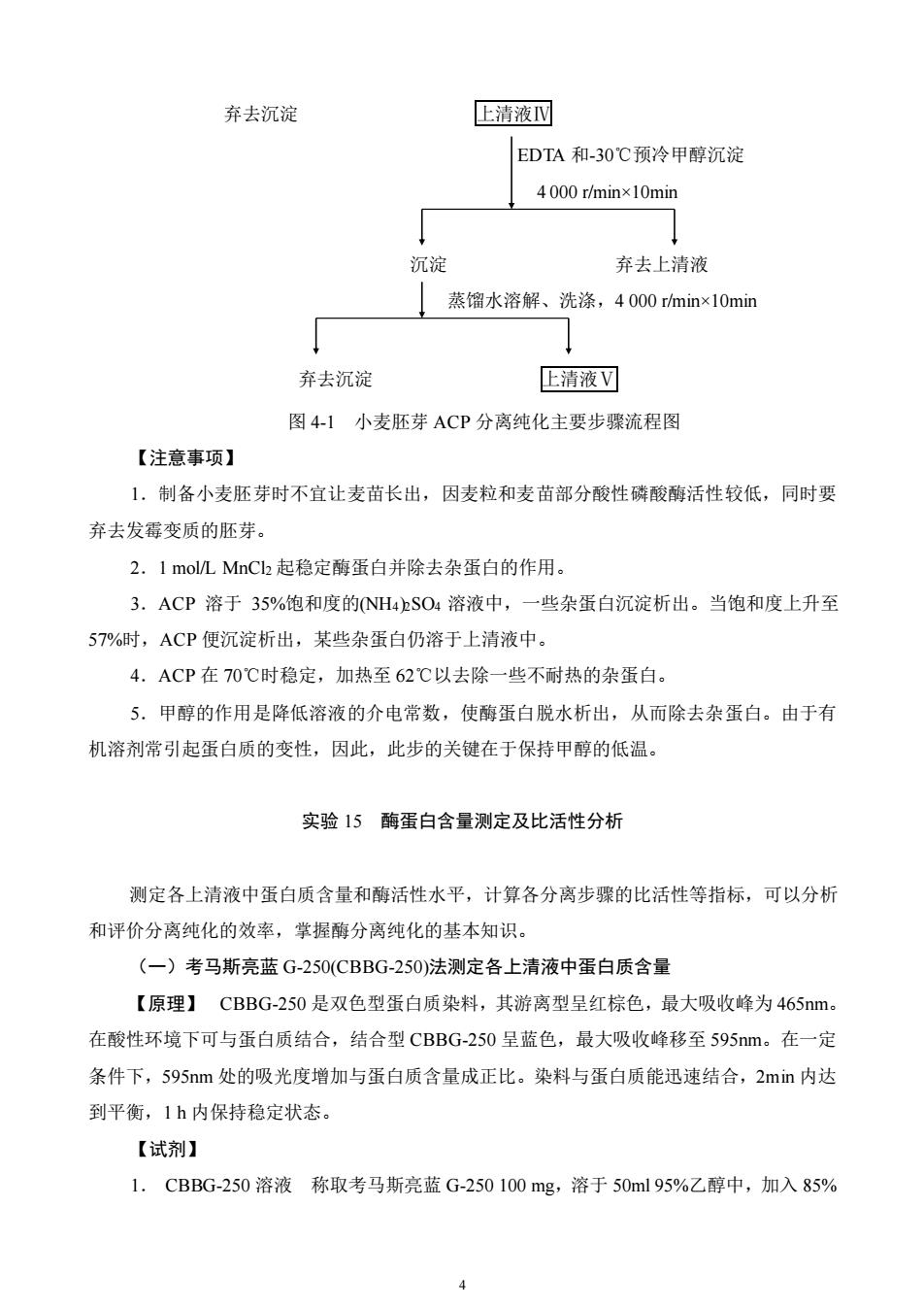
弃去沉淀上清液EDTA和-30°℃预冷甲醇沉淀4000 r/min×10min→沉淀弃去上清液1蒸馏水溶解、洗涤,4000 /minx10min+弃去沉淀E清液图4-1小麦胚芽ACP分离纯化主要步骤流程图【注意事项】1.制备小麦胚芽时不宜让麦苗长出,因麦粒和麦苗部分酸性磷酸酶活性较低,同时要弃去发霉变质的胚芽。2.1mol/LMnCh 起稳定酶蛋白并除去杂蛋白的作用。3.ACP溶于35%饱和度的(NH4)SO4溶液中,一些杂蛋白沉淀析出。当饱和度上升至57%时,ACP便沉淀析出,某些杂蛋白仍溶于上清液中。4.ACP在70℃时稳定,加热至62℃以去除一些不耐热的杂蛋白。5.甲醇的作用是降低溶液的介电常数,使酶蛋白脱水析出,从而除去杂蛋白。由于有机溶剂常引起蛋白质的变性,因此,此步的关键在于保持甲醇的低温。实验15酶蛋白含量测定及比活性分析测定各上清液中蛋白质含量和酶活性水平,计算各分离步骤的比活性等指标,可以分析和评价分离纯化的效率,掌握酶分离纯化的基本知识。(一)考马斯亮蓝G-250(CBBG-250)法测定各上清液中蛋白质含量【原理】CBBG-250是双色型蛋白质染料,其游离型呈红棕色,最大吸收峰为465nm在酸性环境下可与蛋白质结合,结合型CBBG-250呈蓝色,最大吸收峰移至595nm。在一定条件下,595nm处的吸光度增加与蛋白质含量成正比。染料与蛋白质能迅速结合,2min内达到平衡,1h内保持稳定状态。【试剂】1.CBBG-250溶液称取考马斯亮蓝G-250100mg,溶于50ml95%乙醇中,加入85%4
4 弃去沉淀 上清液Ⅳ EDTA 和-30℃预冷甲醇沉淀 4 000 r/min×10min 沉淀 弃去上清液 蒸馏水溶解、洗涤,4 000 r/min×10min 弃去沉淀 上清液Ⅴ 图 4-1 小麦胚芽 ACP 分离纯化主要步骤流程图 【注意事项】 1.制备小麦胚芽时不宜让麦苗长出,因麦粒和麦苗部分酸性磷酸酶活性较低,同时要 弃去发霉变质的胚芽。 2.1 mol/L MnCl2 起稳定酶蛋白并除去杂蛋白的作用。 3.ACP 溶于 35%饱和度的(NH4)2SO4 溶液中,一些杂蛋白沉淀析出。当饱和度上升至 57%时,ACP 便沉淀析出,某些杂蛋白仍溶于上清液中。 4.ACP 在 70℃时稳定,加热至 62℃以去除一些不耐热的杂蛋白。 5.甲醇的作用是降低溶液的介电常数,使酶蛋白脱水析出,从而除去杂蛋白。由于有 机溶剂常引起蛋白质的变性,因此,此步的关键在于保持甲醇的低温。 实验 15 酶蛋白含量测定及比活性分析 测定各上清液中蛋白质含量和酶活性水平,计算各分离步骤的比活性等指标,可以分析 和评价分离纯化的效率,掌握酶分离纯化的基本知识。 (一)考马斯亮蓝 G-250(CBBG-250)法测定各上清液中蛋白质含量 【原理】 CBBG-250 是双色型蛋白质染料,其游离型呈红棕色,最大吸收峰为 465nm。 在酸性环境下可与蛋白质结合,结合型 CBBG-250 呈蓝色,最大吸收峰移至 595nm。在一定 条件下,595nm 处的吸光度增加与蛋白质含量成正比。染料与蛋白质能迅速结合,2min 内达 到平衡,1 h 内保持稳定状态。 【试剂】 1. CBBG-250 溶液 称取考马斯亮蓝 G-250 100 mg,溶于 50ml 95%乙醇中,加入 85%
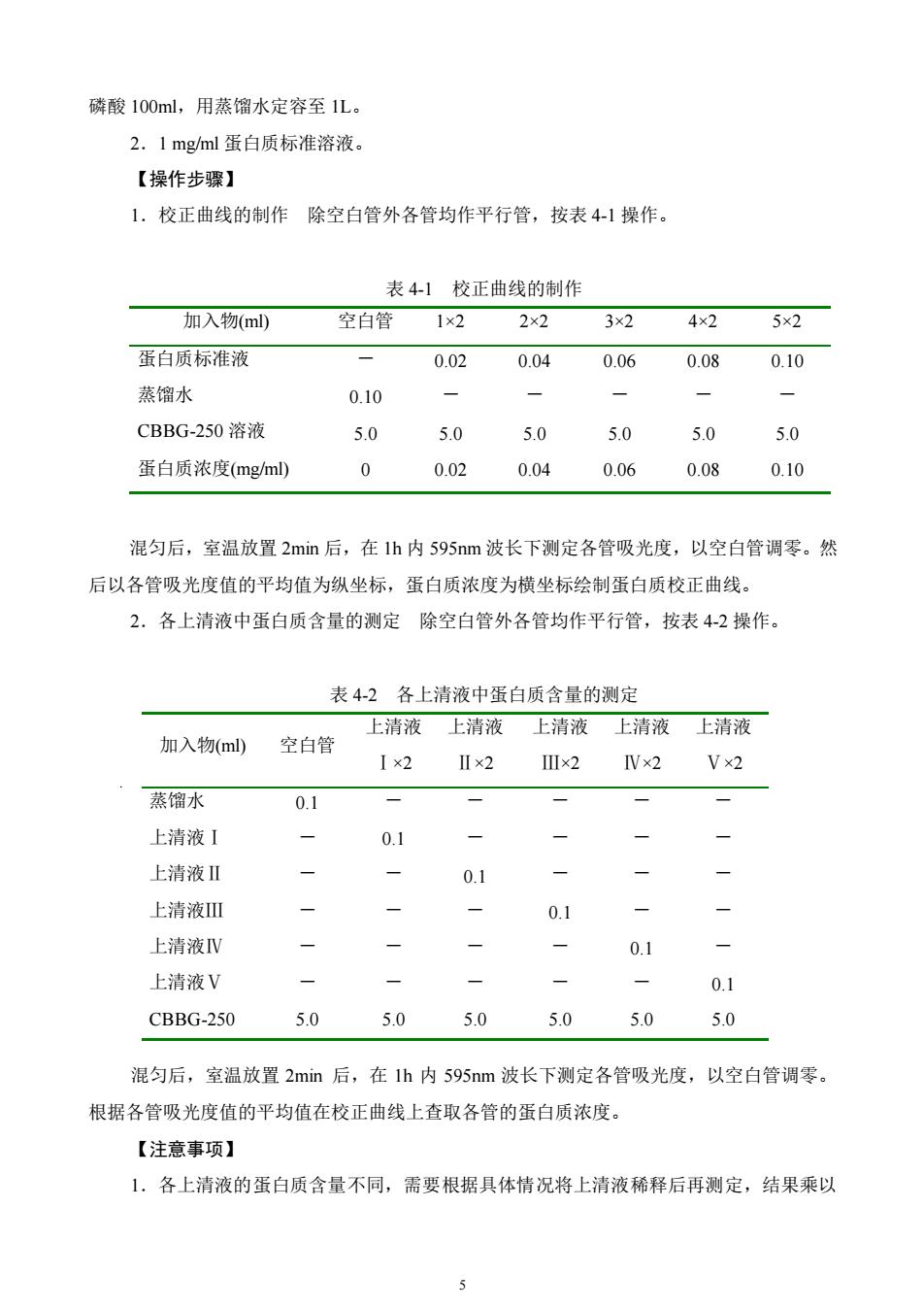
磷酸100ml,用蒸馏水定容至1L。2.1mg/ml蛋白质标准溶液。【操作步骤】1.校正曲线的制作除空白管外各管均作平行管,按表4-1操作。表4-1校正曲线的制作加入物(ml)空白管1×24x22×23×25×2蛋白质标准液0.040.060.080.100.02蒸馏水0.10-一一CBBG-250 溶液5.05.05.05.05.05.00.02蛋白质浓度(mg/ml)00.040.060.080.10混匀后,室温放置2min后,在1h内595nm波长下测定各管吸光度,以空白管调零。然后以各管吸光度值的平均值为纵坐标,蛋白质浓度为横坐标绘制蛋白质校正曲线。2.各上清液中蛋白质含量的测定除空白管外各管均作平行管,按表4-2操作表42各上清液中蛋白质含量的测定上清液上清液上清液上清液上清液加入物(ml)空白管Ix2IIx2II x2IV×2Vx2蒸馏水0.1上清液I0.1 --一--上清液II0一1一上清液IⅢI-0.1 一一上清液IV---/-0.1 ----上清液V0.1 一5.05.05.05.05.0CBBG-2505.0混匀后,室温放置2min后,在1h内595nm波长下测定各管吸光度,以空白管调零。根据各管吸光度值的平均值在校正曲线上查取各管的蛋白质浓度。【注意事项】1.各上清液的蛋白质含量不同,需要根据具体情况将上清液稀释后再测定,结果乘以
5 磷酸 100ml,用蒸馏水定容至 1L。 2.1 mg/ml 蛋白质标准溶液。 【操作步骤】 1.校正曲线的制作 除空白管外各管均作平行管,按表 4-1 操作。 表 4-1 校正曲线的制作 加入物(ml) 空白管 1×2 2×2 3×2 4×2 5×2 蛋白质标准液 - 0.02 0.04 0.06 0.08 0.10 蒸馏水 0.10 - - - - - CBBG-250 溶液 5.0 5.0 5.0 5.0 5.0 5.0 蛋白质浓度(mg/ml) 0 0.02 0.04 0.06 0.08 0.10 混匀后,室温放置 2min 后,在 1h 内 595nm 波长下测定各管吸光度,以空白管调零。然 后以各管吸光度值的平均值为纵坐标,蛋白质浓度为横坐标绘制蛋白质校正曲线。 2.各上清液中蛋白质含量的测定 除空白管外各管均作平行管,按表 4-2 操作。 表 4-2 各上清液中蛋白质含量的测定 混匀后,室温放置 2min 后,在 1h 内 595nm 波长下测定各管吸光度,以空白管调零。 根据各管吸光度值的平均值在校正曲线上查取各管的蛋白质浓度。 【注意事项】 1.各上清液的蛋白质含量不同,需要根据具体情况将上清液稀释后再测定,结果乘以 加入物(ml) 空白管 上清液 Ⅰ×2 上清液 Ⅱ×2 上清液 Ⅲ×2 上清液 Ⅳ×2 上清液 Ⅴ×2 蒸馏水 0.1 - - - - - 上清液Ⅰ - 0.1 - - - - 上清液Ⅱ - - 0.1 - - - 上清液Ⅲ - - - 0.1 - - 上清液Ⅳ - - - - 0.1 - 上清液Ⅴ - - - - - 0.1 CBBG-250 5.0 5.0 5.0 5.0 5.0 5.0