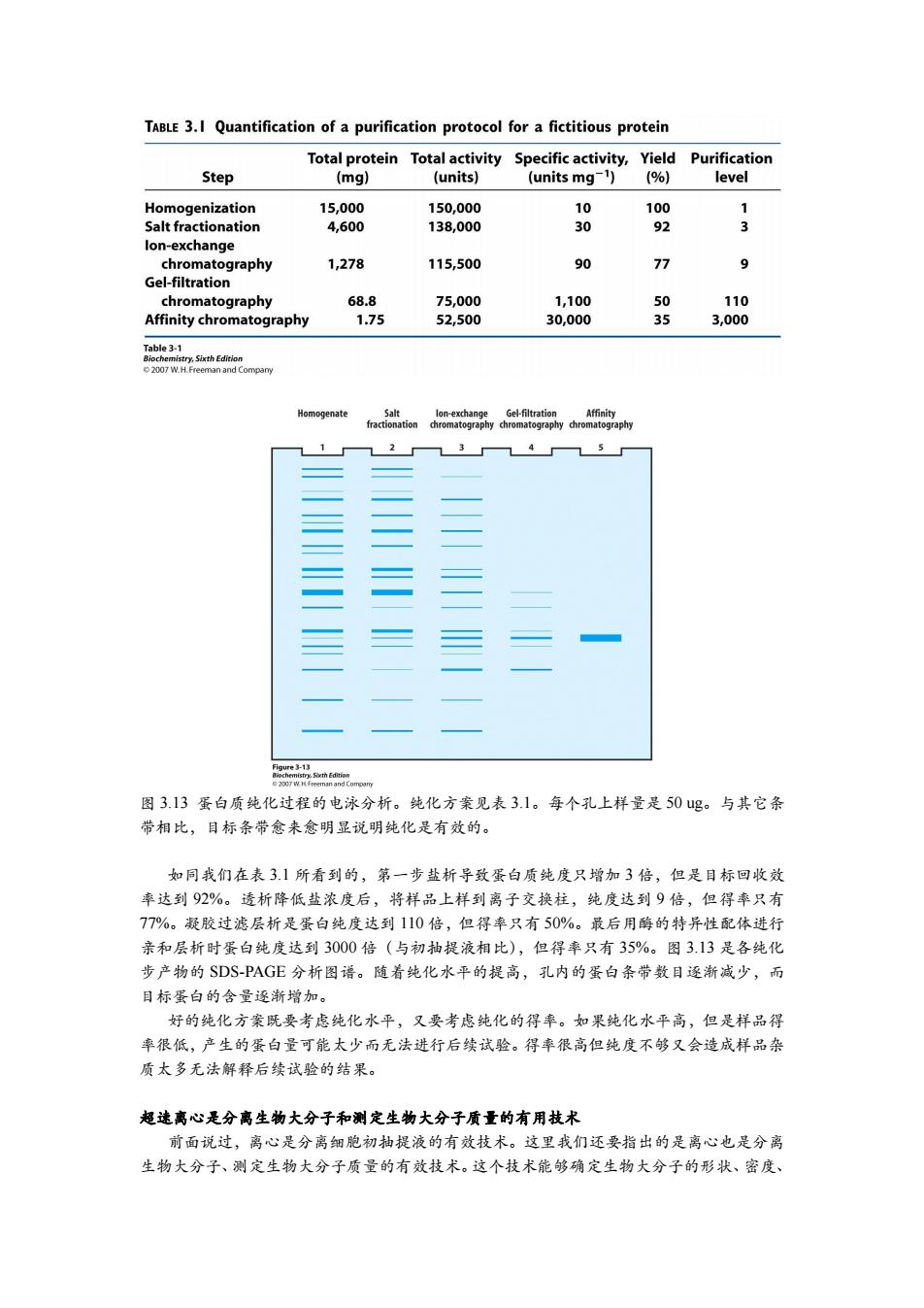
TABLE 3.I Quantification of a purification protocol for a fictitious protein Total protein Total activity Specific activity,Yield Purification Step (mg) (units) (units mg-1)(%) level Homogenization 15,000 150,000 10 100 Salt fractionation 4,600 138,000 30 92 3 lon-exchange chromatography 1,278 115,500 90 77 9 Gel-filtration chromatography 68.8 75,000 1,100 50 110 Affinity chromatography 1.75 52,500 30,000 35 3,000 Table3-1 Biochemistry,Sixth Edition 2007 W.H.Freeman and Compary Homogenate Salt lon-exchange Gel-filtration Affinity fractionation chromatography chromatography chromatography 1 2 3 4 5 图313蛋白质纯化过程的电泳分析。纯化方案见表3.1。每个孔上样量是50ug。与其它条 带相比,目标条带念来愈明显说明纯化是有效的。 如同我们在表3】所看到的,第一步盐析导致蛋白质纯度只增加3倍,但是目标回收效 率达到92%。透析降低盐浓度后,将样品上样到离子交换柱,纯度达到9倍,但得率只有 77%。凝胶过滤层析是蛋白纯度达到110倍,但得率只有50%。最后用酶的特异性配体进行 亲和层析时蛋白纯度达到3000倍(与初抽提液相比),但得率只有35%。图3.13是各纯化 步产物的SDS-PAGE分析图谱。随着纯化水平的提高,孔内的蛋白条带数目逐渐减少,而 目标蛋白的含量逐渐增加。 好的纯化方案既要考虑纯化水平,又要考虑纯化的得率。如果纯化水平高,但是样品得 率很低,产生的蛋白量可能太少而无法进行后续试验。得率很高但纯度不够又会造成样品杂 质太多无法解释后续试验的结果。 超速离心是分离生物大分子和测定生物大分子质量的有用技术 前面说过,离心是分离细胞初抽提液的有效技术。这里我们还要指出的是离心也是分离 生物大分子、测定生物大分子质量的有效技术。这个技术能够确定生物大分子的形状、密度
图 3.13 蛋白质纯化过程的电泳分析。纯化方案见表 3.1。每个孔上样量是 50 ug。与其它条 带相比,目标条带愈来愈明显说明纯化是有效的。 如同我们在表 3.1 所看到的,第一步盐析导致蛋白质纯度只增加 3 倍,但是目标回收效 率达到 92%。透析降低盐浓度后,将样品上样到离子交换柱,纯度达到 9 倍,但得率只有 77%。凝胶过滤层析是蛋白纯度达到 110 倍,但得率只有 50%。最后用酶的特异性配体进行 亲和层析时蛋白纯度达到 3000 倍(与初抽提液相比),但得率只有 35%。图 3.13 是各纯化 步产物的 SDS-PAGE 分析图谱。随着纯化水平的提高,孔内的蛋白条带数目逐渐减少,而 目标蛋白的含量逐渐增加。 好的纯化方案既要考虑纯化水平,又要考虑纯化的得率。如果纯化水平高,但是样品得 率很低,产生的蛋白量可能太少而无法进行后续试验。得率很高但纯度不够又会造成样品杂 质太多无法解释后续试验的结果。 超速离心是分离生物大分子和测定生物大分子质量的有用技术 前面说过,离心是分离细胞初抽提液的有效技术。这里我们还要指出的是离心也是分离 生物大分子、测定生物大分子质量的有效技术。这个技术能够确定生物大分子的形状、密度
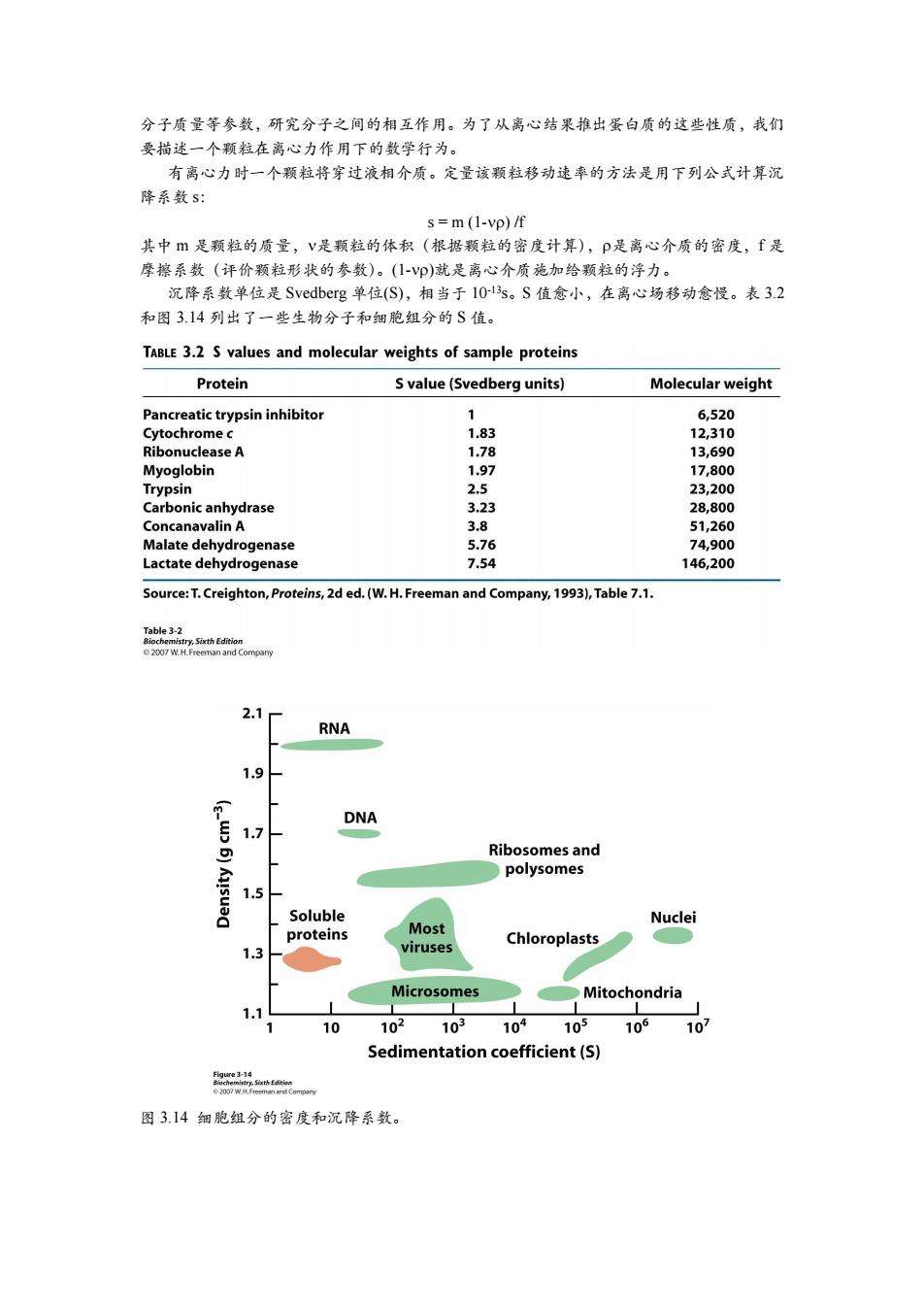
分子质量等参数,研究分子之间的相互作用。为了从离心结果推出蛋白质的这些性质,我们 要描述一个颗粒在离心力作用下的数学行为。 有离心力时一个颗粒将穿过液相介质。定量该颗粒移动速率的方法是用下列公式计算沉 降系数S: s=m (1-vp)/f 其中是颗粒的质量,V是颗粒的体积(根据颗粒的密度计算),P是离心介质的密度,f是 摩擦系数(评价颗粒形状的参数)。(1-Vp)就是离心介质施加给颗粒的浮力。 沉降系数单位是Svedberg单位(S),相当于1013s。S值愈小,在离心场移动愈慢。表3.2 和图314列出了一些生物分子和细胞组分的S值。 TABLE 3.2 S values and molecular weights of sample proteins Protein S value(Svedberg units) Molecular weight Pancreatic trypsin inhibitor 6,520 Cytochrome c 1.83 12,310 Ribonuclease A 1.78 13,690 Myoglobin 1.97 17,800 Trypsin 2.5 23,200 Carbonic anhydrase 3.23 28,800 Concanavalin A 3.8 51,260 Malate dehydrogenase 5.76 74,900 Lactate dehydrogenase 7.54 146,200 Source:T.Creighton,Proteins,2d ed.(W.H.Freeman and Company,1993),Table 7.1. Table 32 istry.Sixth Edition 2007 W.H.Freeman and Compary 2.1 RNA 1.9 m DNA 1.7 Ribosomes and polysomes 1.5 Soluble Nuclei proteins Most Chloroplasts 1.3 viruses Microsomes Mitochondria 10 102 10 104 105 106 10 Sedimentation coefficient(S) Figure 3-14 图3.14细胞组分的密度和沉降系数
分子质量等参数,研究分子之间的相互作用。为了从离心结果推出蛋白质的这些性质,我们 要描述一个颗粒在离心力作用下的数学行为。 有离心力时一个颗粒将穿过液相介质。定量该颗粒移动速率的方法是用下列公式计算沉 降系数 s: s = m (1-) /f 其中 m 是颗粒的质量,是颗粒的体积(根据颗粒的密度计算),是离心介质的密度,f 是 摩擦系数(评价颗粒形状的参数)。(1-)就是离心介质施加给颗粒的浮力。 沉降系数单位是 Svedberg 单位(S),相当于 10 -13s。S 值愈小,在离心场移动愈慢。表 3.2 和图 3.14 列出了一些生物分子和细胞组分的 S 值。 图 3.14 细胞组分的密度和沉降系数

1.一种颗粒的沉降速度部分取决于该颗粒的质量。如果形状和密度相同,那么质量越大, 颗粒的沉降速度愈快。 2.形状也影响沉降速度,因为颗粒的形状会影响颗粒沉降的粘度。同样质量的颗粒,紧密 压缩颗粒的摩擦系数比那些伸展颗粒的摩擦系数小。因此球状颗粒的沉降速度比同质量 长形颗粒的沉降速度快。 3.密度大的颗粒因为要克服的浮力(1-Vp)小,其沉降速度比密度小的颗粒快。 4.沉降速度也依赖于溶液的密度(p)。当Vp<1颗粒沉降;当vp>1颗粒上浮;当vp=I颗 粒不移动。 分带离心技术(也称梯度离心)能用来分离沉降系数不同的蛋白质。第一步在离心管内 建立密度梯度。用梯度混合液注入20%~5%的蔗糖线性梯度溶液(图3.15),造成离心管 底部蔗糖浓度是20%,顶部蔗糖浓度是5%的线性梯度。浓度梯度的介质阻止了对流。待分 离的蛋白质溶液(小体积)置于密度梯度介质顶部。当转子旋转,蛋白质依据其沉降系数通 过梯度溶液。根据经验确定离心的时间和离心的速度。离心后在离心管底部刺出一个小洞, 收集离心管内分离的各个条带。然后测定各组分的蛋白质含量、酶的催化活性、或蛋白质的 其它特性。密度梯度离心技术可用来分离沉降系数差异达到2或2以上的蛋白质。 离心沉降平衡技术能直接用来测定蛋白质的分子量。此时离心速度较慢使蛋白质沉降和 蛋白质扩散达到平衡。用离心沉降平衡技术测定的蛋白质质量非常准确,适于天然蛋白分子 质量的测定。这种条件能保留多亚基蛋白质天然的四级结构。相反,在蛋白质变性条件进行 的SDS-聚丙烯酰胺凝胶电泳只能测定解离多肽链的质量。如果我们既知道一个多聚体蛋白 质沉降平衡离心的分子质量,又知道这个蛋白分子在变性条件下各组分的质量,我们就能够 确定该多亚基蛋白各个多肽链的拷贝数。 Layering of Low-density High-density sample solution solution Fractions collected through Separation by hole in bottom sedimentation of tube coetficient Centrifuge tube Density gradient. 图3.15区带离心。操作步骤如下:(A)形成密度梯度的离心介质,(B)将待分离样品置于 梯度溶液的顶部,(C)将离心管置于悬挂式离心转子并离心,(D)收集样品。 3.2自动Edman降解测定氨基酸序列 当蛋白质被纯化后,就能用来测定蛋白质的氨基酸序列(或蛋白质一级结构)。我们先 考察一下如何确定一个简单多肽Ala-Gly-Asp-Phe-Arg-Gly的氨基酸序列。 第一步是确定多肽的氨基酸组成。在6NHC1,110℃加热24小时将多肽断裂成氨基酸。 然后用离子交换层析对氨基酸进行分离,并根据洗脱体积确定各氨基酸组分(图316)。除 了脯氨酸外,用茚三酮处理氨基酸产生深蓝色。由于脯氨酸含有二级胺,茚三酮处理产生黄 色物质。用茚三酮处理后,氨基酸浓度与溶液的光吸收成正比。这种技术可以检测到1微克 (10nmol)的氨基酸(相当于一个指纹所携带的氨基酸含量)。用荧光胺代替茚三酮,可以
1. 一种颗粒的沉降速度部分取决于该颗粒的质量。如果形状和密度相同,那么质量越大, 颗粒的沉降速度愈快。 2. 形状也影响沉降速度,因为颗粒的形状会影响颗粒沉降的粘度。同样质量的颗粒,紧密 压缩颗粒的摩擦系数比那些伸展颗粒的摩擦系数小。因此球状颗粒的沉降速度比同质量 长形颗粒的沉降速度快。 3. 密度大的颗粒因为要克服的浮力(1-)小,其沉降速度比密度小的颗粒快。 4. 沉降速度也依赖于溶液的密度()。当 颗粒沉降;当 颗粒上浮;当 颗 粒不移动。 分带离心技术(也称梯度离心)能用来分离沉降系数不同的蛋白质。第一步在离心管内 建立密度梯度。用梯度混合液注入 20% ~ 5%的蔗糖线性梯度溶液(图 3.15),造成离心管 底部蔗糖浓度是 20%,顶部蔗糖浓度是 5%的线性梯度。浓度梯度的介质阻止了对流。待分 离的蛋白质溶液(小体积)置于密度梯度介质顶部。当转子旋转,蛋白质依据其沉降系数通 过梯度溶液。根据经验确定离心的时间和离心的速度。离心后在离心管底部刺出一个小洞, 收集离心管内分离的各个条带。然后测定各组分的蛋白质含量、酶的催化活性、或蛋白质的 其它特性。密度梯度离心技术可用来分离沉降系数差异达到 2 或 2 以上的蛋白质。 离心沉降平衡技术能直接用来测定蛋白质的分子量。此时离心速度较慢使蛋白质沉降和 蛋白质扩散达到平衡。用离心沉降平衡技术测定的蛋白质质量非常准确,适于天然蛋白分子 质量的测定。这种条件能保留多亚基蛋白质天然的四级结构。相反,在蛋白质变性条件进行 的 SDS-聚丙烯酰胺凝胶电泳只能测定解离多肽链的质量。如果我们既知道一个多聚体蛋白 质沉降平衡离心的分子质量,又知道这个蛋白分子在变性条件下各组分的质量,我们就能够 确定该多亚基蛋白各个多肽链的拷贝数。 图 3.15 区带离心。操作步骤如下:(A)形成密度梯度的离心介质,(B)将待分离样品置于 梯度溶液的顶部,(C)将离心管置于悬挂式离心转子并离心,(D)收集样品。 3.2 自动 Edman 降解测定氨基酸序列 当蛋白质被纯化后,就能用来测定蛋白质的氨基酸序列(或蛋白质一级结构)。我们先 考察一下如何确定一个简单多肽 Ala-Gly-Asp-Phe-Arg-Gly 的氨基酸序列。 第一步是确定多肽的氨基酸组成。在 6N HCl,110 oC 加热 24 小时将多肽断裂成氨基酸。 然后用离子交换层析对氨基酸进行分离,并根据洗脱体积确定各氨基酸组分(图 3.16)。除 了脯氨酸外,用茚三酮处理氨基酸产生深蓝色。由于脯氨酸含有二级胺,茚三酮处理产生黄 色物质。用茚三酮处理后,氨基酸浓度与溶液的光吸收成正比。这种技术可以检测到 1 微克 (10 nmol)的氨基酸(相当于一个指纹所携带的氨基酸含量)。用荧光胺代替茚三酮,可以
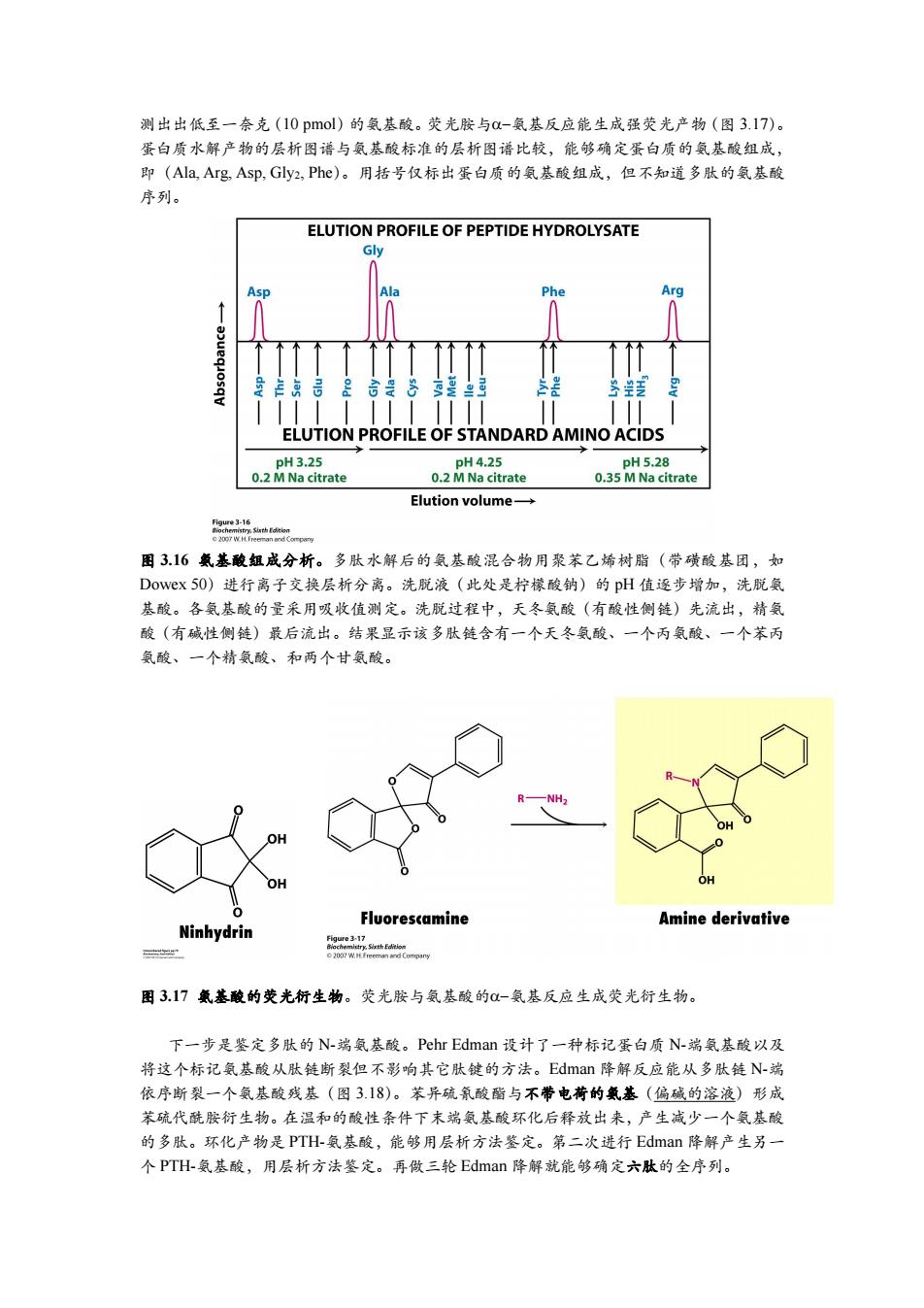
测出出低至一奈克(10pmol)的氨基酸。荧光胺与o-氨基反应能生成强荧光产物(图3.17)。 蛋白质水解产物的层析图谱与氨基酸标准的层析图谱比较,能够确定蛋白质的氨基酸组成, 即(Ala,Arg,Asp,Gly2,Phe)。用括号仅标出蛋白质的氨基酸组成,但不知道多肽的氨基酸 序列。 ELUTION PROFILE OF PEPTIDE HYDROLYSATE Gly Asp Ala Phe Arg 合是8是出3 ELUTION PROFILE OF STANDARD AMINO ACIDS pH3.25 pH4.25 pH5.28 0.2 M Na citrate 0.2 M Na citrate 0.35 M Na citrate Elution volume→ fgeci5ahlsron 图3.16氢基酸组成分析。多肽水解后的氨基酸混合物用聚苯乙烯树脂(带磺酸基团,如 Dowex50)进行离子交换层析分离。洗脱液(此处是柠檬酸钠)的pH值逐步增加,洗脱氨 基酸。各氨基酸的量采用吸收值测定。洗脱过程中,天冬氨酸(有酸性侧链)先流出,精氨 酸(有碱性侧链)最后流出。结果显示该多肽链含有一个天冬氨酸、一个丙氨酸、一个苯丙 氨酸、一个精氨酸、和两个甘氨酸。 OH Fluorescamine Amine derivative Ninhydrin Figure 3-17 图3.17氧基酸的荧光衍生物。荧光胺与氨基酸的-氨基反应生成荧光衍生物。 下一步是鉴定多肽的N-端氨基酸。Pehr Edman设计了一种标记蛋白质N-端氨基酸以及 将这个标记氨基酸从肽链断裂但不影响其它肽键的方法。Edman降解反应能从多肽链N-端 依序断裂一个氨基酸残基(图3.18)。苯异硫氛酸酯与不带电荷的氨基(偏碱的溶液)形成 苯硫代酰胺衍生物。在温和的酸性条件下末端氨基酸环化后释放出来,产生减少一个氨基酸 的多肽。环化产物是PTH-氨基酸,能够用层析方法鉴定。第二次进行Edman降解产生另一 个PTH-氨基酸,用层析方法鉴定。再做三轮Edman降解就能够确定六肽的全序列
测出出低至一奈克(10 pmol)的氨基酸。荧光胺与氨基反应能生成强荧光产物(图 3.17)。 蛋白质水解产物的层析图谱与氨基酸标准的层析图谱比较,能够确定蛋白质的氨基酸组成, 即(Ala, Arg, Asp, Gly2, Phe)。用括号仅标出蛋白质的氨基酸组成,但不知道多肽的氨基酸 序列。 图 3.16 氨基酸组成分析。多肽水解后的氨基酸混合物用聚苯乙烯树脂(带磺酸基团,如 Dowex 50)进行离子交换层析分离。洗脱液(此处是柠檬酸钠)的 pH 值逐步增加,洗脱氨 基酸。各氨基酸的量采用吸收值测定。洗脱过程中,天冬氨酸(有酸性侧链)先流出,精氨 酸(有碱性侧链)最后流出。结果显示该多肽链含有一个天冬氨酸、一个丙氨酸、一个苯丙 氨酸、一个精氨酸、和两个甘氨酸。 图 3.17 氨基酸的荧光衍生物。荧光胺与氨基酸的氨基反应生成荧光衍生物。 下一步是鉴定多肽的 N-端氨基酸。Pehr Edman 设计了一种标记蛋白质 N-端氨基酸以及 将这个标记氨基酸从肽链断裂但不影响其它肽键的方法。Edman 降解反应能从多肽链 N-端 依序断裂一个氨基酸残基(图 3.18)。苯异硫氰酸酯与不带电荷的氨基(偏碱的溶液)形成 苯硫代酰胺衍生物。在温和的酸性条件下末端氨基酸环化后释放出来,产生减少一个氨基酸 的多肽。环化产物是 PTH-氨基酸,能够用层析方法鉴定。第二次进行 Edman 降解产生另一 个 PTH-氨基酸,用层析方法鉴定。再做三轮 Edman 降解就能够确定六肽的全序列