
亲和层析。亲和层析是另一种有效的蛋白质纯化技术。该技术利用蛋白质对特定化学基团的 高度亲和性进行蛋白质纯化。例如,共价连接了葡萄糖的层析柱能用来从植物抽提液纯化植 物蛋白质刀豆素A(图3.5)。因为刀豆素A与葡萄糖的亲和性很高,而其他蛋白质与葡萄糖 的亲和性很低。植物蛋白抽提液流过这样的层析柱,只有刀豆素A结合到层析柱上,其它 蛋白质统统流出。然后用含有葡萄糖的层析溶液将将刀豆素A洗出。液相葡萄糖能替代固 相葡萄糖,使刀豆素A从固相洗下(图3.5)。亲和层析也是分离转录因子的有效技术。转 录因子能够与特定DNA序列结合,调节基因转录(39章和31章)。蛋白质混合物流过共价 交联了DNA的层析柱,那些与该DNA序列亲和性高的蛋白质组分将滞留在柱上。然后用 高浓度盐溶液将柱上结合的蛋白质洗出。 Glucose-binding Glucose-binding protein attaches proteins are to glucose released on residues (G)on addition of beads Addition of glucose glucose(G) GG GG Figure 3-5 Biochemistry,Sixth Edition 2007 W.H.Freeman and Company 图3.5亲和层析。用交联了葡萄糖(G)的固相载体亲和层析纯化刀豆素A(黄色)。 亲和层析纯化蛋白质的方法是(1)先将蛋白质识别的基团X或者X的衍生物共价交联 于固相载体上,然后将这种固相载体装入层析柱;(2)将蛋白质混合物流过这种亲和柱,并 用结合缓冲液洗涤除去不结合蛋白质;(3)用高浓度X溶液、或者用能够降低蛋白质与X 亲和力的缓冲液洗柱,将目标蛋白质洗出。如果蛋白质与X分子(即诱饵分子)相互作用 具有高度特异性,那么亲和层析是一种非常有效地纯化蛋白质技术。 如果纯化重组蛋白质(52节),也可以更改上述的亲和纯化方案。此时修改编码基因, 使基因还编码一段额外的氨基酸序列,这段额外的氨基酸序列充当充当亲和层析标签用于亲 和纯化。例如,一串组氨酸(即Hs标签)可以添加到表达蛋白质的C-端或N-端。有标签 的蛋白质流过共价交联了N+或其它金属离子的固相载体。Hs标签与固相金属离子紧密结 合,导致表达蛋白质也与载体紧密结合。那些没有HS标签的蛋白质不能与固相载体结合, 直接从亲和柱流出。加入咪唑或其它化学物质溶液,能够与金属离子结合从而将带有Hs 标签的蛋白质洗出。 高压液相层析。高压液相层析是上述柱层析技术的加强型。层析柱的固相载体介质更细, 因此与蛋白质相互作用的位点更多,分辨率更高。由于载体介质更细,因此需要更大的压力 才能获得足量的流速。最终的结果是HPLC的分辨率高,分离所需的时间短(图3.6)
亲和层析。亲和层析是另一种有效的蛋白质纯化技术。该技术利用蛋白质对特定化学基团的 高度亲和性进行蛋白质纯化。例如,共价连接了葡萄糖的层析柱能用来从植物抽提液纯化植 物蛋白质刀豆素 A(图 3.5)。因为刀豆素 A 与葡萄糖的亲和性很高,而其他蛋白质与葡萄糖 的亲和性很低。植物蛋白抽提液流过这样的层析柱,只有刀豆素 A 结合到层析柱上,其它 蛋白质统统流出。然后用含有葡萄糖的层析溶液将将刀豆素 A 洗出。液相葡萄糖能替代固 相葡萄糖,使刀豆素 A 从固相洗下(图 3.5)。亲和层析也是分离转录因子的有效技术。转 录因子能够与特定 DNA 序列结合,调节基因转录(39 章和 31 章)。蛋白质混合物流过共价 交联了 DNA 的层析柱,那些与该 DNA 序列亲和性高的蛋白质组分将滞留在柱上。然后用 高浓度盐溶液将柱上结合的蛋白质洗出。 图 3.5 亲和层析。用交联了葡萄糖(G)的固相载体亲和层析纯化刀豆素 A(黄色)。 亲和层析纯化蛋白质的方法是(1)先将蛋白质识别的基团 X 或者 X 的衍生物共价交联 于固相载体上,然后将这种固相载体装入层析柱;(2)将蛋白质混合物流过这种亲和柱,并 用结合缓冲液洗涤除去不结合蛋白质;(3)用高浓度 X 溶液、或者用能够降低蛋白质与 X 亲和力的缓冲液洗柱,将目标蛋白质洗出。如果蛋白质与 X 分子(即诱饵分子)相互作用 具有高度特异性,那么亲和层析是一种非常有效地纯化蛋白质技术。 如果纯化重组蛋白质(5.2 节),也可以更改上述的亲和纯化方案。此时修改编码基因, 使基因还编码一段额外的氨基酸序列,这段额外的氨基酸序列充当充当亲和层析标签用于亲 和纯化。例如,一串组氨酸(即 His 标签)可以添加到表达蛋白质的 C-端或 N-端。有标签 的蛋白质流过共价交联了 Ni2+或其它金属离子的固相载体。His 标签与固相金属离子紧密结 合,导致表达蛋白质也与载体紧密结合。那些没有 His 标签的蛋白质不能与固相载体结合, 直接从亲和柱流出。加入咪唑或其它化学物质溶液,能够与金属离子结合从而将带有 His 标签的蛋白质洗出。 高压液相层析。高压液相层析是上述柱层析技术的加强型。层析柱的固相载体介质更细, 因此与蛋白质相互作用的位点更多,分辨率更高。由于载体介质更细,因此需要更大的压力 才能获得足量的流速。最终的结果是 HPLC 的分辨率高,分离所需的时间短(图 3.6)
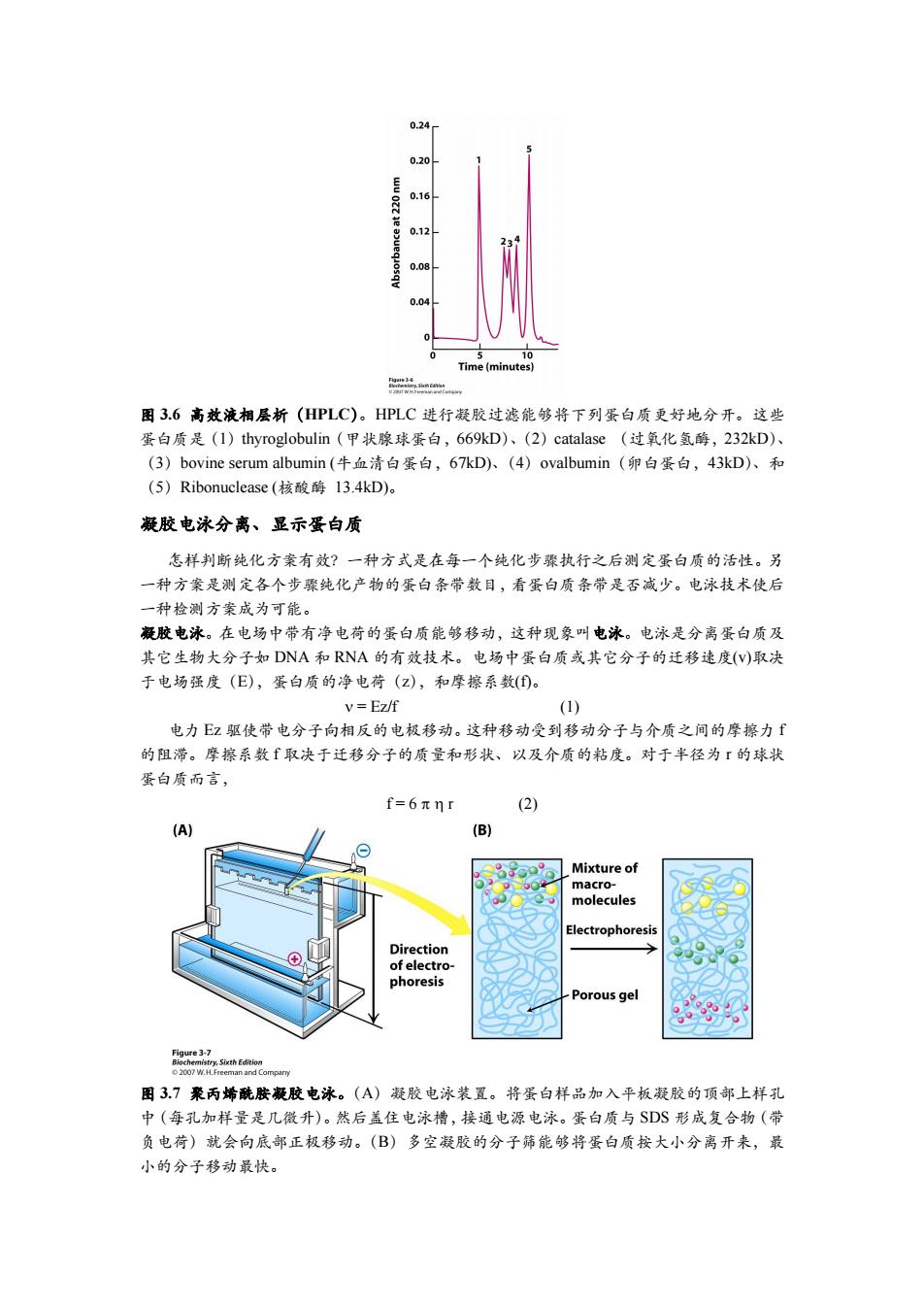
0.24 0.16 0.04 0 10 Time(minutes) e 图3.6高效液相层析(HPLC)。HPLC进行凝胶过滤能够将下列蛋白质更好地分开。这些 蛋白质是(1)thyroglobulin(甲状腺球蛋白,669kD)、(2)catalase(过氧化氢酶,232kD)、 (3)bovine serum albumin(牛血清白蛋白,67kD)、(4)ovalbumin(卵白蛋白,43kD)、和 (5)Ribonuclease(核酸酶13.4kD)。 凝胶电泳分离、显示蛋白质 怎样判断纯化方案有效?一种方式是在每一个纯化步骤执行之后测定蛋白质的活性。另 一种方案是测定各个步骤纯化产物的蛋白条带数目,看蛋白质条带是否减少。电泳技术使后 一种检测方案成为可能。 凝胶电泳。在电场中带有净电荷的蛋白质能够移动,这种现象叫电泳。电泳是分离蛋白质及 其它生物大分子如DNA和RNA的有效技术。电场中蛋白质或其它分子的迁移速度(V)取决 于电场强度(E),蛋白质的净电荷(Z),和摩擦系数()。 V=Ez/f (1) 电力z驱使带电分子向相反的电极移动。这种移动受到移动分子与介质之间的摩擦力「 的阻滞。摩擦系数f取决于迁移分子的质量和形状、以及介质的粘度。对于半径为「的球状 蛋白质而言, f=6πnr (2) (A) (B) Mixture of macro- molecules Electrophoresis Direction of electro- phoresis Porous gel Figure 3-7 mp 图3.7聚丙烯酰胺凝胶电泳。(A)凝胶电泳装置。将蛋白样品加入平板凝胶的顶部上样孔 中(每孔加样量是几微升)。然后盖住电泳槽,接通电源电泳。蛋白质与SDS形成复合物(带 负电荷)就会向底部正极移动。(B)多空凝胶的分子筛能够将蛋白质按大小分离开来,最 小的分子移动最快
图 3.6 高效液相层析(HPLC)。HPLC 进行凝胶过滤能够将下列蛋白质更好地分开。这些 蛋白质是(1)thyroglobulin(甲状腺球蛋白,669kD)、(2)catalase (过氧化氢酶,232kD)、 (3)bovine serum albumin (牛血清白蛋白,67kD)、(4)ovalbumin(卵白蛋白,43kD)、和 (5)Ribonuclease (核酸酶 13.4kD)。 凝胶电泳分离、显示蛋白质 怎样判断纯化方案有效?一种方式是在每一个纯化步骤执行之后测定蛋白质的活性。另 一种方案是测定各个步骤纯化产物的蛋白条带数目,看蛋白质条带是否减少。电泳技术使后 一种检测方案成为可能。 凝胶电泳。在电场中带有净电荷的蛋白质能够移动,这种现象叫电泳。电泳是分离蛋白质及 其它生物大分子如 DNA 和 RNA 的有效技术。电场中蛋白质或其它分子的迁移速度(v)取决 于电场强度(E),蛋白质的净电荷(z),和摩擦系数(f)。 = Ez/f (1) 电力 Ez 驱使带电分子向相反的电极移动。这种移动受到移动分子与介质之间的摩擦力 f 的阻滞。摩擦系数 f 取决于迁移分子的质量和形状、以及介质的粘度。对于半径为 r 的球状 蛋白质而言, f = 6 r (2) 图 3.7 聚丙烯酰胺凝胶电泳。(A)凝胶电泳装置。将蛋白样品加入平板凝胶的顶部上样孔 中(每孔加样量是几微升)。然后盖住电泳槽,接通电源电泳。蛋白质与 SDS 形成复合物(带 负电荷)就会向底部正极移动。(B)多空凝胶的分子筛能够将蛋白质按大小分离开来,最 小的分子移动最快
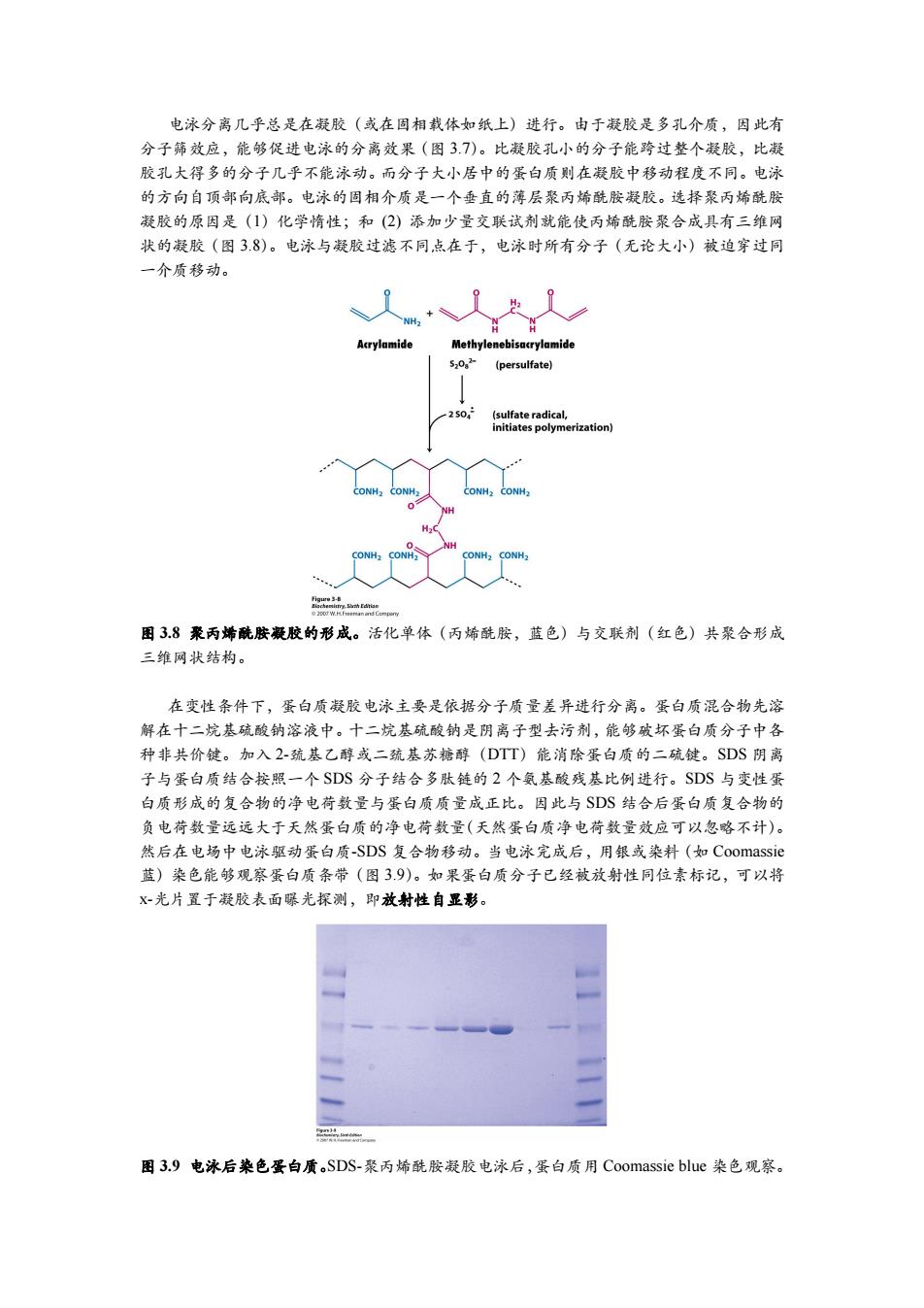
电泳分离几乎总是在凝胶(或在固相载体如纸上)进行。由于凝胶是多孔介质,因此有 分子筛效应,能够促进电泳的分离效果(图37)。比凝胶孔小的分子能跨过整个凝胶,比凝 胶孔大得多的分子几乎不能泳动。而分子大小居中的蛋白质则在凝胶中移动程度不同。电泳 的方向自顶部向底部。电泳的固相介质是一个垂直的薄层聚丙烯酰胺凝胶。选择聚丙烯酰胺 凝胶的原因是(1)化学惰性;和(2)添加少量交联试剂就能使丙烯酰胺聚合成具有三维网 状的凝胶(图38)。电泳与凝胶过滤不同点在于,电泳时所有分子(无论大小)被迫穿过同 一介质移动。 +人 Acrylamide Methylenebisacrylamide 5202 (persulfate) 2504 (sulfate radical, initiates polymerization) CONH2 CONH2 CONH2 CONH2 H CONH CONH2 CONH2 图3.8聚丙烯酰胺凝胶的形成。活化单体(丙烯酰胺,蓝色)与交联剂(红色)共聚合形成 三维网状结构。 在变性条件下,蛋白质凝胶电泳主要是依据分子质量差异进行分离。蛋白质混合物先溶 解在十二烷基硫酸钠溶液中。十二烷基硫酸钠是阴离子型去污剂,能够破坏蛋白质分子中各 种非共价键。加入2-巯基乙醇或二巯基苏糖醇(DTT)能消除蛋白质的二硫键。SDS阴离 子与蛋白质结合按照一个SDS分子结合多肽链的2个氨基酸残基比例进行。SDS与变性蛋 白质形成的复合物的净电荷数量与蛋白质质量成正比。因此与SDS结合后蛋白质复合物的 负电荷数量远远大于天然蛋白质的净电荷数量(天然蛋白质净电荷数量效应可以忽略不计)。 然后在电场中电泳驱动蛋白质-SDS复合物移动。当电泳完成后,用银或染料(如Coomassie 蓝)染色能够观察蛋白质条带(图39)。如果蛋白质分子已经被放射性同位素标记,可以将 X-光片置于凝胶表面曝光探测,即放射性自显彩。 图3.9电泳后染色蛋白质SDS-聚丙烯酰胺凝胶电泳后,蛋白质用Coomassie blue染色观察
电泳分离几乎总是在凝胶(或在固相载体如纸上)进行。由于凝胶是多孔介质,因此有 分子筛效应,能够促进电泳的分离效果(图 3.7)。比凝胶孔小的分子能跨过整个凝胶,比凝 胶孔大得多的分子几乎不能泳动。而分子大小居中的蛋白质则在凝胶中移动程度不同。电泳 的方向自顶部向底部。电泳的固相介质是一个垂直的薄层聚丙烯酰胺凝胶。选择聚丙烯酰胺 凝胶的原因是(1)化学惰性;和 (2) 添加少量交联试剂就能使丙烯酰胺聚合成具有三维网 状的凝胶(图 3.8)。电泳与凝胶过滤不同点在于,电泳时所有分子(无论大小)被迫穿过同 一介质移动。 图 3.8 聚丙烯酰胺凝胶的形成。活化单体(丙烯酰胺,蓝色)与交联剂(红色)共聚合形成 三维网状结构。 在变性条件下,蛋白质凝胶电泳主要是依据分子质量差异进行分离。蛋白质混合物先溶 解在十二烷基硫酸钠溶液中。十二烷基硫酸钠是阴离子型去污剂,能够破坏蛋白质分子中各 种非共价键。加入 2-巯基乙醇或二巯基苏糖醇(DTT)能消除蛋白质的二硫键。SDS 阴离 子与蛋白质结合按照一个 SDS 分子结合多肽链的 2 个氨基酸残基比例进行。SDS 与变性蛋 白质形成的复合物的净电荷数量与蛋白质质量成正比。因此与 SDS 结合后蛋白质复合物的 负电荷数量远远大于天然蛋白质的净电荷数量(天然蛋白质净电荷数量效应可以忽略不计)。 然后在电场中电泳驱动蛋白质-SDS 复合物移动。当电泳完成后,用银或染料(如 Coomassie 蓝)染色能够观察蛋白质条带(图 3.9)。如果蛋白质分子已经被放射性同位素标记,可以将 x-光片置于凝胶表面曝光探测,即放射性自显影。 图 3.9 电泳后染色蛋白质。SDS-聚丙烯酰胺凝胶电泳后,蛋白质用 Coomassie blue 染色观察

小蛋白质分子在凝胶中泳动快,大蛋白质分子泳动慢。在这些条件下,大多数多肽链的 迁移率与蛋白质质量的对数值成线性关系(图310)。有些雷含糖的蛋白质或膜蛋白不服从 这个经验公式,SDS-凝胶电泳(通常叫SDS-PAGE)速度快、灵敏度高、分辨率高。用Coomassie 蓝染色能检测出01g的蛋白质条带,用银染色甚至能够检测出0.02μg以下的蛋白质条带。 分子质量差异只有2%的蛋白质(如50kD和51kD,长度只有10个氨基酸)就能用凝胶电 泳区分。 用电泳检测我们能够确定纯化方案的效益。起始组分将有几十甚至几百个蛋白质条带。 随着纯化操作的进行,蛋白质条带会消失,只有一条蛋白质条带强度逐步增加。这个条带就 是我们所需要的蛋白质条带。 10 60 50 40- 30- 20 1000.20.40.60.8.0 Relative mobility 5二n 图3.10电泳能够测定蛋白质分子质量。很多蛋白质在SDS-聚丙烯酰胺凝胶的电泳迁移率与 蛋白分子质量的对数值负相关。 等电聚焦依据蛋白质酸性氨基酸残基和碱性氨基酸残基相对含量的差异也能将蛋白质分 开。蛋白质等电点()是蛋白质分子净电荷为零时溶液的pH值。此时,蛋白质在电场中不 泳动。例如细胞色素c的等电点是10.6,而血清白蛋白的等电点是4.8.。无需SDS,直接用 pH梯度凝胶电泳分离这些蛋白混合物。每个蛋白质将移动到介质pH值等于自身l值处。 依据蛋白质等电,点分离蛋白质的方法叫等电聚焦(isoelectric focusing)。将具有不同等电,点 的两性电解质(聚合物)混合液加入凝胶,能够形成pH梯度。等电聚焦电泳能够将pl值 差异只有0.01%的蛋白质分开,即净电荷差异只有一个的蛋白质也能分开(图311)。 (A) Low pH High pH (+) - (B) Low pH High pH (+) (-) 图3.11等电聚焦原理。上样之前凝胶已经形成pH梯度。(A)上样后,施加电压使带电离 子泳动。蛋白质会泳动至自身等电点,此时蛋白质没有净电荷。(B)切下蛋白条带,用于 后续实验
小蛋白质分子在凝胶中泳动快,大蛋白质分子泳动慢。在这些条件下,大多数多肽链的 迁移率与蛋白质质量的对数值成线性关系(图 3.10)。有些富含糖的蛋白质或膜蛋白不服从 这个经验公式。SDS-凝胶电泳(通常叫SDS-PAGE)速度快、灵敏度高、分辨率高。用 Coomassie 蓝染色能检测出 0.1 g 的蛋白质条带,用银染色甚至能够检测出 0.02 g 以下的蛋白质条带。 分子质量差异只有 2%的蛋白质(如 50 kD 和 51kD, 长度只有 10 个氨基酸)就能用凝胶电 泳区分。 用电泳检测我们能够确定纯化方案的效益。起始组分将有几十甚至几百个蛋白质条带。 随着纯化操作的进行,蛋白质条带会消失,只有一条蛋白质条带强度逐步增加。这个条带就 是我们所需要的蛋白质条带。 图 3.10 电泳能够测定蛋白质分子质量。很多蛋白质在 SDS-聚丙烯酰胺凝胶的电泳迁移率与 蛋白分子质量的对数值负相关。 等电聚焦 依据蛋白质酸性氨基酸残基和碱性氨基酸残基相对含量的差异也能将蛋白质分 开。 蛋白质等电点(pI)是蛋白质分子净电荷为零时溶液的 pH 值。此时,蛋白质在电场中不 泳动。例如细胞色素 c 的等电点是 10.6,而血清白蛋白的等电点是 4.8.。无需 SDS,直接用 pH 梯度凝胶电泳分离这些蛋白混合物。每个蛋白质将移动到介质 pH 值等于自身 pI 值处。 依据蛋白质等电点分离蛋白质的方法叫等电聚焦(isoelectric focusing)。将具有不同等电点 的两性电解质(聚合物)混合液加入凝胶,能够形成 pH 梯度。等电聚焦电泳能够将 pI 值 差异只有 0.01%的蛋白质分开,即净电荷差异只有一个的蛋白质也能分开(图 3.11)。 图 3.11 等电聚焦原理。上样之前凝胶已经形成 pH 梯度。(A)上样后,施加电压使带电离 子泳动。蛋白质会泳动至自身等电点,此时蛋白质没有净电荷。(B)切下蛋白条带,用于 后续实验

二维电泳等电聚焦和SDS-PAGE结合能获得非常高的分辨效率。样品先用等电聚焦分离, 然后将一等电聚焦条水平放置于$DS聚丙烯酰胺凝胶顶部,沿与聚焦条垂直的方向电泳, 使蛋白质分布于二维面。因此水平方向的电泳分离基础是是蛋白质等电点差异,垂直方向分 离的基础是蛋白质质量的差异。用二维电泳分离大肠杆菌蛋白质抽提液,一次能获得一千多 个蛋白质凝胶电泳,点(图3.12)。 Low pH Isoelectric focusing (+) 图3.12二维凝胶电泳。(A)蛋白样品先用等电聚焦电泳分离(方法与311相同)。然后将 等电聚焦后的凝胶置于SDS-凝胶顶部,沿原来分离方向垂直的方向进行电泳。电泳分离的 基础是蛋白质的分子量。(B)用二维凝胶电泳分离大肠杆菌抽提液,能分离出一千多种蛋 白质。第一相是水平方向进行等电聚焦(根据等电点差异),第二相(垂直方向)进行SDS- 聚丙烯酰胺凝胶电泳(根据分子质量差异)。 可以用二维凝胶电泳分离不同生理状态细胞的蛋白质。在应对细胞生理状态变化时,某 一蛋白质含量会升高或降低。我们怎样鉴定出应答这种变化的蛋白质呢?尽管二维凝胶有很 多蛋白质样品点,但是各个样品点的本质还不清楚。将二维凝胶电泳与质谱分析技术相结合 能够鉴定各个蛋白点的本质。在3.5节我们将简单介绍这些技术。 蛋白纯化方案的定量评估 为了保证蛋白纯化方案是可行的,要测定每个纯化步骤纯化产物的比活性,并进行 SDS-PAGE分析。表3.1和图3.13列出了纯化一个虚构蛋白质各个步骤所获得的结果。在纯 化的每个步骤都要测定下列参数: 总蛋白:从纯化液中取出一定体积溶液测定蛋白浓度,该浓度与溶液总体积的乘积就是溶液 的总蛋白量。 总活性:从纯化液中取出一定体积溶液测定蛋白活性,该活性数据与溶液总体积的乘积就是 溶液的总蛋白活性。 比活性:蛋白的总活性与总蛋白量的比值。 产率:该参数用来衡量纯化操作保留了多少蛋白活性(与初抽提液相比)。初抽提液活性定 义为100%。 纯化水平:每步纯化后蛋白质的比活性与初抽提液比活性的比值。这个数值愈大表明蛋白质 纯度愈高
二维电泳 等电聚焦和 SDS-PAGE 结合能获得非常高的分辨效率。样品先用等电聚焦分离, 然后将一等电聚焦条水平放置于 SDS-聚丙烯酰胺凝胶顶部,沿与聚焦条垂直的方向电泳, 使蛋白质分布于二维面。因此水平方向的电泳分离基础是是蛋白质等电点差异,垂直方向分 离的基础是蛋白质质量的差异。用二维电泳分离大肠杆菌蛋白质抽提液,一次能获得一千多 个蛋白质凝胶电泳点(图 3.12)。 图 3.12 二维凝胶电泳。(A)蛋白样品先用等电聚焦电泳分离(方法与 3.11 相同)。然后将 等电聚焦后的凝胶置于 SDS-凝胶顶部,沿原来分离方向垂直的方向进行电泳。电泳分离的 基础是蛋白质的分子量。(B)用二维凝胶电泳分离大肠杆菌抽提液,能分离出一千多种蛋 白质。第一相是水平方向进行等电聚焦(根据等电点差异),第二相(垂直方向)进行 SDS- 聚丙烯酰胺凝胶电泳(根据分子质量差异)。 可以用二维凝胶电泳分离不同生理状态细胞的蛋白质。在应对细胞生理状态变化时,某 一蛋白质含量会升高或降低。我们怎样鉴定出应答这种变化的蛋白质呢?尽管二维凝胶有很 多蛋白质样品点,但是各个样品点的本质还不清楚。将二维凝胶电泳与质谱分析技术相结合 能够鉴定各个蛋白点的本质。在 3.5 节我们将简单介绍这些技术。 蛋白纯化方案的定量评估 为了保证蛋白纯化方案是可行的,要测定每个纯化步骤纯化产物的比活性,并进行 SDS-PAGE 分析。表 3.1 和图 3.13 列出了纯化一个虚构蛋白质各个步骤所获得的结果。在纯 化的每个步骤都要测定下列参数: 总蛋白:从纯化液中取出一定体积溶液测定蛋白浓度,该浓度与溶液总体积的乘积就是溶液 的总蛋白量。 总活性:从纯化液中取出一定体积溶液测定蛋白活性,该活性数据与溶液总体积的乘积就是 溶液的总蛋白活性。 比活性:蛋白的总活性与总蛋白量的比值。 产率:该参数用来衡量纯化操作保留了多少蛋白活性(与初抽提液相比)。初抽提液活性定 义为 100%。 纯化水平:每步纯化后蛋白质的比活性与初抽提液比活性的比值。这个数值愈大表明蛋白质 纯度愈高