
§3原电池和电解池 一、原电他和电解他 导体:能导电的物质。 ▲电子导体:靠自由电子的定向运动而导电,导 电过程中自身不发生化学变化。 温度升高,导电能力降低。 金属、石墨、金属化合物,etc ▲离子导体:依靠离子的定向移动(迁移)而导 电。温度升高,导电能力升高。 电解质溶液、熔融电解质,etc
§3 原电池和电解池 一、原电池和电解池 导体:能导电的物质。 ▲ 电子导体:靠自由电子的定向运动而导电,导 电过程中自身不发生化学变化。 温度升高,导电能力降低。 金属、石墨、金属化合物,etc. ▲ 离子导体:依靠离子的定向移动(迁移)而导 电。温度升高,导电能力升高。 电解质溶液、熔融电解质,etc

两个化学电极(金属类导体/电解质溶液)电池 电流通过:正、负离子定向移动,到界面处发生 氧化/还原反应。 物理现象:电流、电阻; 化学现象:氧化还原反应 原电池:化学能→电能 电池 电解池:电能→化学能 二、原电池和电解池的组成 1.电解池
→ → 电解池:电能 化学能 原电池:化学能 电能 电池 两个化学电极(金属类导体 / 电解质溶液) → 电池 电流通过:正、负离子定向移动,到界面处发生 氧化/还原反应。 物理现象:电流、电阻; 化学现象:氧化/还原反应 二、原电池和电解池的组成 1. 电解池
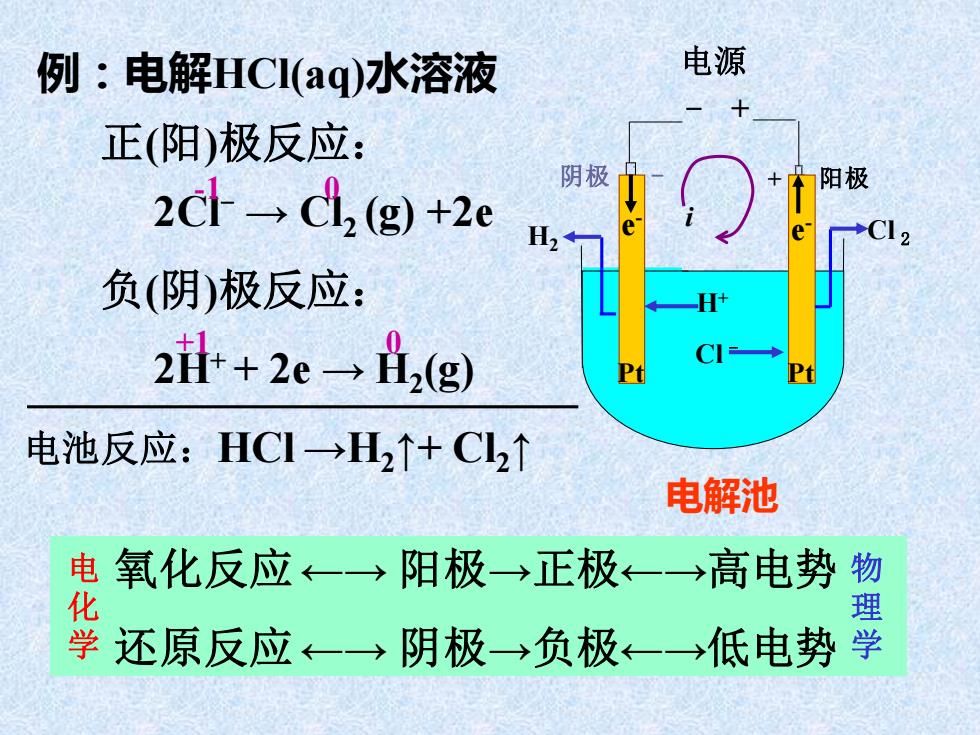
例:电解HCl(aq)水溶液 电源 正(阳)极反应: 2dl→d2(g)+2e 阴极 阳极 H2 负(阴)极反应: 2l+2c-→h,(g) 电池反应:HCI→H2↑+C2↑ 电解池 电氧化反应←一→阳极→正极←一→高电势物 学还原反应←→阴极→负极←→低电势学
例:电解HCl(aq)水溶液 阴极 - + 阳极 多 孔 隔 膜 Cl - - + 电源 H+ 电解池 Pt Pt i Cl e 2 e - - H2 正(阳)极反应: 2Cl- → Cl2 (g) +2e 负(阴)极反应: 2H+ + 2e → H2 (g) 电池反应:HCl →H2↑+ Cl2↑ -1 0 +1 0 氧化反应←→ 阳极→正极←→高电势 还原反应←→ 阴极→负极←→低电势 电 化 学 物 理 学
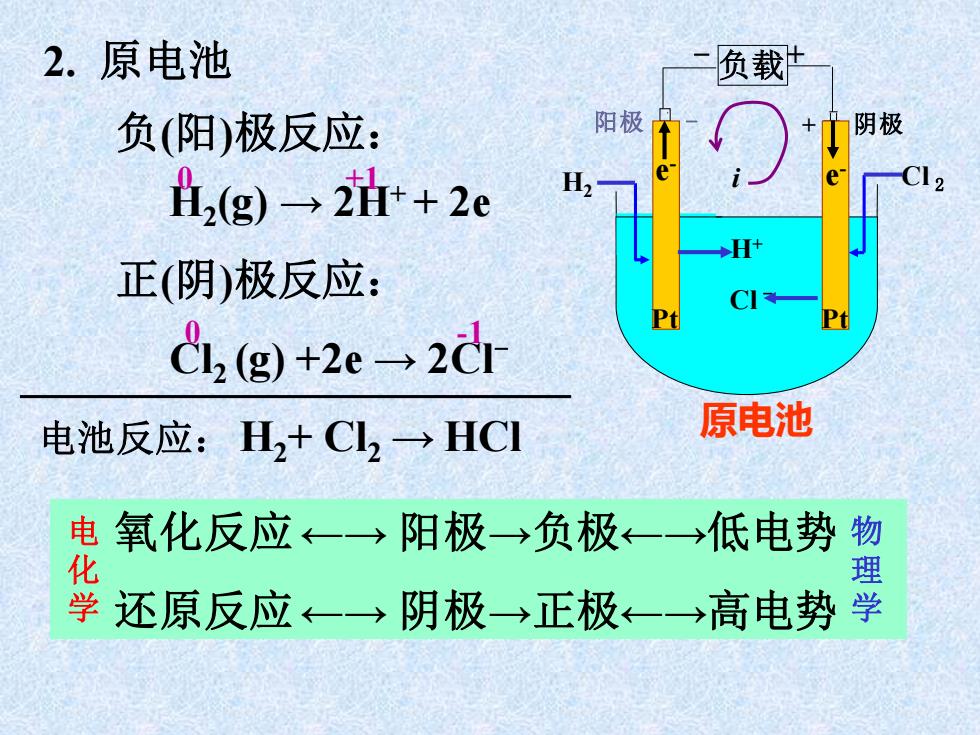
2.原电池 负载 负(阳)极反应: 阳极 阴极 h,(g)→2i+2c H H 正(阴)极反应: CI CL,g+2e→2d Pt 电池反应:H2+Cl2→HCI 原电池 电氧化反应←一→阳极→负极←-→低电势 物 学还原反应←一→阴极→正极←一→高电势学
阳极 - + 阴极 多 孔 隔 膜 Cl - - 负载+ H+ 原电池 Pt Pt i Cl e 2 e - - H2 负(阳)极反应: H2 (g) → 2H+ + 2e 正(阴)极反应: Cl2 (g) +2e → 2Cl- 电池反应: H2+ Cl2 → HCl 0 +1 0 -1 2. 原电池 氧化反应←→ 阳极→负极←→低电势 还原反应←→ 阴极→正极←→高电势 电 化 学 物 理 学

正极:电解时→氧化反应,原电池一→还原反应 负极:电解时一还原反应,原电池一氧化反应; 一般,讨论原电池多用物理学规定(正、负极) 讨论电解池多用电化学规定(阴、阳极) 3.电解质溶液的导电步骤 ■离子的定向移动(迁移); ■通过两电极上的氧化0还原反应维持可持续 的迁移
正极:电解时→氧化反应,原电池→还原反应; 负极:电解时→还原反应,原电池→氧化反应; 一般,讨论原电池多用物理学规定(正、负极) 讨论电解池多用电化学规定(阴、阳极) 3. 电解质溶液的导电步骤 ■ 离子的定向移动(迁移); ■ 通过两电极上的氧化or还原反应维持可持续 的迁移