
例:K2MnO4、KMnO4、Cr20,2、HC1O中各原 子的氧化数各为多少? 化合价:整数 氧化数:整数、分数,可能超过化合价的值。 决定电子得失数,如:Fe3O4一FeO Fe:+(8/3)→+2,(83)-2=23,3×(23)=2 Fe304+2e+2H+==3Fe0+H0 氧化数高的状态:氧化态 氧化数低的状态:还原态
例:K2MnO4、KMnO4、Cr2O7 2-、HClO中各原 子的氧化数各为多少? 化合价:整数 氧化数:整数、分数,可能超过化合价的值。 决定电子得失数,如:Fe3O4→ FeO Fe:+(8/3) → +2 , (8/3) -2 = 2/3 , 3×(2/3) = 2 Fe3O4 + 2e - + 2H+ === 3FeO +H2O 氧化数高的状态:氧化态 氧化数低的状态:还原态
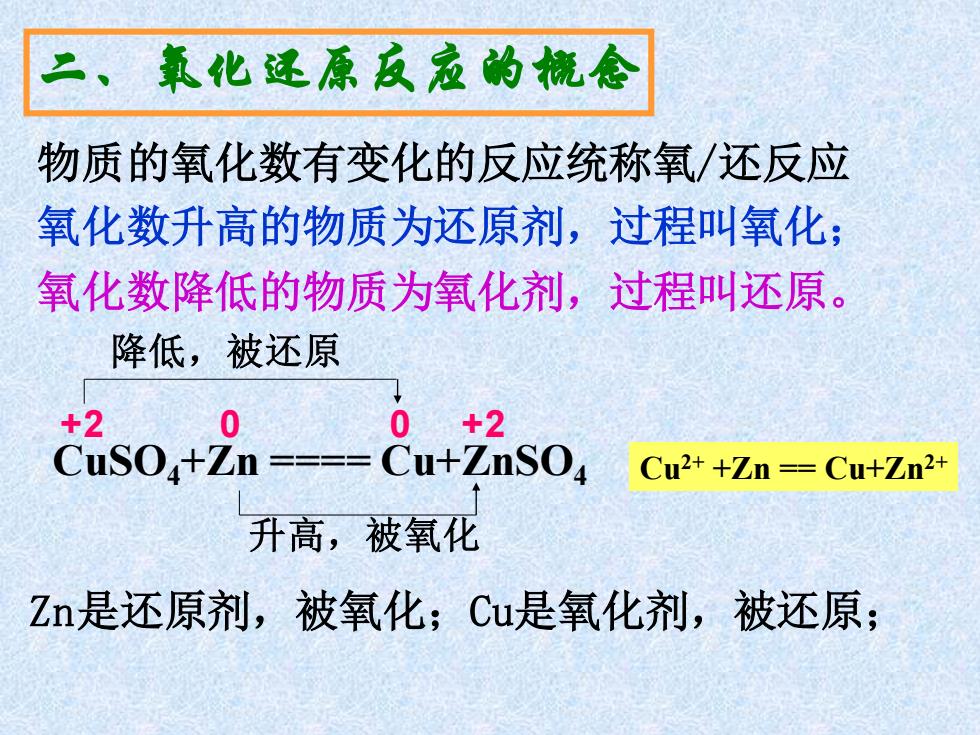
二、氧化还原反孟的橇念 物质的氧化数有变化的反应统称氧/还反应 氧化数升高的物质为还原剂,过程叫氧化; 氧化数降低的物质为氧化剂,过程叫还原。 降低,被还原 品s0+n—8u+孟so Cu2++Zn =Cu+Zn2+ 升高,被氧化 Zn是还原剂,被氧化;Cu是氧化剂,被还原;
CuSO4+Zn ==== Cu+ZnSO4 +2 0 0 +2 降低,被还原 升高,被氧化 二、氧化还原反应的概念 物质的氧化数有变化的反应统称氧/还反应 氧化数升高的物质为还原剂,过程叫氧化; 氧化数降低的物质为氧化剂,过程叫还原。 Zn是还原剂,被氧化;Cu是氧化剂,被还原; Cu2+ +Zn == Cu+Zn2+

三、氧化还原友方程式的配平 原则:物质守恒,电荷守恒 1.氧化数法:熟悉 2.离子-电子法:分别配平氧化、还原反应 对于水溶液反应的配平问题: 若方程式两边的电荷无法平衡时,可以 用H或OH补充! 对于氧化数法难以配平的反应,离子-电子法 可能比较方便
三、氧化还原反应方程式的配平 1. 氧化数法:熟悉 2. 离子-电子法:分别配平氧化、还原反应 对于水溶液反应的配平问题: 若方程式两边的电荷无法平衡时,可以 用H+或OH-补充! 对于氧化数法难以配平的反应,离子-电子法 可能比较方便。 原则:物质守恒,电荷守恒

例 离子·电子法配平碱液吸收氯气的反应 方程式。 (1)写出离子反应式: Cl2+OH→CI03+C (2)将反应写成两个半反应: 氧化反应:C2+OH→C1O3 还原反应:C2→C (3)配平半反应两端的原子数和电荷数: 0.5C2+60H→CI03+5e+3H20 0.5Cl2+e→C
例 离子-电子法配平碱液吸收氯气的反应 方程式。 (1)写出离子反应式: Cl2 + OH- →ClO3 - + Cl- (2)将反应写成两个半反应: 氧化反应: Cl2 + OH- →ClO3 - 还原反应: Cl2 → Cl- (3)配平半反应两端的原子数和电荷数: 0.5Cl2 + 6OH- →ClO3 - + 5e - + 3H2O 0.5 Cl2 + e- → Cl-

(4)根据得失电子数相等原则,配平两个 半反应,并合并为一个离子方程式: 0.5CL2+60H→C103+5e+3H20 ×1 +)0.5Cl2+e→C ×5 Cl2+60H→CI103+5C+3H20 (5)改写成分子方程式: Cl,6NaOH===NaCIO3+5NaCI 3H,O 配半反应式两边氧原子数不等时: 酸性介质中,在多氧的一边加H+,少氧的一边加水: 巧 碱性介质中,在多氧的一边加水,少氧的一边加水H+
(4)根据得失电子数相等原则,配平两个 半反应,并合并为一个离子方程式: (5)改写成分子方程式: ×1 ×5 0.5Cl2 + 6OH- →ClO3 - + 5e- + 3H2O 0.5Cl2 + e- → Cl- +) Cl2 + 6OH- →ClO3 - + 5Cl- + 3H2O Cl2 + 6NaOH === NaClO3 + 5NaCl + 3H2O 配 平 技 巧 半反应式两边氧原子数不等时: 酸性介质中,在多氧的一边加H+ ,少氧的一边加水; 碱性介质中,在多氧的一边加水,少氧的一边加水H+